
新型冠状病毒肺炎(NCP)于2019年12月由武汉开始发展至全国各地,其防控工作是当前医务人员的首要任务。现报道3例NCP患者治疗后咽拭子病毒核酸转阴性,粪便核酸检测仍呈阳性。鉴于2019新型冠状病毒(2019-nCoV)与严重急性呼吸综合征(SARS)病毒高度同源、临床表现相似,参考SARS防治的经验,建议在诊治过程中重视粪便核酸检测情况。推荐粪便核酸检测结果作为解除隔离和出院标准的参考,以最大限度地降低消化道传播风险。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
中山大学附属第三医院粤东医院是广东省梅州市收治新型冠状病毒肺炎(novel coronavirus pneumonia,NCP)定点医院之一,截至2020年2月11日共收治7例确诊病例,其中3例患者咽拭子2019新型冠状病毒(2019 novel coronavirus,2019-nCoV)核酸检测转阴后粪便核酸检测仍呈阳性,现报告如下。
例1 患者男,28岁,因咳嗽、咳痰1周,加重伴胸闷半天,于2020年1月25日收住隔离病房。该患者为武汉市人,入院1周前无明显诱因出现咳嗽、咯白痰,无流涕、鼻塞,无发热、畏寒,无呼吸困难,1月23日曾于武汉市中心医院就诊,查血常规示白细胞计数为3.3×109/L,淋巴细胞占比为0.515,超敏CRP为10.2 mg/L,予口服左氧氟沙星片0.4 g(1次/d)和对症处理,患者自觉无好转。次日患者乘动车从武汉到达广东省梅州市,半天后开始出现咳嗽加重,伴有胸闷、冷汗、头痛、乏力,无气促、腹痛、腹泻,急诊收入中山大学附属第三医院粤东医院。入院后查血常规、血液生物化学指标、凝血4项、D-二聚体、CRP、降钙素原均未见异常。胸部CT检查考虑双下肺炎症。咽拭子送梅州市疾病预防控制中心和广东省疾病预防控制中心检测2019-nCoV核酸均呈阳性。患者入院后伴有低热,体温<38.0 ℃,予口服洛匹那韦利托那韦片500 mg、奥司他韦胶囊75 mg(2次/d)抗病毒和静脉滴注莫西沙星注射液0.4 g(1次/d)抗细菌等治疗,患者咳嗽、咯痰症状缓解。1月26日停用莫西沙星、奥司他韦。1月28日起无发热,体温≤36.8 ℃。1月27、30日,咽拭子2019-nCoV核酸检测均呈阳性。1月30日,患者解黄褐色水样便,4~5次/d,予口服枯草杆菌二联活菌肠溶胶囊250 mg(2次/d)、口服蒙脱石散3 g(3次/d)治疗。1月31日,咽拭子经医院和梅州市疾病预防控制中心检测2019-nCoV核酸均呈阴性。2月1日,经医院专家组讨论研究,不排除2019-nCoV感染导致的腹泻,继续原治疗方案并留取粪便。粪便经核酸检测,结果呈2019-nCoV阳性,次日复查仍呈阳性。2月3日,患者腹泻症状缓解,粪便核酸检测转阴。2月5、7日连续复查粪便核酸检测均呈阴性,同时咽拭子核酸检测亦呈阴性,于2月7日出院。
例2 患者男,62岁,因咽痛8 d,发热2 d于2020年2月2日收住隔离病房。患者长期居住在武汉,1月21日从武汉出发,当晚到达广东省梅州市。1月25日开始出现咽痛,伴流涕、鼻塞,自觉腰背部不适和疲乏酸软感,曾到当地卫生站就诊,口服感冒药治疗,症状未见改善。1月30日出现发热,体温37.8 ℃,间有咳嗽、头晕,急诊至外院住院治疗,胸部CT检查提示双肺广泛斑片状磨玻璃密度影,考虑病毒性肺炎;右肺中外侧段小结节,考虑增殖性结节。在外院住院期间予口服奥司他韦75 mg、左氧氟沙星0.2 g(2次/d)治疗,发热持续,最高达38.0 ℃。2月1日咽拭子检测2019-nCoV核酸呈阳性,遂转入中山大学附属第三医院粤东医院进一步隔离治疗。患者有2型糖尿病病史3年,长期口服二甲双胍。入院后查血常规示白细胞计数为2.4×109/L,淋巴细胞绝对值为0.44×109/L,血小板计数为84×109/L,ESR为98 mm/1 h,CRP水平为48 mg/L,白蛋白水平为33.8 g/L,TBil水平为25.6 μmol/L,间接胆红素水平为16.6 μmol/L,ALT水平为53 U/L,AST水平为55 U/L,磷酸肌酸激酶水平为275 U/L,LDH水平为318 U/L,血清钠水平为122 μmol/L,血糖水平为16.98 mmol/L,D-二聚体水平为244 μg/L,凝血4项和降钙素原未见异常。予吸氧,口服洛匹那韦利托那韦片500 mg、奥司他韦胶囊75 mg(2次/d),静脉滴注莫西沙星0.4 g、人免疫球蛋白20 g、甲泼尼龙琥珀酸钠40 mg(2次/d),控制血糖、维持水电解质平衡等治疗。该患者住院期间均无胃肠道症状,但为了解NCP患者中粪便2019-nCoV核酸检测情况,医院常规行粪便核酸检测。2月3日患者咽痛、发热症状缓解。2月2、5日分别行咽拭子和粪便2019-nCoV核酸检测,结果均呈阴性。2月8日咽拭子核酸检测呈阴性,粪便核酸检测呈阳性。2月10日咽拭子和粪便核酸检测均呈阴性。2月10日患者肺部CT复查肺炎有进展,至截稿仍在观察治疗中。
例3 患者女,25岁,因咽痛1 d于2020年2月2日收住隔离病房。患者长期居住武汉市,1月20日与其哥哥(1月25日确诊为NCP病例)乘坐飞机从武汉经广州至广东省梅州市,之后自行在家隔离无外出,与其父母同住(其母亲2月4日确诊为NCP,其父亲至截稿时未发病)。1月25日至当地医院行CT检查,提示肺部少许炎症,遂在当地医院隔离,咽拭子2019-nCoV病毒核酸检测呈阴性。2月1日患者出现咽痛,无发热、咳嗽、咳痰、腹泻等不适,2月2日当地疾病预防控制中心咽拭子2019-nCoV核酸检测呈阳性,转入中山大学附属第三医院粤东医院进一步隔离治疗。入院后查血常规、血液生物化学指标、凝血4项、D-二聚体、CRP、降钙素原均未见异常。胸部CT检查示双肺散在少许炎症。入院后予口服洛匹那韦利托那韦片500 mg、奥司他韦胶囊75 mg(2次/d)治疗,2月4日出现粪便次数增多,为黄色稀便,3次/d,予口服枯草杆菌二联活菌肠溶胶囊250 mg(2次/d)、口服蒙脱石散3 g(3次/d)治疗后症状缓解。2月6、8、10日咽拭子2019-nCoV核酸检测均呈阴性,2月3、7、8、10、11日粪便核酸检测均呈阳性。2月10日复查胸部CT示双肺散在少许炎症,较前吸收,至截稿仍在观察治疗中。
3例患者的咽拭子、粪便核酸检测情况汇总见表1,连续2次(隔日检测)的咽拭子2019-nCoV核酸检测转阴性后,粪便核酸检测仍呈阳性。
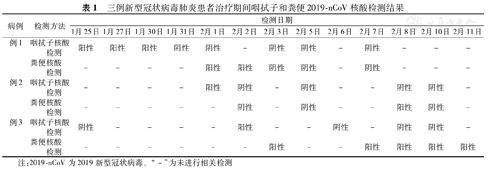
三例新型冠状病毒肺炎患者治疗期间咽拭子和粪便2019-nCoV核酸检测结果
三例新型冠状病毒肺炎患者治疗期间咽拭子和粪便2019-nCoV核酸检测结果
| 病例 | 检测方法 | 检测日期 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1月25日 | 1月27日 | 1月30日 | 1月31日 | 2月1日 | 2月2日 | 2月3日 | 2月5日 | 2月6日 | 2月7日 | 2月8日 | 2月10日 | 2月11日 | ||
| 例1 | 咽拭子核酸检测 | 阳性 | 阳性 | 阳性 | 阴性 | 阴性 | - | 阴性 | 阴性 | - | 阴性 | - | - | - |
| 粪便核酸检测 | - | - | - | - | 阳性 | 阳性 | 阴性 | 阴性 | - | 阴性 | - | - | - | |
| 例2 | 咽拭子核酸检测 | - | - | - | - | 阳性 | 阴性 | - | 阴性 | - | - | 阴性 | 阴性 | - |
| 粪便核酸检测 | - | - | - | - | - | 阴性 | - | 阴性 | - | - | 阳性 | 阴性 | - | |
| 例3 | 咽拭子核酸检测 | 阴性 | - | - | - | - | 阳性 | - | - | 阴性 | - | 阴性 | 阴性 | - |
| 粪便核酸检测 | - | - | - | - | - | - | 阳性 | - | - | 阳性 | 阳性 | 阳性 | 阳性 | |
注:2019-nCoV为2019新型冠状病毒。"-"为未进行相关检测
2019-nCoV近期在国内暴发疫情,具备人传人能力,严重威胁广大人民健康[1]。从病毒学的角度来看,其与严重急性呼吸综合征(severe acute respiratory syndrome,SARS)病毒同属于β属的冠状病毒,基础研究表明两者高度同源,基因组学相似度高[2,3]。进一步的研究发现,两者都通过血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)受体进入细胞[4,5],这意味着两者有相同的致病基础。ACE2受体除了在肺部AT2细胞高表达外,在食管、回结肠、直肠等消化道的上皮细胞表面也有表达。有研究表明,回肠和结肠的ACE2受体表达水平甚至高于肺部[6]。回顾SARS的文献资料,SARS病毒除累及肺部外,肠道也是累及器官。Leung等[7]通过研究1例腹泻患者的肠道活组织检查标本和5例死亡患者尸体解剖的肠道标本,发现所有6例患者的标本都可以观察到肠道上皮细胞内质网扩张,细胞内存在包裹病毒颗粒的囊泡,肠道绒毛上皮细胞表面可见成簇的病毒颗粒,提示存在病毒感染后出胞现象。值得注意的是,在他们的研究中5例患者的小肠标本可以分离出病毒株,其中4例为尸体解剖标本。在未能分离出病毒的尸体解剖小肠标本中,病毒核酸检测呈阳性。在5例尸体解剖标本中,只有2例在肠道以外的器官(肺部标本)能够分离出病毒株。这些结果提示SARS病毒具有嗜肠道特性,肠道是其重要的增殖场所。Huang等[8]回顾性分析了41例NCP患者的诊治过程,发现NCP的临床特征与SARS非常相似,危重型患者均存在急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),部分NCP患者也存在腹泻症状,故呼吁检测粪便样本以排除潜在的传播途径。2020年1月31日,《新英格兰医学杂志》报道美国首例确诊NCP患者存在消化道症状,粪便样本2019-nCoV核酸检测呈阳性[9],这是最早的粪便检测出2019-nCoV核酸的报道。中山大学附属第三医院粤东医院收治的7例NCP病例中,3例患者在咽拭子2019-nCoV核酸转阴后,粪便核酸仍呈阳性,占42.86%。基于病毒结构高度相似和通过相同受体入侵细胞,结合当前所获得的临床资料,推测2019-nCoV与SARS病毒可能具有类似的嗜肠道特性,粪便核酸阳性的检测结果需要引起高度重视。该3例患者粪便核酸阳性持续时间长短不一,存在个体差异(表1)。病例2无腹泻等肠道感染症状,粪便2019-nCoV核酸检测亦呈阳性。上述结果均提示,咽拭子与粪便的核酸阴转时间不同步,因此NCP患者除常规咽拭子2019-nCoV核酸检测外,还需重视采集粪便进行病毒核酸检测。
SARS流行期间曾在中国香港地区发生1起因患者排泄物导致大规模社区感染的事件,1例腹泻的SARS患者到访某住宅区亲戚家,期间使用了2次卫生间。最后因为大楼排污系统问题,导致该小区321人感染,42人死亡[10]。该事件表明SARS患者的粪便排泄物具有一定传染性,若处置不当,在特定的条件下可诱发社区感染。吸取该经验教训,在防控NCP期间除了做好戴口罩、勤洗手的健康教育外[11],还需要正确处理确诊患者的排泄物,检视老旧小区的排污系统,这在疫区可能更为重要。
2020年2月4日国家卫生健康委办公厅和国家中医药管理局办公室联合下发《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》[12],其中解除隔离和出院标准为:体温恢复正常3 d以上,呼吸道症状明显好转,肺部影像学明显吸收,连续2次呼吸道病原体核酸检测呈阴性(采样时间至少间隔1 d)。中山大学附属第三医院粤东医院收治的7例患者中有3例患者咽拭子2019-nCoV核酸转阴,但是粪便核酸检测仍呈阳性。现有的基础和临床研究都提示2019-nCoV与SARS病毒高度相似,因此借鉴SARS的防控经验,笔者认为对于符合上述标准的患者是否增加连续2次粪便隔天核酸检测阴性作为解除隔离和出院的标准,需要更多的临床病例来证实。
所有作者均声明不存在利益冲突



























