
钙化性纤维性肿瘤(CFT)是一种罕见的软组织良性纤维性肿瘤,临床少见,胃内病变更为罕见,目前报道不足100例。现报道2例胃CFT患者的临床资料,并回顾分析39篇文献中行超声内镜检查的23例CFT患者(含本组2例CFI患者)的资料,总结其超声内镜特点,期望对临床医师诊治胃CFT提供借鉴。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
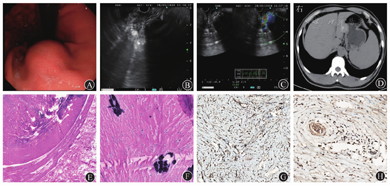
例1 患者男,38岁,因"上腹痛1个月,恶心、呕吐>10 d"于2018年4月8日入院。既往癫痫病史6年,经药物治疗病情稳定,肾结石病史3年。入院体格检查示中上腹压痛。入院后实验室检查示血红蛋白水平为141 g/L,白蛋白水平为42.88 g/L,甲胎蛋白、CA19-9、癌胚抗原均未见异常,肝炎全套和免疫相关检查均为阴性,免疫球蛋白(immunoglobulin,Ig)G4水平为0.39 g/L。2018年3月28日胃镜和超声内镜检查示胃体下部黏膜下肿物,大小约30 mm×30 mm,表面黏膜光滑(图1A);胃体隆起部呈低回声改变,内部回声不均匀,近胃腔侧可见片状高回声改变,后方见声影、边界欠清晰,向腔内外凸出,起源于固有肌层,横截面大小约20 mm×20 mm(图1B);多普勒超声检查未见明显血流信号;弹性成像提示质地偏硬(图1C)。入院后上腹部CT检查示胃体小弯侧见团块状软组织密度影,凸向腔外生长,边界较清晰,横截面大小约22 mm×27 mm,密度不均,其内见多发结节状钙质密度影,平均CT值约为75 HU(图1D)。初步诊断为胃体黏膜下肿物(间质瘤可能)、癫痫、肾结石。于2018年4月11日行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)治疗,剥离病变过程中发现浆膜面较大血管显露,出血风险较大,转胃肠外科行胃楔形切除术。术后病理提示胃体肿瘤位于固有肌层,为梭形细胞肿瘤(图1E),肿瘤由增生的胶原纤维伴较多淋巴细胞浸润组成,内见砂砾体,考虑为钙化性纤维性肿瘤(calcifying fibrous tumor,CFT)(图1F);免疫组织化学染色示波形蛋白阳性(图1G),IgG阳性(图1H),IgG4阳性,IgG4/IgG<40%,CD117、胃肠道间质瘤未知功能蛋白1(discovered on gastrointestinal stromal tumor 1,Dog-1)、平滑肌肌动蛋白(smooth muscle actin,SMA)、结蛋白、酸性钙结合蛋白S100和CD99均阴性,CD34阳性,Ki-67阳性率约为1%。患者术后好转,于2018年4月28日出院,随访近5个月无复发。

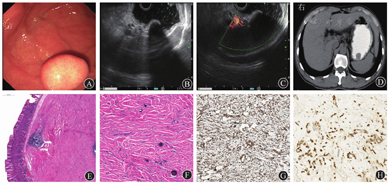
例2 患者男,45岁,因"体格检查发现胃占位1个月余"于2016年8月3日入院。既往糖尿病1个月余,血糖控制可。腹部体格检查无异常。入院后实验室检查示白细胞计数为3.15×109/L,血红蛋白水平为142 g/L,癌胚抗原水平为4.28 μg/L,白蛋白水平为38 g/L,血糖水平为6.68 mmol/L,尿糖(+++)。2016年7月26日行胃镜和超声内镜检查提示胃底隆起性病变,大小约15 mm×12 mm,表面黏膜光滑,病变呈低回声改变,其胃腔侧呈偏高回声改变,后方见声影、边界欠清晰,起源于固有肌层,考虑间质瘤可能(图2A、图2B);多普勒超声检查未见明显血流信号(图2C)。入院后上腹部CT检查示胃底可见一类圆形软组织密度结节影,边界清晰,大小约14 mm×19 mm(图2D)。临床诊断:间质瘤、2型糖尿病。于2016年8月5日行ESD治疗。术后病理提示胃底肿瘤位于黏膜下层,主要由大量胶原化的纤维结缔组织组成,内部可见散在钙化灶,间质内可见数量不等的淋巴细胞和浆细胞,部分区域可见生发中心形成,符合良性纤维性肿瘤,考虑CFT可能(图2E、图2F);免疫组织化学染色示波形蛋白阳性(图2G),IgG阳性,IgG4阳性(图2H),IgG4/IgG>40%,异型细胞角蛋白、SMA、CD117、CD34、Dog-1、S100均阴性,Ki-67阳性率约为5%,H.pylori阴性。患者于2016年8月10日治愈出院,随访2年无复发。

CFT又称钙化性纤维性假瘤,是一种软组织良性纤维性肿瘤,好发于四肢、躯干、颈部等,临床少见,胃内病变更罕见,目前报道不足100例。文献报道CFT多见于女性,好发年龄为33.6~49.2岁[1]。
回顾39篇文献共66例胃CFT患者的资料,其中行超声内镜检查者共21例,加本组2例患者共23例。该23例患者中19例描述了性别,男8例,女11例,男女比例0.7∶1,女性多见;18例患者描述了发病年龄,发病年龄为(48.9±9.8)岁,与文献报道相近[1]。CFT病因不明,有学者认为其可能为炎症性肌纤维母细胞瘤的某个阶段或IgG4相关硬化性疾病的一种表现[2,3]。胃CFT一般无症状或为非特异性消化道症状,如腹痛、恶心、呕吐等,也有溃疡、消化道出血等表现[4]。腹部CT表现为病灶密度均匀,无明显坏死囊变,当病变富含散在砂砾体时其相对密度较高,CT值高于周围胃黏膜和其他常见的胃固有肌层来源肿瘤。CFT病变内出现明显钙化是其典型征象[5,6]。胃CFT普通内镜下表现为黏膜下肿物,大部分表面黏膜光滑,个别有溃疡形成[4]。分析23例患者的超声内镜检查资料发现,20例患者描述了病变内部回声改变,其中19例呈低回声改变,1例呈等回声改变;13例患者描述了病变内部回声是否均匀,其中9例患者内部回声不均匀,可见高回声改变,4例病变内部回声均匀;10例患者描述了肿瘤边界,其中9例患者病变后方边界欠清晰;7例患者描述了病变后方可见声影;19例患者描述了病变层次起源,其中17例患者病变起源于固有肌层,2例病变起源于黏膜下层;病变大小为6 mm×6 mm~54 mm×32 mm,平均长径为(20±10) mm;22例患者描述了病变部位,其中15例位于胃体,3例位于胃底,2例位于胃窦,1例位于胃底体交界,1例位于胃窦体交界。CFT大多被误诊为间质瘤,分析的23例患者中,7例患者被误诊为间质瘤,仅1例术前怀疑CFT。
CFT的确诊依赖病理组织学和免疫组织化学染色,组织学表现为卵圆形、边界清晰的肿块,无包膜,切面呈灰白色,大量胶原纤维组织增生伴钙化或砂砾体形成是其特征性组织学表现,间质内有少量淋巴细胞、浆细胞浸润;免疫组织化学染色示病变内梭形细胞主要表达波形蛋白,部分患者IgG4阳性[3],个别患者CD34或CD117散在阳性,而SMA、S100、肌动蛋白、结蛋白、活化素受体样激酶1(activin receptor-like kinase 1,ALK1)多为阴性[7]。CFT需与钙化的间质瘤鉴别,后者超声内镜检查也可见病变内钙化,但免疫组织化学染色提示CD117和Dog-1阳性,基因检测提示KIT或血小板源性生长因子受体α(platelet-derived growth factor receptor α,PDGFRA)基因突变等。除间质瘤外,CFT还需与平滑肌瘤、神经鞘瘤等鉴别。ESD、内镜黏膜下肿瘤挖除术(endoscopic submucosal excavation,ESE)或内镜下全层切除术(endoscopic full-thickness resection,EFR)现已被用于治疗胃CFT,具有较好的可行性和安全性,并发症较少[8,9]。传统治疗多以手术切除为主,但创伤较大,且胃解剖结构改变较大,严重影响患者术后生命质量。分析的23例患者中,13例行ESD治疗,其中1例因腹腔侧可见较粗血管转外科手术治疗,3例行ESE治疗,2例行EFR治疗,6例行外科手术治疗。
综上所述,胃CFT为罕见病,中年多发,女性略多于男性,临床表现缺乏特异性,肿块内出现明显钙化是其典型影像学征象。超声内镜下更多表现为低回声占位,内部回声不均匀,可见高回声,部分患者病变后方见声影,边界欠晰,多起源于固有肌层。免疫组织化学染色提示大量胶原纤维组织增生伴钙化或砂砾体形成,波形蛋白阳性,部分患者IgG4阳性,个别患者CD34或CD117散在阳性,而SMA、S100、肌动蛋白、结蛋白、ALK1多为阴性。临床上,超声内镜检查易将CFT误诊为间质瘤,ESD、ESE和EFR等内镜下治疗是CFT有效的治疗方式。CFT不同于恶性间质瘤,为良性疾病,预后良好[10]。
所有作者均声明不存在利益冲突



























