
功能性消化不良(FD)和胃轻瘫是2种常见的功能性胃肠疾病,在中国和世界范围内影响着数百万人。然而,由于其病理生理学涉及多种因素,导致治疗方案有限且制定困难。因此,在治疗前评估和了解这些疾病的病理生理学非常重要。本文就FD和胃轻瘫的病理生理学和治疗最新进展进行综述。除了FD常见的临床症状如胃容受性受损、胃排空延迟和内脏高敏感,最近有报道称FD症状中亦有十二指肠功能的一些损害,如轻度炎症和黏膜通透性增加。巨噬细胞在胃轻瘫的病理生理机制中起着重要作用。本文根据FD和胃轻瘫的病理生理学,讨论了治疗这2种疾病的常用方法和新兴方法的优缺点。同时对FD和胃轻瘫的治疗方案进行了综述,包括作者对每种治疗方法的优缺点的看法。本文对FD和胃轻瘫的可能的新疗法,尤其是与中医药相关的新疗法也进行了介绍和讨论。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
功能性消化不良(functional dyspepsia, FD)和胃轻瘫是累及上消化道最常见的疾病。西方国家的FD患病率为10%~40%,亚洲的FD患病率为5%~30%[1]。尽管胃轻瘫的流行病学尚不明确,但有研究估计胃轻瘫患者占全球总人口的1.3%~1.4%[2]。FD和胃轻瘫的常见症状包括餐后饱胀、早饱、上腹痛或烧灼感、上腹胀、呃逆、恶心、呕吐等。FD的病理生理机制和治疗与胃轻瘫的相重叠。本文总结了对FD和胃轻瘫的定义、病因、病理生理机制,以及治疗的认识。
1.FD是指具有起源于胃十二指肠区域的上腹部症状,经临床检查,包括上消化道内镜检查后,排除引起上述症状的器质性疾病的慢性消化系统疾病。根据2016年发布的罗马Ⅳ标准,FD患者在过去6个月中的3个月内必须表现出以下1种以上症状:餐后饱胀、早饱、上腹痛和上腹烧灼感,并且这些症状无法由其他结构性或器质性病因解释。FD分为2种临床亚型,即餐后不适综合征(postprandial distress syndrome, PDS)和上腹痛综合征(epigastric pain syndrome, EPS[3],这2种亚型可能重叠。
2.胃轻瘫是一种临床综合征,其特征是胃排空延迟而无机械性梗阻,主要症状包括进食后早饱、餐后饱胀、恶心、呕吐、嗳气和腹胀。
胃轻瘫由多种临床疾病引起,例如糖尿病、上消化道手术(胃底折叠术和迷走神经切断术等)、神经系统疾病(帕金森病、淀粉样变性和全自主神经障碍等)、病毒感染(诺如病毒、EB病毒、巨细胞病毒和疱疹病毒等)、药物(阿片样物质、抗生素、抗心律失常药和抗惊厥药)、结缔组织疾病(硬皮病和系统性红斑狼疮等)、肾功能不全等[6]。尽管传统认为糖尿病为胃轻瘫的主要病因,但特发性胃轻瘫构成其最常见的病因。
FD为多因素疾病,涉及不同的病理生理机制,包括胃容受性受损、胃排空延迟、内脏高敏感、胃电节律紊乱、十二指肠黏膜改变等(图1)。据报道,30%~40%的FD患者存在胃容受性受损[7],胃容受性受损与早饱和体重减轻有关[8];约35%的FD患者存在胃排空延迟[9],这与恶心、呕吐和餐后饱胀,以及较低的生活质量有关[10]。通过电子恒压器评估,约37%的FD患者存在内脏高敏感[11],内脏高敏感的程度与FD症状的严重程度有关[12]。胃电描记术(electrogastrography, EGG)检查发现,36%~60%的FD患者有胃起搏活动异常[13],其特征是在禁食和(或)餐后,其正常胃慢波占比减少[14]。有研究认为,十二指肠黏膜通透性增高和十二指肠低度炎症也与FD的病理生理机制有关[15]。尤斯灌流室检测发现FD患者的十二指肠黏膜通透性增加,并且存在十二指肠低度炎症,表现为黏膜肥大细胞和嗜酸性粒细胞浸润增加[16]。十二指肠高通透性和炎症标志物与胃固体排空有关[17]。有研究报道,有些FD患者并无上述的病理生理机制异常,并且这些病理生理机制异常与FD的特定症状之间无明显关系或根本无关[11]。
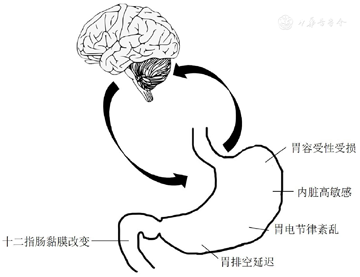

胃轻瘫涉及多种病理生理机制。不同病因导致的胃轻瘫如糖尿病胃轻瘫和特发性胃轻瘫的病理生理机制存在差异。胃排空延迟是诊断胃轻瘫的先决条件,但目前胃轻瘫患者胃排空延迟的病理生理机制尚不明确。胃容受性受损、内脏高敏感和胃电节律异常等均可导致胃轻瘫。Karamanolis等[18]发现43%的难治性特发性胃轻瘫患者的胃容受性受损,其中29%的受试者表现出内脏高敏感,且与早饱、腹痛和厌食有关。研究发现,胃电节律异常如胃电节律过缓和紊乱等与胃轻瘫相关[19]。治疗特发性胃轻瘫与胃电图参数的正常化有关,这表明胃电节律异常在特发性胃轻瘫中的病理生理机制中起重要作用[20]。另一项研究发现小肠动力障碍也可导致胃排空障碍和胃轻瘫症状[2]。
胃轻瘫具有多种细胞的病理学改变,包括间质卡哈尔细胞( interstitial Cajal cell,ICC)缺失、肌层纤维化、肌层神经元周围炎性细胞浸润、神经元异常等(图2)。有研究采用全层胃体活组织检查发现,糖尿病胃轻瘫和特发性胃轻瘫患者存在ICC缺失[21]。糖尿病胃轻瘫和特发性胃轻瘫患者的ICC缺失可能会导致胃排空延迟,损害胃的起搏活动和运动协调性[22],但尚不清楚ICC缺失是否可以预测胃轻瘫症状的严重程度。肌层纤维化,特别是神经元周围的纤维化是特发性胃轻瘫另一超微结构特征,这些纤维层可能损害平滑肌的新陈代谢,并引起细胞损伤[23]。有2项研究结果显示,某些胃轻瘫患者肌层中有异常嗜酸性粒细胞或巨噬细胞浸润[24,25]。研究发现,糖尿病和特发性胃轻瘫患者胃组织中CD206阳性细胞和抗炎性M2型巨噬细胞数量减少,并与ICC的缺失有关[26]。另一项研究发现促炎性M1型巨噬细胞在胃轻瘫组织中的基因表达增加[27]。巨噬细胞引起的免疫失调和氧化应激损伤是导致ICC缺失和胃排空延迟的关键因素[2]。胃轻瘫的神经元异常包括神经纤维减少、迷走神经功能障碍、肠神经系统变化以及表达神经型一氧化氮合酶(neuronal nitric oxide synthase, nNOS)的抑制性神经元数量减少[28]。
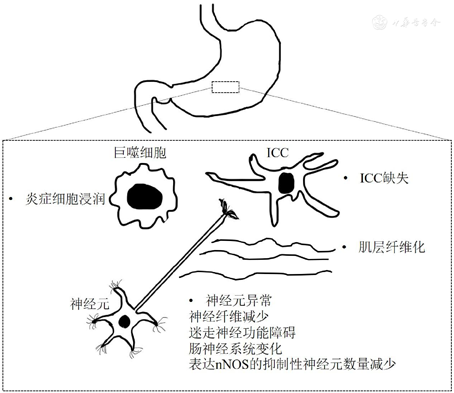

注:ICC为间质卡哈尔细胞;nNOS为神经型一氧化氮合酶
传统认为FD和胃轻瘫是胃动力障碍疾病。但是,近年来有研究发现,除了胃动力障碍,FD和胃轻瘫的病理生理机制还包括胃容受性受损和内脏高敏感。机理研究发现,FD的病理生理机制还有十二指肠因素的参与,例如十二指肠黏膜改变;胃轻瘫的病理生理机制还包括巨噬细胞的分子机制等。
如果患者有消化系统警报症状,例如呕血、便血、贫血、不明原因的体重减轻、进行性吞咽困难、反复呕吐和胃肠道肿瘤家族史,则应首先怀疑器质性疾病或机械性梗阻,并通过上消化道内镜检查排除,建议内镜检查结果为阴性的难治性患者进行更多检查以评估内在的病理生理机制,包括胃排空、胃容受性、内脏敏感性和胃电慢波的测定。
胃排空测定包括固体闪烁测量、呼气试验、无线动力胶囊、超声和磁共振成像(magnetic resonance imaging, MRI)检查。
1.固体闪烁测量是目前最广泛使用的方法,也是胃排空测定的金标准。分别在患者摄入99mTc标记的测试餐后0 、1 、2和4 h时,使用前后位伽玛照相机拍摄标记食物所在的胃内区域[29]。1 h时的胃潴留率>90%,2 h时的胃潴留率>60%,4 h时的胃潴留率>10%则诊断为固体排空延迟[30]。4 h时的胃潴留率> 10%对诊断胃排空延迟的灵敏度为100%,特异度为70%。胃排空固体闪烁测量具有可重复性,2次测量结果具有良好的一致性相关系数(consistency correlation coefficient,CCC)。研究发现,2次测量结果的CCC在1 h时为0.79(0.67~0.87),2 h时为0.83(0.75~0.9),4 h时为0.54(0.34~0.7)[31]。测试餐的成分、成像时间、血糖值和计量方法等因素会影响固体闪烁测量的结果,其中最重要因素是测试餐的成分,目前在检查中使用的食物包括绞碎的牛肉和鸡肝、鸡蛋清、整鸡蛋、燕麦片,以及煎饼,其中可能包含液体成分。美国神经胃肠病学和动力学学会,以及核医学学会建议给患者提供低脂蛋清测试餐,包含2个鸡蛋清(30 g)、2片面包(120千卡)、草莓酱(30 g,74千卡)和水(120 mL)[30]。考虑到饮食习惯,一些亚洲医院已经修改了测试餐的成分,例如改用米饭。进餐后成像的时间也很重要,重点是4 h时胃潴留率的数值。Pathikonda等[32]发现4 h时的胃潴留率与3 h时的胃潴留率呈强相关,与2 h时的胃潴留率呈中等相关,而与1 h时的胃潴留率相关性一般。4 h胃排空延迟的患者,若诊断时采用1 h时的胃潴留率,36%的患者可能会被漏诊。血糖值对胃排空测定有影响,美国胃肠病学学会临床指南建议,给予测试餐前患者的血糖值应<15.3 mmol/L[33]。药物、吸烟、性别、测量时扫描的部位等其他因素也需要考虑。该方法有以下几个局限性:①某些患者无法耐受固体食物;②固体闪烁测量具有轻微的放射暴露;③核医学科并未在全球广泛普及;④价格昂贵。
2.呼气试验:在没有固体闪烁测量前,呼气试验是其替代方法之一。在测试过程中,将13C标记的底物(通常为辛酸或螺旋藻)掺入固体食物中。该试验的基本原理为通过分析呼气中的13CO2含量来反映固体食物中13C标记底物的胃排空率。试验前患者应禁食8 h,试验全程耗时4 h,其结果具有可重复性,可与固体闪烁测量相媲美[34]。呼气试验的灵敏度和特异度分别为75%~86%和80%~86%[35]。呼气试验是非侵入性的、易于操作、且没有放射暴露,该试验适合需要重复检查的患者、孕妇或哺乳期妇女,以及儿童。此外,呼气试验的价格低于固体闪烁测量。其局限性主要在于2个方面:①由于多种身体因素(如患者自身的运动、消化不良、小肠细菌过度生长、胰腺外分泌功能不全,以及严重的肝脏、心脏或肺部疾病)导致的内源性CO2排出量发生变化;②某些国家或地区无法获得13C标记的底物,必须将患者的呼气标本寄送到商业公司进行分析。
3.无线动力胶囊:无线动力胶囊已获得美国FDA的批准用于胃排空测定。患者在服用测试餐后摄入胶囊,胶囊将pH值、压力和温度信息无线传输到外部的记录仪。记录仪通过胶囊在胃内的停留时间来评估胃排空情况[33]。无线运动胶囊的胃排空时间与固体闪烁测量4 h时的胃排空时间总体相关系数为0.73[36]。以300 min为截断值,无线动力胶囊对胃轻瘫诊断的灵敏度为65%,特异度为87%。该方法无放射性、相对安全,并可以测量完整的肠道传输时间。但其不能直接测量进餐的生理性胃排空,因为胶囊通常是在第三时相,在胃完全排空的空腹状态时由胃的移行性复合运动排出。这一方法需要在更大规模的人群中进一步验证。
4.其他方法:评估胃排空的其他技术包括不透射线标志物、超声检查和MRI。不透射线标志物法是通过摄入不透射线的标记物或标准餐,然后进行仰卧位腹部X线摄片或透视检查。该方法操作简单、价格低廉,但其诊断可靠性较低[37]。超声和MRI都是非侵入性检查,可避免放射暴露[38,39]。由于超声和MRI专业知识要求高、设备昂贵、图像采集和解读速度慢,两者主要用于科学研究。MRI评估胃排空的优势在于其还能提供胃窦收缩和幽门开放的信息[40]。
胃容受性测定包括电子恒压器检测、超声检查、MRI、单光子发射计算机断层成像(single-photon emission computerized tomography,SPECT)和液体营养餐试验。
目前评估胃容受性的金标准是电子恒压器检测。电子恒压器由一个双腔聚乙烯管和一个最大容量为1.0~1.2 L的聚乙烯气囊组成,聚乙烯气囊被放置在胃近端以检测胃底容积的变化。胃电子恒压器在消化不良患者和健康受试者中均显示出优良的可重复性。然而,该技术是侵入性的且耗时较长,大多数受试者会感到不适,限制了其在临床中的应用。另外,胃气囊会干扰胃的正常生理过程,气囊在胃壁上施加的直接刺激可能会导致胃窦过度松弛并改变胃内食物分布情况[41]。
二维和三维超声检查已在临床上用于评估胃容受性。超声检查系非侵入性且患者对其耐受性良好。但是,腹部气体的干扰给操作带来了技术上的难度,并且超声检查费时费力。其评估胃容受性的可靠性和准确性需要进一步评估。
与超声类似,MRI是一种无创测量胃容受性的方法,但更耗时,一般用于科学研究,目前尚无足够研究证实其在评估胃容受性中的实用性。
SPECT最初是由美国梅奥医学中心提出用于测量胃容受性的方法。该技术通过静脉注射99m锝标记的高锝酸盐,高锝酸盐被胃的壁细胞和黏液分泌细胞摄取,由无创SPECT伽玛照相机拍摄、获取胃壁图像。SPECT是一种非侵入性检查,与电子恒压器检测比较,具有可靠性和可重复性[42]。但是,该检测需要昂贵的设备和特殊的软件,仅在很少的专业中心可获得,且存在放射性暴露。未来若有更多研究进行验证,则SPECT可能会成为有前景的诊断工具。
液体营养餐试验是一种简单、无创的测量胃容受性的方法。检测时,要求受试者缓慢、匀速饮用液体营养餐,例如Nutridrink®和Ensure®,直到达到最大饱腹感。该检测的原理基于以下假说:胃容受性受损导致胃容量下降,导致最大耐受量降低。液体营养餐试验具有很高的可重复性,并与电子恒压器检测结果具有很好的相关性[43],其价格低,易于操作,无需特殊设备,受试者耐受性好,易于实施。
内脏敏感性测定包括电子恒压器检测、液体营养餐试验或水负荷试验、化学刺激试验(如酸刺激或辣椒素刺激)、电刺激试验和热刺激试验。
电子恒压器是评估机械刺激高敏反应的传统金标准。检查过程中医师使用气囊扩张患者胃底,嘱患者对不适感进行主观评分,电子恒压器提供机械性扩张的感觉阈值信息。电子恒压器操作复杂且为侵入性检查,因此该检测方法仅在少数医学中心开展。
液体营养餐试验或水负荷试验较电子恒压器检测更简单,可以广泛应用,它通过患者摄入液体营养餐或水来确定胃的敏感性[44,45]。这2种试验不影响胃的生理过程。操作时要求受试者报告不适或疼痛的程度,不适或疼痛的程度对应于摄入液体营养餐或水的量。
化学刺激试验,电刺激试验和热刺激试验通常用于科学研究目的[46]。
人类的胃慢波起始于胃体的中上部,以约3次/min的频率向下传播至胃窦。1922年Alvarez[47]第1次报道了胃慢波的记录。EGG是一种简单、非侵入性测定胃电活动的方法,医师在患者腹部皮肤上放置多个电极来记录胃肌电活动,通常记录1个或4个通道EGG[48]。为确保结果可靠,要求医师在安静的房间中记录患者的EGG约30 min(至少15 min),过程中嘱患者仰卧位,保持安静。患者在服用标准餐前后,医师均需记录其EGG参数用于后续的比较分析。标准餐的热量应至少有250千卡,>400千卡最佳,脂肪占比<35%。EGG提供以下主要信息:正常胃慢波的百分比、主频率、主功率、餐前和餐后主功率比值、胃电节律不齐的百分比。已有研究证实,EGG的结果与胃电浆膜内的胃动力和胃排空具有较好的相关性[49,50,51]。医师准确记录、分析和解释EGG,可获得胃肌电活动有意义的信息。
近年来,高分辨地形图已发展为一项评估胃电慢波活动的新技术。高分辨地形图通过在胃浆膜上放置密集的电极阵列以记录和重建电激活模式。多项关于高分辨地形图的研究发现,胃轻瘫和功能性消化不良患者存在胃慢波活动传导异常[52]。然而,该方法是侵入性的,记录信息直接来自受试者胃浆膜层,需要进行腹部手术,有引起不适、感染的风险,因此不能长期使用。最近,有研究者开发了高分辨EGG,仅在腹部体表放置密集的电极,用于研究高分辨EGG的空间模式与FD和胃轻瘫患者症状之间的相关性[53]。高分辨EGG的主要优势在于可能揭示胃电慢波的传导异常。
与食管测压和肛门直肠测压相似,胃窦十二指肠测压用于评估FD和胃轻瘫患者的胃窦和十二指肠收缩情况[54]。食管测压和肛门直肠测压法是临床评估食管和肛门直肠动力受损的常规方法,而胃窦十二指肠测压很少用于评估胃窦十二指肠动力。这归因于以下因素:①胃窦十二指肠动力与FD和胃轻瘫症状之间的相关性较差;②该测压方法为侵入性,患者不耐受;③测压过程很长,至少需要4 h以涵盖完全空腹和餐后时相;④由于测压传感器与胃黏膜之间接触的不可预测性,测压的准确性无法保证。因此,该技术仅在极少数的三级医疗中心开展,且并非每个患者都可以进行该检查。
与食管和肛门直肠的功能性疾病不同,FD和胃轻瘫的诊断进展缓慢,这主要归因于腔内方法具有侵入性,而非侵入性方法并不完全可靠。此外,FD和胃轻瘫缺乏治疗选择也可能导致了诊断进展缓慢。对于中国的患者,无创液体营养餐试验可能是评估胃容受性和内脏高敏性的最好的替代测试。利用MRI无创评估胃排空和胃窦收缩是临床研究中非常有前景的方法,同时也是一个很好的研究机会。
FD和胃轻瘫存在多个病理生理机制和病因,针对不同的病理生理机制有不同的治疗选择,如图3所示。临床医师应特别注意对于不同病理生理机制导致多种症状的患者。例如,如果患者同时有胃容受性下降(例如早饱)和胃窦收缩受损(例如餐后饱胀和腹胀等症状),那么选择何种治疗方法可能会有争议,选择肌肉松弛剂能改善胃容受性,但可能会加重因胃窦动力受损而引起的症状,反之亦然;内脏性疼痛和胃窦动力障碍的症状会并存,大多数止痛药物(如阿片类药物)会加重动力障碍。针对这种情况,应考虑采用综合治疗,中医可能提供更好的解决方案。
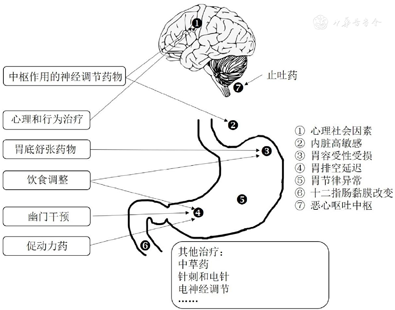

人们日益认识到饮食是诱发FD症状的重要因素。许多FD,尤其是PDS患者称其症状与进食有关。据报道,含有小麦、高脂肪和高含量可发酵的低聚糖、双糖、单糖和多元醇的食物可能在诱发FD症状方面起关键作用[55]。遗憾的是,很少有研究调查饮食调整对改善FD症状的益处。目前,饮食调整主要基于医师或患者的经验,饮食干预的设计还需要进一步的系统研究。
大多数指南均建议对感染H.pylori的FD患者进行根除治疗,根除H.pylori能改善PD症状,并降低消化性溃疡和胃癌的风险。根除H.pylori对EPS患者的治疗效果比PDS患者更明显[56]。
传统上,抑酸治疗是对H.pylori根除无反应或H.pylori阴性FD患者的一线治疗。一项系统分析显示质子泵抑制剂(proton pump inhibitors, PPI)可有效治疗FD[57]。此外,与H2受体拮抗剂(H2 receptor antagonist, H2RA)相比,PPI的优势很小或没有优势,但PPI可能比促动力药更有效。不同剂量或类型的PPI之间疗效并无显著差异。EPS患者对抑酸药的反应比PDS患者可能更好。其他药物,包括抗酸药、铋剂和硫糖铝,对FD似乎无效[58]。
促动力药被广泛用于FD的治疗,尤其是PDS的治疗。促动力药包括5-羟色胺(5-hydroxytryptamine ,5-HT) 4受体激动剂、多巴胺D2受体拮抗剂和胃动素受体激动剂(如红霉素)。研究促动力药症状获益的证据质量始终很低[59],可能是因为胃窦动力和消化不良症状并不相关。
考虑到FD患者存在脑肠轴和中枢性疼痛处理异常,中枢作用的神经调节药物已被推荐为FD的一种治疗选择。神经调节药物可以通过治疗合并的抑郁症、增加胃容受性和控制疼痛感知来缓解FD症状。这些药物包括抗精神病药、三环类抗抑郁药(tricyclic antidepressants, TCA)、选择性5-HT再摄取抑制剂、5-HT和去甲肾上腺素再摄取抑制剂、四环类抗抑郁药等。系统评价和meta分析发现,精神药物中仅抗精神病药(如舒必利和左舒必利)和TCA(如阿米替林和丙咪嗪)对FD有效[60]。因为不良事件及其导致停药的情况很常见,故医师应重视这些药物的不良反应。
胃底容受性受损是FD的主要病理生理机制之一。5-HT1A受体激动剂可通过抑制胆碱能活性而使近端胃松弛。研究发现,与安慰剂相比,5-HT1A受体激动剂丁螺环酮和坦度螺酮能改善FD症状[61,62]。阿考替胺是一种混合型突触前毒蕈碱1型和2型(M1/M2)受体抑制剂和胆碱酯酶抑制剂,能提高胃容受性和胃动力。有报告发现,阿考替胺能改善FD患者的临床症状[63]。但是,以上这些药物尚未在中国批准用于FD的治疗。
中草药在FD治疗中起重要作用[64]。FD分多个中医证型,需要对症下药。已有临床研究证实了中草药对FD的有益效果[65,66],但这些研究通常缺乏明确的作用机制和标准的方法学设计。因此,使用中草药治疗FD需要高质量的临床试验来获得令人信服的证据。
与健康人相比,FD患者的精神心理共患病更常见,虽然其对消化不良症状产生的作用尚不清楚。心理和行为治疗,包括心理治疗、认知治疗和催眠治疗,对于症状严重并对药物治疗无反应,症状与生活压力或精神病合并的FD患者可能有效。总体来说,由于样本量小和研究质量差,这些治疗方法缺乏令人信服的临床证据[67]。大多数心理治疗都会影响胃动力,无论是增强还是抑制,因此,在治疗心理异常或将患者转诊到其他医疗保健机构治疗心理异常时,都应格外注意其胃动力改变的情况。明确患者的焦虑和抑郁是由FD引起的症状,还是导致FD症状的原因是比较困难的,但也十分重要。
针刺是一种传统的FD非药物治疗选择。meta分析显示,与假针刺相比,针刺后FD患者的症状和生活质量得以改善[68]。但是,其中大多数临床试验的质量较低、样本量较小,还需要高质量的随机对照试验。最近一项使用针刺治疗PDS的多中心、随机临床研究发现,每周行3次针刺,共治疗4周,与假针刺相比,针刺可提高所有3种主要症状的缓解率和消失率,并在12周内持续有效[69]。
尽管医师在临床实践中通常使用手工针刺,但电针由于其独特的优势,在临床和基础研究中更常用:①可以统一进行;②如果选择的刺激参数适当,不仅可以模仿手工针刺,而且可以改善自主神经功能,增加神经调节的效果[70]。文献[71]中有许多关于使用电针治疗FD的研究。最近的一项多中心、随机、对照研究显示,电针能改善难治性FD患者的消化不良症状[72]。
当使用针刺或电针治疗FD时,应注意以下几个重要问题。①刺激穴位和刺激参数的选择。尽管已有大量研究比较了不同穴位,但在优化刺激参数方面尚无较大研究进展,因为大部分电刺激都用于模拟针刺的手动操作而并非改善自主神经功能。②治疗频度至关重要。在条件允许的情况下,应尽量频繁进行针刺或电针治疗,例如1次/d,一次治疗的效果不能持续超过24 h。大部分文献报道有争议的结果可能与每周不同的治疗次数有关。③因为针刺或电针治疗中,安慰剂效应很常见,因此在临床研究中仍需进行安慰剂对照,如不同部位的假刺激,以证明治疗的有效性。
神经调控是生物电子医学的一种新兴治疗方法,用于研究治疗包括FD和胃轻瘫在内的多种胃肠道疾病。神经调控方法包括胃电刺激(gastric electrical stimulation, GES)、经皮穴位电刺激(transcutaneous electrical acustimulation, TEA)、迷走神经刺激(vagus nerve stimulation, VNS)、脊髓刺激(spinal cord stimulation, SCS)、骶神经刺激(sacral nerve stimulation,SNS)等。
GES是指通过腹腔镜手术植入设备,直接刺激胃或者胃壁内分布的迷走神经分支。考虑到该方法是侵入性的,因此很少用于FD的治疗。目前仅有2项GES的相关研究在儿童和青少年中进行,发现GES能明显改善上消化道症状和生活质量[73,74]。
TEA是一种非侵入性方法,采用电极代替针灸针。作者团队的研究发现,TEA刺激足三里和内关穴可以改善FD患者的消化不良症状、生活质量、胃排空能力和胃容受性[75,76]。与针刺和电针相比,TEA有以下优势:①无需插入针灸针,患者可在家中自己操作进行治疗;②TEA的刺激参数设计旨在增强迷走神经活性,从而改善胃动力或改善消化不良症状;③ TEA可以每天进行1次甚至多次以提高其疗效[70]。
高脂、固体饮食会增加胃轻瘫患者症状的严重程度和发生频率,饮食调整是胃轻瘫的一线治疗方法,适用于所有患者。建议胃轻瘫患者少食多餐,避免食用含有高脂肪和不易消化的纤维的食物,这些食物会导致胃排空延迟[33]。每日进餐至少4~6餐。补充高热量液体或匀浆固体有助于提供足够的营养而不会引起胃轻瘫症状。
对于无法通过口服维持营养的患者,可以通过空肠造口饲管(绕过胃)进行肠内营养,这样能改善症状并减少住院时间[77]。空肠造口前首先应尝试鼻空肠管营养,以了解患者是否耐受空肠管营养。
长期以来,促动力药一直用于治疗胃轻瘫。一项系统分析证实了促动力药对改善胃排空和临床症状的有效性,尽管其中纳入的大多数试验都存在方法学局限性[78]。常用的促动力药包括甲氧氯普胺、多潘立酮和大环内酯类抗生素。甲氧氯普胺(5-HT3 、多巴胺D2拮抗剂和5-HT4激动剂),是美国唯一经FDA批准用于治疗胃轻瘫的药物,通过促进胃动力和抑制呕吐来缓解症状。使用过程中需注意其不良反应,例如迟发性运动障碍。
多潘立酮是另一种多巴胺D2受体拮抗剂,与甲氧氯普胺疗效相似,是中国治疗胃肠动力障碍最常用的药物之一[79]。由于多潘立酮不易穿过血脑屏障,因此其中枢不良反应较小。有研究发现,由于抑制了人类果蝇相关基因通道的活性,多潘立酮与心脏QT间隔延长有关[80]。
大环内酯类抗生素是胃动素受体激动剂。尽管尚未批准该类抗生素用于治疗胃轻瘫,但由于红霉素和阿奇霉素在短期内能改善胃轻瘫症状和胃排空功能,因此也用于临床。该类抗生素的快速耐药性会引起长期疗效丧失和不良反应,故通常只能短期使用,同时还会损害胃容受性,因此对于胃轻瘫的总体症状改善效果并不显著。
新的促动力药,例如新型胃动素激动剂(GSK962040)、ghrelin受体激动剂(relamorelin)、新型5-HT4受体激动剂(普卢卡必利、维司曲格和YKP10811)在治疗胃轻瘫方面很有前景,但还需要进一步研究[81]。
由于胃轻瘫患者恶心和呕吐的发生率高且症状较严重,故临床中常用止吐药,但止吐药并不能改善胃排空。最常用的止吐药物包括吩噻嗪类(丙氯拉嗪)、组胺H1受体拮抗剂(异丙嗪)、5-HT3受体拮抗剂(昂丹司琼)和神经激肽NK1拮抗剂(阿瑞匹坦)。证实止吐药可以用于治疗胃轻瘫的研究证据多数基于病例报告或缺乏数据[82]。这些药物均存在QT间期延长等不良反应,因此仅在促动力药治疗失败后才考虑使用。
一些胃轻瘫患者存在幽门括约肌功能障碍,即幽门痉挛,这为幽门干预提供了理论依据。
肉毒杆菌毒素注射可阻断胆碱能神经末梢乙酰胆碱的分泌,从而抑制幽门括约肌的痉挛。遗憾的是,根据目前的随机对照试验结果,尚无证据支持可以广泛使用肉毒杆菌毒素注射[83,84]。
已有小样本研究进行了经内镜幽门支架置入术治疗的研究,尤其是针对难治性胃轻瘫[85,86]。一项研究显示,30例患者中有75%表现出胃排空功能和临床症状的改善[86]。但由于支架移位的可能性为52%,所以经幽门支架置入术并不是永久性治疗方案,可以将其视为顽固性症状的临时治疗方法。
通过腹腔镜或外科手术进行幽门成形术,扩大幽门并防止痉挛,已有研究证明该方法可以改善胃轻瘫症状的严重程度和胃排空功能[87]。考虑到目前尚无高质量的随机对照研究,且需要长期随访,建议医师仅针对难治性患者慎重选择幽门成形术。
胃经口内镜下幽门肌切开术(gastric peroral endoscopic myotomy, G-POEM)已成为难治性胃轻瘫的一种新型、微创治疗方法[88]。经口内镜下幽门肌切开术是治疗贲门失弛症的成熟方法,G-POEM扩展治疗手段。该过程包括黏膜下注射和黏膜层切开,建立黏膜下隧道,肌切开,然后关闭黏膜层切口。一项系统综述和meta分析发现,G-POEM可以显著改善胃轻瘫症状和胃排空功能,并且其不良事件发生率低[89]。目前的研究大多数样本量较小且缺乏对照组,尚需进行大样本对照试验来评估G-POEM在胃轻瘫中的作用。
对于幽门干预治疗,选择合适的患者十分重要,目前尚无有效的筛查方法来确定适合幽门干预的患者。总体而言,幽门痉挛在胃轻瘫中并不常见,故建议尽量少用幽门干预治疗,且该治疗方法引起的幽门松弛可能会导致胆汁反流到胃中。
针灸可改善糖尿病性胃轻瘫患者的症状,减少胃潴留,并加速固体胃排空[90,91]。针灸被认为是一种替代疗法,尚需进一步研究来评估其对胃轻瘫的长期影响。
GES采用高频、低能量电流刺激胃。GES的确切机制尚不清楚,有研究猜测其会干预迷走神经传入纤维向大脑的感觉传导。已有研究发现GES可以控制胃轻瘫症状(主要症状为恶心和呕吐),改善生活质量,并提高口服喂养的耐受性[92],从而为难治性胃轻瘫提供了治疗选择。GES对糖尿病性胃轻瘫的疗效较其他病因的胃轻瘫似乎更好,例如特发性胃轻瘫或术后胃轻瘫。但是GES治疗并不能改善胃排空功能[93]。GES需要植入刺激装置,植入后有关的并发症包括局部感染、导线移位、肠梗阻和穿孔,这些并发症的发生率约为20%。
迷走神经在调节恶心和呕吐中起重要作用。VNS在19世纪后期首次用于治疗癫痫。VNS可能和GES一样通过迷走神经传入大脑中枢进行神经调节,对胃轻瘫有着相似的治疗作用。无创迷走神经刺激不需要手术植入电极或脉冲发生器,从而避免了手术并发症。迄今为止,只有2项研究评估了无创迷走神经刺激治疗胃轻瘫[94,95]。结果显示部分胃轻瘫患者的症状和胃排空均得到改善。该结果还需要更大样本的随机对照试验来验证这些发现。
有研究发现,SCS能够通过增强大鼠和狗的迷走神经活性来改善胃排空功能[96,97]。最近有研究发现,SNS可以通过一种新的脊髓传入和迷走神经传出通路改善大鼠的胃容受性和胃动力障碍[98,99]。这些研究结果提示SCS和SNS对胃轻瘫有潜在的治疗作用,但还需要进一步的临床研究。
总体而言,FD和胃轻瘫的治疗选择很有限,因为目前尚没有或仅有很少药物被批准专门用于治疗FD或胃轻瘫。中国已经有一些药物被批准使用,并且中医药疗法也更容易实施,故中国关于治疗FD和胃轻瘫的现状略好一些。治疗FD和胃轻瘫主要的挑战是其病理生理学涉及的多种因素。因此,对于特定患者,在为其提供治疗之前医师要尽可能明确其疾病的病理生理。
FD和胃轻瘫患者具有相似的症状,需要进行多种诊断实验以确定其潜在的病理生理机制,这有助于指导治疗。尽管FD和胃轻瘫有多种治疗选择,但它们的疗效仍有限。目前新的治疗方法正在取得进展,包括新的药物、内镜下干预和神经调制方法。
所有作者均声明不存在利益冲突



























