
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,69岁,因"下腹部隐痛3个月余"入院。患者3个月余前无明显诱因出现下腹部隐痛,伴大便间断不成形,2~3次/d,无黏液血便,既往有慢性乙型肝炎病史20年余。我院门诊肠镜检查:回盲瓣开口处可见2.0 cm×2.0 cm侧向发育型肿瘤,收入院行内镜黏膜下剥离术(ESD)。术中见息肉位于回盲瓣上唇,呈侧向发育型,表面结节不均一,病灶随肠道蠕动进入回肠末端内,整体观察效果欠佳。术者决定用钛夹固定法辅助ESD治疗:黏膜下注射1∶10 000肾上腺素+亚甲蓝水溶液使病灶隆起,透明帽辅助下用Hook刀沿病变外侧环状切开周围黏膜,再次补充黏膜下注射剂,进行病灶肛侧上方部分黏膜下剥离,由于回盲瓣处肠蠕动频繁,病变固定效果不良,剥离操作稳定性欠佳,决定用Olympus金属钛夹夹住病灶上方部分已剥离黏膜,辅助固定于对侧回盲部正常黏膜上,起牵拉作用,固定病变,减少肠蠕动对手术的干扰,继续行ESD完整剥离病灶(图1,图2,图3,图4,图5,图6,图7,图8,图9),切除标本体外测量2.4 cm×2.2 cm(图10,图11,图12)。病理示:绒毛状管状腺瘤伴低级别上皮内瘤变,四周切缘阴性。
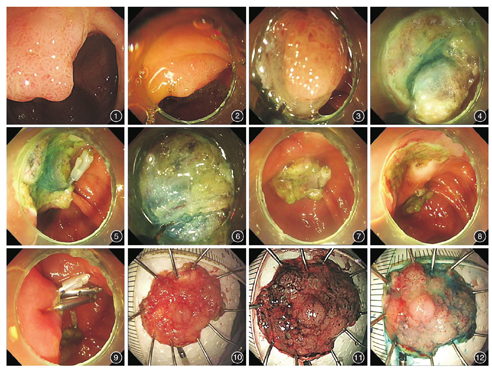

侧向发育型肿瘤生长方式主要为沿大肠黏膜浅表侧向扩散而少向肠壁深层侵袭,目前对于浸润未超过黏膜下层的LST临床采用内镜下黏膜切除(EMR)、内镜下分片切除术(EPMR)、环周状预切开后行EMR方法(circumferential precutting followed by snare resection,EMR-P)[1]和ESD等方法治疗。一般肿瘤直径<20 mm时,选用EMR,其中10~20 mm可选用EMR-P以提高完整切除率[1];直径≥20 mm时选用EPMR、EMR-P或ESD。Kim等[2]进行的回顾性研究显示不完整切除和切除病灶边缘阳性被认为是局部复发的危险因素,因此应尽量进行完整切除,以获取完整组织进行病理学评估,指导下一步治疗及随访。
本例患者病灶大于20 mm,由于我中心开展ESD较为成熟,所以笔者选择ESD进行治疗;因病灶位置、肠道蠕动等因素影响,操作有一定的难度,选择金属钛夹固定辅助法ESD具体体会如下:(1)使用透明帽辅助可以更好地暴露视野,使切开剥离在直视下进行,对可见血管进行预处理,防止发生出血。(2)治疗型胃镜(Olympus GIF-Q260J)活检孔内径3.2 mm,外径9.9 mm,在有附件的情况下可保证吸引液体、气体及术中烟雾;同时治疗型胃镜带有附送水功能,可保持操作视野清晰、剥离层次明确,对术中出血部位的冲洗利于找准出血点,精确止血。治疗型肠镜(Olympus PCF-Q260J)活检孔内径3.2 mm,外径10.5 mm,带有附送水功能,也适合用于肠道ESD,但由于本中心配备的数量较少,笔者便选用治疗型胃镜进行下消化道ESD,同时考虑如需要可方便倒镜操作。(3)钛夹的辅助固定法:由于环周状切开后,回盲瓣、末端回肠黏膜蠕动频快,增加剥离的难度,本例术中使用钛夹将病灶夹于对侧回盲部的正常黏膜,其作用是固定病灶,使移动度减少;牵拉病灶,使黏膜下层视野清楚,便于剥离;切除后病灶固定于回盲部,不会随肠道蠕动进入回肠末端,便于标本取出。(4)此种钛夹固定辅助法ESD类似牙线等辅助牵引法,在肠道病变中应用效果应较好,使操作视野清晰,操作过程更快、更安全、更有效,但既往报道多用于上消化道(食管、胃)治疗,如Ota等[3]、Parra-Blanco等[4]的报道,也有Imaeda等[5]报道采用类似牵引技术治疗直肠肿瘤;本中心使用圈套器在直肠ESD中作为辅助法,效果满意,但由于肠道弯曲走行的解剖结构使牵引实施困难、效果不良,对于右半结肠、回盲瓣ESD辅助技术未见报道;而笔者采用的方法,特别在一些弯角处等操作困难部位的应用,可能是一种较好的方法,简单易行,值得推广。


























