
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
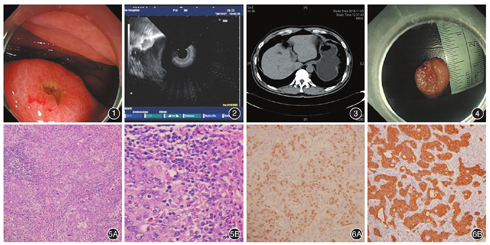
患者男,53岁,以"反复中上腹闷痛7个月"行胃镜检查,见胃体大弯上段一火山样隆起型病变,中央凹陷,表面见少许白苔,大小约1.0 cm,边界尚清(图1)。多次活检病理均提示:急慢性炎症细胞浸润,幽门螺杆菌(+)。既往史:发现乙肝病毒携带十余年。EUS:病灶源于黏膜下层,呈不均匀偏低回声,呈分叶状,边界尚清,紧临肌层,肌层尚完整,考虑黏膜下肿物可能(图2)。上腹部CT增强:胃底体交界处稍不规则增厚,最厚约0.8 cm,略呈结节样;邻近肝胃间隙小淋巴结;考虑:炎症(?),间质瘤(?),异位胰腺(?)(图3)。为进一步明确病灶性质,行诊断性ESD,标本大小约1.5 cm×1.5 cm(图4)。术后病理诊断:胃淋巴上皮瘤样癌(lymphoepithelioma-like gastriccarcinoma,LELC),侵及黏膜下层,标本周切缘及底切缘均未见癌残留,无神经及脉管侵犯。术后病理学及免疫特点:肿瘤呈圆盘状,中央凹陷,最大直径1.5 cm,灰褐色,质地稍硬,无包膜。镜检可见在大量淋巴细胞的背景下,瘤细胞呈团状、巢状、条索状分布(图5A)。癌细胞呈圆形、椭圆形或梭形,呈丰富嗜酸性,核膜厚,分裂像少见,染色质呈空泡状,部分可见明显核仁,浸润性淋巴样细胞(包括小淋巴细胞、少量转化样淋巴细胞及浆细胞,图5B)明显多于瘤样细胞,部分可见淋巴滤泡形成,异形淋巴细胞少见,间质胶原纤维蛋白成分较少。免疫组化:Ki-67(60%+),CK18(+++),CD56(-),P63(-),CgA(-),SY(-),ck(pan)(+++),EBER(+)。肿瘤细胞CK18、ck(pan)阳性,提示来源于上皮来源,并采用原位杂交的方法检测出EB病毒编码的小RNA(EBER+)(图6A),阳性定位在肿瘤细胞核中(图6B),而周围胃黏膜及淋巴样细胞阴性。手术治疗及随访:考虑到特殊类型的胃癌及侵犯黏膜下层,患者及其家属考虑行根治性全胃切除术(D2),术后病理:部分区域黏膜缺失,间质纤维、肌纤维母细胞增生,找到周围25枚淋巴结,未见转移灶。2个月后复查全身PET-CT未见肿瘤复发及转移征象。目前仍在随访中。

WHO(2010)消化系统肿瘤分类中将胃LELC作为独立的胃腺癌亚型,又称伴淋巴样间质胃癌或胃髓样癌,分为2种亚型,一种为EBV阳性癌,另一种为高频微卫星不稳定型癌,属于胃癌中的罕见类型,与富于淋巴细胞表型有关[1]。>80%原发胃LELC与EBV感染相关,约10%与高频微卫星不稳定性相关[2],且EB病毒在血清学的滴度水平是影响预后的一项重要指标[3]。淋巴上皮瘤样癌好发于鼻咽部,但是发生于消化道较为少见,它是一种发生于鼻咽部之外但是在组织病理学上与鼻咽部淋巴上皮癌相似的特殊类型的胃癌,过去常诊断为未分化癌或者低分化腺癌,并且在食管、胃、肺部、胰腺、输尿管等也有个例报道。但是目前EBV感染与幽门螺杆菌感染对胃LELC的发生与发展是否存在协同关系仍有争议。
胃LELC以黏膜下肿物的形式表现较为少见,本例中在白光内镜下表现为盘状隆起,中央凹陷,超声内镜提示偏低回声的黏膜下肿物,肌层完整,无液化、坏死等征象,且剥离过程中病灶与肌层明显粘连,剥离血管丰富易出血。但术后病理及免疫组化提示胃淋巴上皮瘤样癌。该病变好发于老年男性,临床上常表现为腹部不适、反酸、胀痛、呕血等,绝大数表现为近期症状加重,但是消化道症状无明显特异性。典型的内镜下表现为隆起型病变,中央伴有凹陷、浅溃疡形成,边界清晰[4]。由于肿瘤表面覆盖正常黏膜,内镜常规活检通常无法取到癌组织,超声内镜可以清楚显示病灶性质、大小、起源和与周围关系,但是超声内镜下常表现为黏膜下肿物,常无法与其他常见的黏膜下肿物鉴别。对于CT检查,能判断病灶性质、位置及淋巴结转移情况,虽然不能明确诊断,但是对后续的治疗有进一步指导的意义。胃LELC术前诊断困难,主要依靠病理组织学及免疫组化确诊,进行EBER原位杂交试验是关键,如果阳性,可确诊为胃LELC[5]。该病的主要特点是肿瘤内部含有丰富的淋巴样间质细胞,边界不规则,呈浸润生长,是一种罕见的具有特殊临床病理学特点的低分化腺癌。在大量淋巴细胞的背景下,瘤细胞呈团状、巢状、条索状分布。利用原位杂交的方法检测出定位在肿瘤细胞核中的EBER,而周围胃黏膜及淋巴样细胞阴性。本研究中采用原位杂交的方法在癌组织中检测到了EBV编码的小RNA,从而考胃LELC可能与EBV感染有关。有研究表明,EBV感染胃黏膜上皮细胞,使许多癌症相关基因(p16、p73、E-cadherin等)的启动区GpC岛发生甲基化而表达下调,最终导致肿瘤的发生[6]。
近年来多项研究表明了肿瘤微环境对指导治疗、判断预后具有重要指示作用。其中,肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TIL)和免疫抑制因子是其重要的组成成分。近年来,免疫抑制因子程序性死亡分子-1(programmed death-1,PD-1)/程序性死亡分子配体-1(programmed death ligand-1,PD-L1)抑制剂在恶性肿瘤领域已取得显著的进展。Tumeh等[7]研究肿瘤组织中CD8+TIL的表达与PD-L1呈正相关,PD-1/PD-L1抑制剂效果越强。唐敏等[8]研究提出胃LELC中存在的肿瘤微环境具有肿瘤浸润淋巴细胞丰富、PD-L1高表达等特点。PD-1/PD-L1抑制剂有望成为治疗胃LELC的一种有效手段。
目前治疗仍同传统腺癌治疗,以手术根治性切除+化疗辅助治疗为主,较传统胃腺癌具有较好的预后,对于是否需要进行放疗治疗文献报道较少。胃LELC病例罕见,术前诊断存在困难,EUS及CT可以为治疗提供进一步指导意义,但是具有其特征性组织病理学及免疫学改变是明确诊断的关键。


























