
超过60%的胃神经内分泌肿瘤(gastric neuroendocrine neoplasms,G-NENs)内镜下病变表现为多发病灶,可为息肉样隆起、黏膜下来源的肿瘤,或为丘疹、糜烂、溃疡性病灶,病变多局限于黏膜层或黏膜下层,病灶多数<10 mm,平均5 mm。1型G-NENs中,约22%病例内镜下并无任何肉眼可见的病灶,只有通过胃体、胃底的盲检,显微镜下才能发现病灶,即微小类癌。本例患者胃镜下并无任何肉眼可见的隆起型病灶,因一次随机活检,才得以发现病变。本文结合该例病变内镜下表现及其临床特征,以提升诊断G-NENs的经验。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,28岁,因发现巨幼细胞性贫血6年余来我院行胃镜检查,平素无任何消化道不适。患者6年前曾于外院胃镜检查示慢性萎缩性胃炎,未予活检;3个月前诊断毒性弥漫性甲状腺肿(Graves病),目前服用甲巯咪唑治疗。辅助检查:血红蛋白126 g/L,维生素B12 50 pg/mL,叶酸43.13 ng/mL,铁蛋白80.8 ng/mL,壁细胞抗体(-),内因子抗体(+),胃泌素251.04 pg/mL,血嗜铬粒蛋白A 171.79 ng/mL。甲状腺功能五项检查:抗甲状腺过氧化物酶抗体(aTPO)3 259.1 U/mL,甲状腺球蛋白抗体(TGAb)18.4 U/mL,血清游离三碘甲腺原氨酸(FT3)>20.0 pg/mL,血清游离甲状腺素(FT4)3.81 ng/dL,促甲状腺激素(TSH)0.004 μIU/mL。13碳呼气试验、粪便幽门螺杆菌抗原均为阴性。腹部磁共振成像检查未见异常。
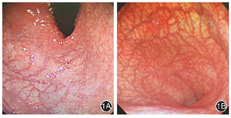
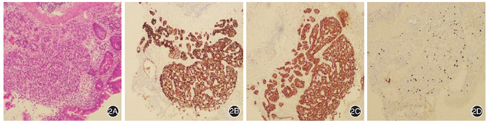
遂于我院行首次胃镜检查,诊断:慢性萎缩性胃炎(胃体、胃底)(图1A)。胃体随机活检,病理检查显示慢性中度炎症,重度肠上皮化生,局灶固有层见密集细胞形成巢状结构,细胞胞浆减少,细胞核呈圆形、深染,未见明确核分裂像。免疫组化检查示AE1/AE3(+)、CD56(+)、CgA(+)、SYN(+)、Ki-67(+,约1%),符合神经内分泌肿瘤(1级)。为明确诊断复查胃镜,见胃体、胃底黏膜明显变薄,红白相间,以白为主,黏膜下血管网透见,胃窦黏膜正常(图1B),仍诊断:慢性萎缩性胃炎(胃体、胃底)。胃窦、胃体前后壁、胃体大小弯、胃底随机多点活检,病理检查示胃底、胃体呈末期慢性萎缩性胃炎,伴广泛肠化;胃体小弯、胃体后壁、胃体大弯有肠嗜铬样细胞增生,接近神经内分泌肿瘤;胃体前壁呈神经内分泌肿瘤G1(类癌);胃窦、胃角呈轻度慢性炎,未见萎缩。免疫组化检查示胃体前壁CgA(+)、SYN(+)、CD56(+/-)、AE1/AE3(弱+)、Ki-67(+,约2%),符合神经内分泌肿瘤(1级)(图2)。目前诊断:1型胃神经内分泌肿瘤(gastric neuroendocrine neoplasms,G-NENs)G1级;自身免疫性胃炎;Graves病。治疗:建议每1~2年定期复查胃镜+活检随访G-NENs。


G-NENs根据2016年欧洲神经内分泌肿瘤学会(European Neuroendocrine Tumor Society,ENETS)相关指南可分为3型(表1)[1]。其中1型G-NENs占70%~80%,常伴有胃泌素升高,合并自身免疫性胃炎,部分患者可无明显临床症状,肝脏及淋巴结转移风险低,肿瘤相关死亡率为0,预后好。2型G-NENs常合并高胃泌素血症,表现为难治性消化性溃疡,部分2型G-NENs可合并甲状旁腺、胰岛细胞、垂体肿瘤。3型G-NENs发病率介于1、2型G-NENs之间,恶性程度最高,易发生淋巴和血行转移,肿瘤相关死亡率明显高于1型、2型G-NENs。G-NENs内镜下超过60%的病例表现为多发病灶,可为息肉样隆起、黏膜下来源的肿瘤,或为丘疹、糜烂、溃疡性病灶,病变多局限于黏膜层或黏膜下层,主要累及胃底、胃体,以胃体部最为多见,病灶多<10 mm,平均5 mm[2,3]。其中1型和2型G-NENs内镜下多表现为多发息肉样隆起,病灶常<2 cm,病变多局限于黏膜层或黏膜下层。3型G-NENs内镜下多表现为巨大息肉样、溃疡性病变,病灶常>2 cm,其生物学行为与胃癌类似。

不同分型胃神经内分泌肿瘤的临床表现[1]
不同分型胃神经内分泌肿瘤的临床表现[1]
| 临床表现 | 1型 | 2型 | 3型 |
|---|---|---|---|
| 各型占比(%) | 70~80 | 5~6 | 14~25 |
| 肿瘤特点 | 常为小病灶(<2 cm),65%为多发,其中78%表现为多发息肉样 | 常为小病灶(<2 cm),表现为多发、息肉样 | 单发,病灶常>2 cm,表现为息肉样、溃疡样 |
| 相关疾病 | 胃体萎缩性胃炎 | 胃泌素瘤/垂体肿瘤 | 无 |
| 病理分级 | G1~G2 NET | G1~G2 NET | G3 NEC |
| 血清胃泌素水平 | 升高 | 升高 | 正常 |
| 胃pH值 | 明显升高 | 明显降低 | 正常 |
| 转移比例(%) | 2~5 | 10~30 | 50~100 |
| 肿瘤相关死亡比例(%) | 0 | <10 | 25~30 |
注:NET指神经内分泌肿瘤;NEC指神经内分泌癌
对于内镜医生来说,只要内镜下发现疑似病灶,活检病理加免疫组化诊断G-NENs并不难。但在1型G-NENs中,约22%病例内镜下并无任何肉眼可见的病灶,只有通过胃体、胃底的盲检,显微镜下才能发现病灶,即微小类癌[4],甚至个别病例需通过放大胃镜加窄带成像技术才能找到微小病灶[5]。检索国内外的文献,罕有此类微小类癌的报道,即使有胃微小神经内分泌肿瘤的个案报道,内镜下也是表现为肉眼可见的直径1~2 mm的微隆起型结节[6]。对于内镜下肉眼可见的病变,不管是表现为微小隆起型结节,还是微小的糜烂、溃疡或丘疹样红斑,内镜医生只要认真仔细规范地完成胃镜检查,均可发现病灶并进行活检病理明确诊断。而本文中的病例,患者无任何消化道不适症状,内镜下亦无任何肉眼可见的隆起型病灶,普通白光胃镜下表现为慢性萎缩性胃炎,如当时内镜医生未进行随机活检,就会造成G-NENs漏诊。
由于1型G-NENs多为惰性生长,病灶可长期随访观察。有研究者推荐以活检钳钳除所有可见病灶,而对>5 mm的病灶行内镜黏膜切除术[7]。ENETS指南推荐:对于≥1 cm的肿瘤,可考虑内镜下切除,术前需行超声内镜检查评估转移风险。此病例中的患者胃镜下并无任何肉眼可见的隆起型病灶,故建议每1~2年定期复查胃镜+活检随访。
综上,通过学习此病例以及复习相关文献,我们认为内镜医生应提高对G-NENs的内镜下表现的认识,特别是加强对微小病灶的识别。应当密切结合患者病史、临床特征,仔细规范地完成胃镜检查,对有易患G-NENs风险者(如幽门螺杆菌检查呈阴性、胃体为主的慢性萎缩性胃炎患者,或者自身免疫性胃炎,且病史>2年的患者),胃镜检查时即使内镜下无肉眼可见的隆起型病灶,也应行随机多点活检(特别是对胃体四壁处),以提高G-NENs诊断的阳性率。而对于明确诊断为胃微小神经内分泌肿瘤的患者,长期内镜随访时可考虑行放大胃镜+窄带成像技术以及内镜下的染色技术以避免遗漏胃微小病灶。
所有作者声明不存在利益冲突



























