
Borrmann Ⅳ型胃癌又称皮革胃,在内镜下表现为胃黏膜皱襞肥厚、融合,因肿瘤细胞浸润至黏膜下层,内镜下活检表面黏膜常出现假阴性结果。对内镜医师而言,如何准确获取病灶部位以病理确诊仍是一个挑战。本文报道1例反复内镜活检阴性的皮革胃患者,最终通过内镜下线性黏膜切开后深挖活检术确诊。该方法为皮革胃内镜下获取病理诊断提供一种新思路。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
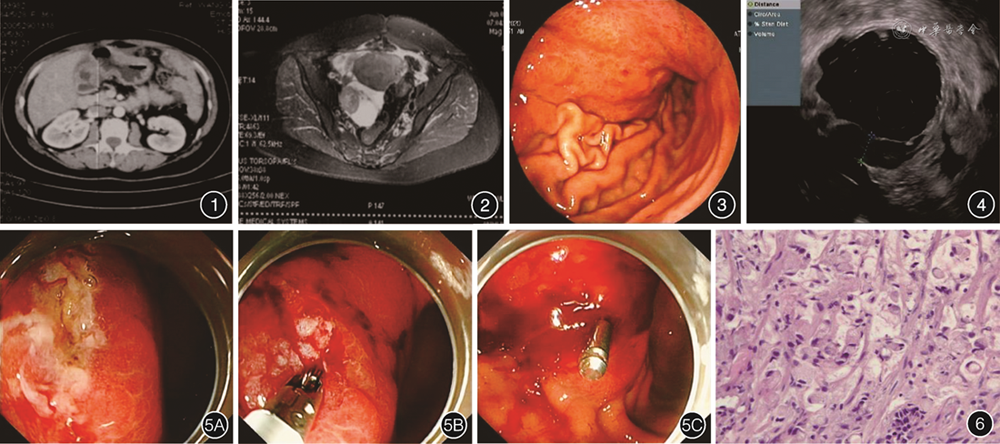
患者女,35岁,因“产后月经不规律2个月余”至当地医院就诊,发现“盆腔肿块”。行全腹部增强CT:胃角增厚强化,网膜、腹膜多发结节,盆腔肿块,直肠壁增厚,转移可能,子宫增大并强化不均,肝胃间隙稍大淋巴结,肝脏小囊肿,腹盆腔少量积液(图1)。盆腔MRI:盆腔内右侧附件区团块状软组织信号,网膜、腹膜结节状不均匀增厚(图2)。PET-CT:胃窦及相邻胃体大弯侧及小弯壁软组织增厚并氟代脱氧葡萄糖(fluorodeoxyglucose,FDG)摄取增高,右侧附件区混杂密度肿块并FDG摄取增高,大网膜、肠系膜区及盆底腹膜软组织增厚并FDG摄取增高,胃小弯侧、胃窦旁、腹膜后多发淋巴结并FDG摄取增高,均考虑恶性肿瘤累及,以胃癌伴多发淋巴结转移、腹膜种植转移、右侧卵巢种植转移可能性大,原发性卵巢癌不排外,腹盆积液。胃镜:胃体黏膜病变,活检组织病理:(胃体)黏膜慢性炎伴息肉状增生。血CA125:452 U/mL。患者为进一步确诊,至我院门诊行环扫内镜超声检查(endoscopic ultrasonography,EUS):胃体中下部前壁及大弯侧见弥漫黏膜肥厚、粗糙、发红,未见明显凹陷性病灶,受累处胃壁僵硬,蠕动差,病变范围累及胃角(图3),以12 MHz 超声探头扫查,可见病灶处局部全层增厚,呈不均匀低回声改变,层次结构不清,呈融合改变,其中一处厚度约11 mm(图4),于内镜视野下局部深挖活检7块。病理提示:浅表黏膜慢性炎。为进一步明确诊断,行内镜下线性黏膜切开后深挖活检术(图5):术中于胃体中下部前壁黏膜增厚处注射含有稀释肾上腺素、亚甲蓝及甘油果糖的注射液,黏膜下层质地硬,黏膜无法抬举,后用一次性黏膜切开刀于病灶处将黏膜层线形切开,切开长度0.6~0.8 cm,再予一次性活检钳从切开处深挖活检,术后局部创面无活动性出血,以钛夹1枚夹闭创面。术后患者病情稳定,无腹痛、呕血、黑便。活检病理:胃黏膜组织,局灶见核偏位细胞,核增大,部分可见核仁(图6)。免疫组化见肿瘤细胞表达AE1/AE3、CK7、EMA、CAM5.2、Ki67(约5%+)、P53(野生型),不表达Vimentin及CD34。结合临床及免疫组化表型,考虑为胃低分化腺癌(印戒细胞癌)。

Borrmann Ⅳ型胃癌又称皮革胃,其特征是胃底腺区域黏膜中存在未分化的癌细胞,起初表现为局灶的Ⅱc型黏膜内癌,在溃疡发生前肿瘤细胞在黏膜下弥漫性浸润,伴有纤维组织增生,导致胃皱襞肿胀,胃壁增厚、僵硬[1]。对于内镜下所见胃壁增厚,需要与皮革胃鉴别诊断的疾病包括胃淋巴瘤、转移性胃癌、Menetrier病、梅毒、克罗恩病、结核导致的特异性胃炎、巨细胞病毒感染、淀粉炎样病变等[1, 2],这些疾病的治疗策略完全不一样,因此及时准确的诊断非常有必要,否则影响下一步治疗及患者预后。
近年来围绕Borrmann Ⅳ型胃癌等胃弥漫性浸润性病变的内镜下病灶组织诊断,有许多文献报道。2012年Kodani等[3]报道对1例硬性胃癌患者行透明帽辅助下黏膜圈套切除术明确诊断。但该方法有出血风险,且对于无局限性隆起性病灶,尤其是合并纤维组织时,很难进行圈套操作。亦有虽然行透明帽辅助下黏膜圈套切除术后再活检,但仍无法确诊的病例报道[4]。Chiyo等[5]借鉴胃黏膜下肿瘤活检取样[6]方法,采用内镜下黏膜剥离术,对病灶周边正常黏膜切开,形成黏膜下瓣,再用活检钳进入黏膜下层进行病灶活检明确诊断。内镜超声引导下细针抽吸术(endoscopic ultrasound-guided fine needle aspiration,EUS-FNA)可以诊断导致胃壁弥漫增厚的病变,一项回顾研究纳入24例诊断皮革胃的患者,发现EUS-FNA对胃壁病灶的诊断准确性并不高,相对于穿刺转移性淋巴结,诊断准确率低(54.2%比75%)[7]。另一项研究也发现EUS-FNA诊断皮革胃型胃癌的阳性率为71.43%,而对胃周转移性淋巴结的诊断率为93.75%[8],也证实对皮革胃患者,穿刺淋巴结阳性率要高。EUS-FNA能够获取黏膜下层组织,但是由于技术本身因素,有时候难以获取大小合适的组织用于病理组织学诊断,满足不了临床上对肿瘤精准诊断(基因测序、免疫组化)日益增加的需求。Zhou等[9]报道对于胃内浸润性肿瘤,在EUS引导下采用EMR法(圈套器圈套切除病灶表面覆盖的黏膜)、深挖活检法(当黏膜平坦或黏膜下层难以抬举时),诊断阳性率分别为82.1%、75%。Liu和Yang[10]报道采用一种垂直于黏膜的电圈在病变黏膜上切开一个洞,再进行深挖活检,用于诊断胃浸润性肿瘤及黏膜下肿瘤。当然,如果通过内镜下手段仍无法获得病理诊断时,腹腔镜下对浆膜层进行活检是一种可以考虑的策略[2]。
对于皮革胃,由于黏膜下层的纤维化明显,黏膜下注射往往无法形成黏膜下隆起,并且病变处胃壁明显增厚,在内镜超声评估后,可以直接进行病灶处线形切开黏膜,笔者认为这是一种可行、安全的方法。对于切开、活检后出血,内镜下进行喷洒止血药物、电凝止血、钛夹夹闭等措施可有效止血,因局部胃壁僵硬、增厚,黏膜切开基本无穿孔风险。因此,内镜下线性黏膜切开后深挖活检术是一种有效、可行的诊断皮革胃的方法,但需要更多的病例验证其有效性、安全性。
所有作者声明不存在利益冲突



























