
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,42岁。因发热2周入院,期间最高体温39 ℃,伴体质量下降、咳嗽咳痰等不适,无明显盗汗,无恶心呕吐、头痛头晕、腹泻纳差等。体格检查:体温37.8 ℃;右侧颈部及双侧颌下多发肿大淋巴结,质韧,活动度尚可,最大直径可至2 cm;心、肺、腹部检查未及明显异常。实验室检查:血、尿常规、血生化无异常;肿瘤标志物无异常;血红细胞沉降率38(正常参考值范围0~15) mm/1 h;结核抗体阴性。胸部CT示:双肺散在少许模糊片状影,左侧胸腔积液;纵隔、双肺门及双侧腋窝淋巴结增多,部分增大伴钙化。
18F-脱氧葡萄糖(fluorodeoxyglucose, FDG) PET/CT(美国GE Discovery Elite 64)显像(图1)示:(1)左肾占位,代谢无明显增高;(2)双侧腮腺深部、双侧颈部、双侧锁骨上下、纵隔及双肺门、双侧腋窝、肝胃间隙、肠系膜、盆腔及双侧腹股沟区淋巴结增多,部分增大伴多发钙化,代谢无增高;(3)双肺散在少许感染,左侧胸腔积液。患者入院行抗炎治疗2周后,咳嗽咳痰症状好转,体温恢复正常。
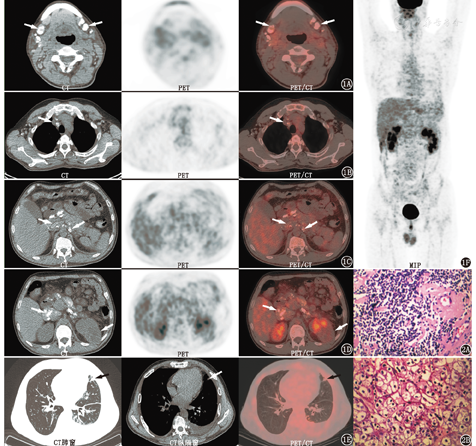

右颈部淋巴结活组织病理检查(图2)示:淋巴结广泛玻璃样变性伴钙化,散在成熟的小淋巴细胞,小血管壁玻璃样变,未见明显淋巴滤泡结构。结合免疫组织化学及临床检查,诊断:非霍奇金B细胞淋巴瘤(惰性),符合边缘区淋巴瘤,但小淋巴细胞淋巴瘤难以完全排除。免疫组织化学检查:肿瘤细胞CD20(+),CD79α(+),B细胞特异性激活蛋白PAX-5 (+),B细胞淋巴瘤/白血病-2(B-cell lymphoma/leukemia-2,Bcl-2)蛋白(+),CD23(+),CD43(弱+),CD21[残存滤泡树突状细胞(follicular dendritic cell,FDC)网+],CD3(-),CD5(-),CD10(-),BCL-6(-),细胞周期蛋白CyclinD1 (-),Kappa (-),Lamda (-),IgG(-),IgG4(-),CD138(-),细胞增殖核抗原Ki-67标记指数:5%左右。左肾占位切除术后病理示:左肾透明细胞癌(Furhman分级:Ⅱ级)。
非霍奇金惰性B细胞淋巴瘤包括小淋巴细胞淋巴瘤/慢性淋巴细胞白血病、Ⅰ~Ⅱ级滤泡性淋巴瘤、边缘区淋巴瘤、淋巴浆细胞淋巴瘤、毛细胞白血病、脾脏不能分类的淋巴瘤/白血病。惰性淋巴瘤恶性程度较低,进展缓慢,绝大多数患者在就诊时已处于中晚期,但该病会复发,组织类型可转变为侵袭性淋巴瘤。结内边缘区B细胞淋巴瘤(nodal marginal zone B-cell lymphoma, NMZL)是少见的非霍奇金B细胞淋巴瘤(惰性),仅占淋巴瘤的1.5 %~1.8%[1],可向弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)转化或继发于经典霍奇金淋巴瘤(Hodgkin′s lymphoma, HL)。NMZL一般见于成年人,大部分患者就诊时无明显症状,少数患者有全身症状(发热、体质量减轻、盗汗),最常见体征为局部或全身淋巴结肿大,以头颈部淋巴结多见,可累及骨髓[2]。其他可能出现的情况包括贫血、血小板减少症、血清M蛋白阳性、合并自身免疫性疾病及HCV阳性等[3]。大多数NMZL的国际预后指数为低危或低中危,化疗后能获得完全缓解,预后较好。本例患者发热考虑为肺炎引起,而非淋巴瘤的全身症状。
淋巴瘤治疗前的钙化罕见[4,5,6],可见于DLBCL、Burkitt淋巴瘤、套细胞淋巴瘤、外周T细胞淋巴瘤及HL,其中绝大多数为高度侵袭性。Apter等[6]报道956例淋巴瘤治疗前的钙化出现率约为0.84%,8例淋巴瘤治疗前钙化中5例为纵隔病灶钙化,3例为腹腔病灶钙化;此8例淋巴瘤均具较高的侵袭性,疗效及预后欠佳。上述文献[4,5,6]报道的淋巴瘤治疗前钙化均由CT发现,难以了解病灶的代谢水平。
病理性钙化通常包括转移性钙化和营养不良性钙化。成人T细胞淋巴瘤可引起破骨细胞的激活、骨吸收增强及高钙血症,导致双肺转移性钙化[7];DLBCL合并肾细胞癌以高血钙危象为首发症状亦见报道[8]。营养不良性钙化则常继发于局部组织的变性或坏死,更易在侵袭性非霍奇金淋巴瘤(non-Hodgkin′s lymphoma, NHL)中出现。淋巴瘤组织梗塞、变性或坏死并不罕见,但一般不会导致钙化,淋巴瘤治疗前钙化可能存在某些未知影响因素。淋巴瘤治疗后钙化通常出现在治疗后8个月,可能是治疗后淋巴瘤浸润组织的营养不良性钙化,其出现往往提示良好的疗效和预后。本例患者血钙正常,且为惰性淋巴瘤,推测其治疗前钙化是病史较长,免疫系统的波动使淋巴瘤病灶处于长期的缓慢进展和自我修复状态所致,但该患者预后有待进一步随访观察。
惰性淋巴瘤侵袭性较低,进展缓慢,18F-FDG摄取通常不高且稳定性差。尽管文献[9,10]报道NMZL几乎均为18F-FDG高代谢,但由于病例数较少,尚需进一步证实。本例患者淋巴瘤组织18F-FDG摄取无增高,可能与惰性淋巴瘤及多发钙化有关。另外,本例的淋巴结病理可见细胞外广泛玻璃样变性,考虑病灶含有丰富的纤维瘢痕组织,可能也是影响18F-FDG摄取的因素之一。
本例患者并发肾透明细胞癌Ⅱ级,但18F-FDG摄取无增高,可能是肾透明细胞癌细胞膜的葡萄糖转运蛋白1(glucose transport protein 1, Glut1)表达较低,线粒体内己糖激酶活性也较低,导致约半数左右的肾癌病灶18F-FDG摄取并不高。淋巴瘤并发第2肿瘤并不少见,其中白血病及乳腺癌较为常见。文献[11]报道,NHL合并肾细胞癌并非巧合,其原因可能与NHL患者生存期的延长、放化疗的不良反应、共同存在的遗传变异、免疫因素及病毒感染等有关。
综上,极少数淋巴瘤患者治疗前可出现钙化,不能凭多发钙化而排除淋巴瘤。淋巴瘤也可合并其他原发恶性肿瘤,且某些惰性淋巴瘤及肾脏原发恶性肿瘤可表现为18F-FDG摄取无增高,进行18F-FDG PET/CT诊断时应综合考虑。
无


























