
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
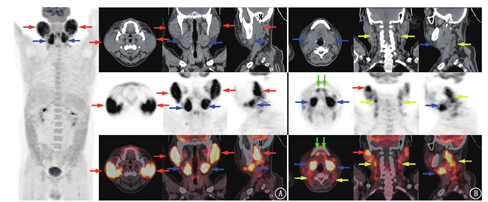
患者男,37岁,因"双侧腮腺肿大伴疼痛17个月余,加重1个月余"入院。患者17个月前发现双侧腮腺及下颌角处无明显诱因肿大,并逐渐增大,伴胀痛、发痒。自述双眼干涩及轻度口干,部分皮肤颜色呈淡褐色改变,伴瘙痒。无发热等其他病史。体格检查:躯干、四肢广泛分布直径约0.5 mm左右的淡褐色丘疹,部分抓破结痂,小腿部位见少量红斑;双侧腮腺及下颌角处肿大明显,质韧,皮温高,伴有触痛;双侧颌下及颈部可扪及数枚肿大淋巴结,质韧,活动度差,触之无痛感;口唇无明显紫绀,张口受限。实验室检查:WBC计数17.7(括号中为正常参考值范围,下同:3.5~9.5)×109/L、嗜酸性粒细胞计数1.00(0.02~0.52)×109/L,中性粒细胞计数13.2(1.8~6.3)×109/L,免疫球蛋白(immunoglobulin, Ig)E 8.7×107(<1×106) U/L,乳酸脱氢酶426(120~230) U/L,超敏C反应蛋白12(<6) mg/L,红细胞沉降率16(0~15) mm/1 h,肝肾功能、男性肿瘤系列(包含癌胚抗原及铁蛋白等)、IgG亚型(IgG4)测定、干燥综合征相关自身抗体等未见明显异常。彩色超声示双侧腮腺弥漫性损害,双侧颈部淋巴结肿大。CT示双侧涎腺肥大,密度增高,腺体明显均匀性强化,考虑炎性反应并颈部淋巴结反应性增生。18F-脱氧葡萄糖(fluorodeoxyglucose, FDG) PET/CT(美国GE Discovery STE16型)显像示双侧涎腺(包括双侧腮腺、双侧颌下腺及双侧舌下腺;图1A)、颈部两侧及右侧锁骨上淋巴结(图1B)FDG代谢异常增高,考虑炎性病变的可能性大;脾脏及全身多骨骼/骨髓FDG代谢增高,考虑反应性改变可能性大。骨髓细胞形态学检查结果符合反应性骨髓象。左颈部淋巴结活组织检查(简称活检;图2)示淋巴组织反应性增生,副皮质区血管增生伴较多嗜酸性粒细胞浸润;免疫组织化学分析示CD20(B细胞,+),CD3、CD7(T细胞,+),CD21(滤泡树突细胞,+),CD1a(-),B淋巴细胞瘤(B-cell lymphoma, Bcl)-2(生发中心,-),Bcl-6(生发中心,+),细胞增殖核抗原Ki-67生发中心阳性较密集,周边阳性较稀疏,符合木村病,给予甲泼尼龙琥珀酸钠、沙利度胺、环磷酰胺等药物治疗后患者症状好转并出院。

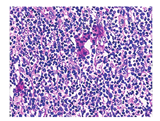

木村病又称Kimura病,病因不明,是一种少见的良性慢性软组织炎性病变,该病最早由我国金显宅教授于1937年报道,1948年日本学者木村以"伴有淋巴组织增生的特殊肉芽肿"的描述进行了较为详细的报道[1,2]。木村病好发于中国、日本及东南亚地区,其男女发病比例及好发年龄文献报道差异较大,1项我国444例木村病的研究报道发病年龄多在20~50岁,男女比例为3.5∶1~9∶1[2]。该病以头颈部的皮下软组织肿块并累及涎腺及区域淋巴结为主要临床表现,可累及肾脏,表现为肾病综合征[2]。目前多数学者认为该病与过敏、自身免疫及感染有关[3,4]。实验室检查多伴有嗜酸性粒细胞及IgE升高。影像学检查可发现不同受累部位软组织肿大或累及淋巴结的表现。影像学表现多样,无特异性表现,CT平扫可表现为等密度或略低密度边界清或不清的皮下肿块,增强扫描时呈均匀或不均匀强化[3,4];MRI检查可表现为T1加权成像(weighted imaging, WI)等或稍高信号、T2WI高信号,可伴点状、条状血管流空信号,增强扫描时呈不均匀强化[3,4,5,6]。Syed等[5]报道木村病的MR弥散WI表现为受累腮腺低信号、受累淋巴结高信号,而表观弥散系数(apparent diffusion coefficient, ADC)图像信号表现相反,并认为这是木村病的一个特异表现。本病的确诊依据活检和病理学检查,组织学上以小血管增生、大量嗜酸性粒细胞浸润、淋巴细胞增生及滤泡形成等为基本病变[4]。
本例患者为中年男性,病程近18个月,表现为慢性进展性。双侧腮腺及下颌角处肿大并双侧颌下及颈部可扪及数枚肿大淋巴结。实验室检查WBC计数、中性粒细胞计数、嗜酸性粒细胞计数、IgE均增高。18F-FDG PET/CT显像示双侧涎腺对称性明显肿大,密度欠均匀且高度摄取FDG;颈部两侧多区及右侧锁骨上可见多枚高度摄取FDG的淋巴结影,诊断结论考虑炎性病变。左颈部淋巴结活检示淋巴组织反应性增生,副皮质区血管增生伴较多嗜酸性粒细胞浸润,符合木村病。该病应与下列疾病进行鉴别:(1)流行性腮腺炎,主要发生在儿童和青少年,起病急,有发热、头痛等症状,呈自限性病程;(2)慢性化脓性腮腺炎,常表现一侧或两侧腮腺肿痛,进食或看见食物可加剧腮腺区的疼痛与肿大;(3)淋巴瘤,可累及全身各组织器官,可有乳酸脱氢酶的升高;(4)Mikulicz病,又称良性淋巴上皮病,为IgG4相关性疾病的一种,以双侧对称性唾液腺及泪腺肿胀为主要表现,血液检查多显示IgG4升高[7]。
木村病在18F-FDGPET/CT显像中常表现为病灶的高度FDG摄取,与炎性反应、淋巴瘤或恶性肿瘤等疾病不易鉴别。Li等[8]报道了1例病理诊断为木村病的肺门肿块,其18F-FDG PET/CT显像表现为肿块高度显像剂浓聚,与恶性病变不易鉴别。Yang等[9]报道了1例表现为左颈部、左锁骨上、左腋窝及纵隔淋巴结肿大并高度摄取FDG而类似淋巴瘤的木村病病例。本例患者病程长,进展缓慢,提示良性病变,因患者IgG4、干燥综合征相关自身抗体均为阴性,且泪腺不受累,故可以排除Mikulicz病及干燥综合征;而流行性腮腺炎和化脓性腮腺炎具有典型临床表现,也可排除。该患者的头颈部病变双侧对称并累及区域淋巴结,较易诊断为慢性炎性病变,结合嗜酸性粒细胞及IgE明显升高,高度提示木村病。
总之,PET/CT的诊断既要仔细分析显像结果,又要紧密结合患者的病史及实验室检查。当病变位于头颈部并累及涎腺及淋巴结、病灶FDG代谢明显升高、血液学检查伴有嗜酸性粒细胞及IgE升高时,要考虑木村病的可能性。
所有作者均声明不存在利益冲突


























