
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,49岁,主诉右肩关节活动受限半年,体格检查发现右肩关节肿胀明显,无压痛,右肩关节活动受限,右上肢自肩关节以下麻木。X线片示右侧肱骨头骨质吸收、消失。患者既往患脊髓空洞症。为评估肩关节病变性质及其余骨骼受累情况行99Tcm-亚甲基二膦酸盐(methylene diphosponate, MDP)全身骨显像,结果示全身骨骼摄取好,显影清晰,未见全身性的骨代谢异常表现,软组织本底和肾影正常;右肩关节见放射性浓聚区,累及范围包括右肱骨头、右肩胛骨关节盂、肩峰、喙突;另可见右肩关节形态异常,肱骨头位于喙突下方,右上肢似处于强迫体位,考虑存在右肩关节脱位的情况;左肩关节亦见摄取增高区(肩胛骨关节盂、肩峰和喙突),增高程度较右侧明显低(图1)。
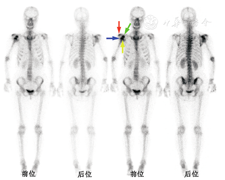

累及肩关节区域的病变主要包括感染性或炎性病变、退行性变和肿瘤性病变。对于单发的骨病变,由于骨显像信息量少,缺乏病变局部的细节信息,往往很难仅凭全身骨显像的放射性浓聚特点作出诊断。本例骨显像示除了肱骨头,病变亦累及组成肩关节的其他诸骨,并且伴肩关节脱位,结合患者脊髓空洞症的病史,考虑这是典型的夏科关节(亦称神经性关节病)表现。夏科关节是一种慢性退行性神经关节病变,是保护性感觉缺失引起的关节骨和软组织进行性破坏性疾病。各种神经系统疾病均可为夏科关节的病因,常见的包括脊髓空洞症、糖尿病性神经炎、脊髓损伤、周围神经炎、外周性神经损伤、麻风病和慢性酒精中毒等。正常的关节滑膜、关节囊、关节内韧带、肌腱、骨膜上分布大量的功能感受器及游离神经末梢,正常情况下游离神经末梢对炎性反应、疼痛刺激、高阈值的机械应力产生反应,促进释放肽类物质对关节产生保护作用,并对慢性损伤作出修复反应。当支配关节的神经功能障碍时,正常的关节保护性反应消失,加上局部软组织和骨的营养障碍,使局部骨代谢紊乱、关节囊和韧带结构松弛。由于患者缺乏感觉,不能自动纠正不良姿势,使关节过度负荷和应力集中,关节结构在反复的机械性损伤后发生退变并呈进行性加剧,软骨可完全剥脱、软骨下骨骨折、游离体形成;另外由于关节囊和韧带变性松弛,也可产生关节半脱位[1],本例就发生了肱骨近端和肩胛骨关节面损伤以及肩关节半脱位。
由于夏科关节继发于神经性因素,因此神经系统相关病史是诊断夏科关节的前提。夏科关节多为单发性,以负重大、活动多、周围软组织少的关节最容易受累,如膝关节、肩关节、肘关节、腕关节、踝关节等。发病的关节与原发的神经系统疾病相关,如糖尿病神经性关节病多累及足部关节,有时可累及膝关节;而脊髓空洞症是导致肩关节及肘关节发生夏科关节的主要原因,约6%的脊髓空洞症患者会出现夏科关节[2]。夏科关节的X线片以骨溶解吸收为主要表现,严重者大块骨质均可吸收、消失,骨吸收后可继发修复改变,出现大量骨膜反应和骨赘形成,有滑膜或关节囊钙化及关节内游离体,有时可伴骨折和脱位[1,3]。对于早期病变,X线片并不敏感,MR可发现早期病变时软骨下的骨髓水肿和隐匿性骨折以及韧带、肌腱的病变。
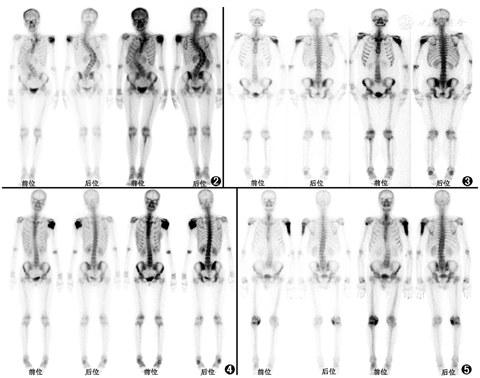
由于夏科关节的病理机制伴随骨质破坏和重塑过程,累及部位会在骨显像上表现为放射性摄取增高,但此表现不特异,难以仅凭放射性浓聚特点将该病和其他疾病区分开来。本例发生于肩关节的夏科关节需要与发生于肱骨头的肿瘤性病变相鉴别。图2为另一例夏科关节病例(患者女,28岁),患者因左肩疼痛就诊,既往有脊髓侧弯、脊髓空洞症病史,全身骨显像可见左肱骨头放射性摄取异常增高灶,似呈肿块样;左肱骨近端病灶部分切除活组织检查(简称活检)的病理提示未见肿瘤,结合病史考虑为夏科关节。图3病例(患者男,18岁)主诉左肩活动后疼痛、左上肢无力2年余,既往史无特殊,全身骨显像见左肱骨头放射性浓聚灶,X线片提示左肱骨头类圆形低密度肿物,手术后病理提示骨巨细胞瘤。图4病例(患者女,20岁)主诉左肩疼痛伴活动受限8个月,骨显像示左肱骨上段摄取异常增高肿物,手术病理诊断为骨肉瘤。图5病例(患者男,76岁)主诉左肩部疼痛伴活动受限,X线片提示左肱骨上段可见高低不等混杂密度阴影,CT提示左侧肱骨上段可见穿凿样、虫蚀样破坏,其周围可见骨膜反应,髓腔内密度增高,周围软组织肿胀;全身骨显像见左肱骨上段放射性摄取增高灶,病变从肱骨骨端延伸至骨干,右肱骨头亦见点状浓聚灶,后进一步检查发现胰尾部占位,行左肱骨病灶活检,病理提示腺癌,考虑为胰腺癌骨转移。以上病变在骨显像中表现较相似,尤其是肩部夏科关节与肱骨头原发骨肿瘤的表现,鉴别诊断时需要注意结合病史,关注病变的生长方式、累及范围等。夏科关节的诊断要点包括明确的神经系统疾病病史和表现,如糖尿病、脊髓空洞症等,临床表现为进行性关节肿大、过度活动和畸形、疼痛不明显;X线检查可见关节结构紊乱或畸形、关节端碎裂和游离体形成、骨膜反应及骨赘形成、骨端硬化、关节肿大和异位钙化;影像学上往往关节破坏严重,但患者自觉症状相对较轻。

夏科关节若进一步发展可出现关节畸形、溃疡、感染,尤其是继发于糖尿病的神经性关节病合并感染的概率更高。当怀疑夏科关节合并骨髓炎时,考虑到两者治疗方法不同,需要鉴别是否存在骨髓炎的情况。常规方法(如X线片、CT、MR、全身骨显像)通常难以鉴别[1,3],而骨三(四)相检查虽可用于鉴别骨髓炎和蜂窝织炎(骨髓炎在血流、血池和延迟期均表现为摄取增高),但不能区分夏科关节是否合并骨髓炎[4,5,6]。111In或99Tcm标记的白细胞在病变部位浓聚提示存在感染,可用于诊断骨髓炎。然而研究发现夏科关节在白细胞显像中也可与骨髓炎表现相似,这可能与骨髓反应性增生以及合并骨折时的修复活动有关[7]。白细胞显像结合骨髓显像(99Tcm-硫化锝)有助于提高诊断夏科关节合并骨髓炎的特异性:合并骨髓炎时表现为白细胞显像摄取增高、骨髓显像摄取减低;若骨髓显像表现为摄取正常或增高则提示非骨髓炎的可能性更大[7]。另外,18F-脱氧葡萄糖(fluorodeoxyglucose, FDG)PET/CT也可能有助于鉴别夏科关节合并骨髓炎的情况[8]。
对于骨骼系统的疾病,全身骨显像不是万能的,尤其是平面显像。诊断中要认识到骨显像的不足,掌握疾病典型特征,用其他信息去弥补。
所有作者均声明不存在利益冲突


























