
该篇继续教育对PET用放射性金属核素进行概述,介绍了基于其制备的放射性示踪剂的应用,重点阐述最常用的PET放射性金属核素68Ga、89Zr和64Cu及其优缺点。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
在核医学显像领域,放射性金属核素的应用已经不仅仅限于基于99Tcm放射性药物的SPECT显像。就诊断显像剂而言,使用发射正电子的放射性金属核素用于PET显像正成为一个快速发展的领域。例如,采用68Ga标记生长抑素类似物[如1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid, DOTA)-酪氨酸3-奥曲肽(DOTA-Tyr3-octreotide, DOTATOC)/D-苯丙氨酸1-酪氨酸3-苏氨酸8-奥曲肽(1, 4, 7, 10-tetraacetic acid-D-Phel-Tyr3-Thr8-octreotide, TATE)]和前列腺特异膜抗原(prostate specific membrane antigen, PSMA)配体(如HBED-cc-PSMA),分别用于神经内分泌肿瘤和前列腺癌的诊断,已在临床上成为标准。
放射性金属核素通常是通过双功能螯合剂(bifunctional chelating agent, BFCA)与靶分子相联,二者之间形成稳定的共价结合,以确保放射性探针在体内具有良好的稳定性(图1)。在许多情况下,螯合剂与靶分子之间会引入1个间隔基团,避免二者因距离过近而导致的潜在干扰。螯合剂包含多个具有不同功能的基团,以络合相应的金属核素,这种结构特征不仅使制备的放射性复合物具有高动力学和热力学稳定性,通常该过程还能快速且定量完成(螯合效应)。放射性金属核素可以通过与含有螯合剂修饰后载体的药盒反应,快速方便地制备放射性药物。螯合剂的选择取决于需要应用何种金属核素,而金属核素的选择又基于应用的目的。一些螯合剂可以螯合多种放射性核素,例如DOTA可以螯合68Ga、111In和177Lu。但是,一般情况下,金属核素都对应1套为其自身定制的螯合体系。

本文主要概述了目前常用的PET放射性金属核素,包括其物理性质、适合的螯合剂,并对其应用进行举例。68Ga、89Zr和64Cu是目前临床最为常用的3种PET金属核素,因此对这3种核素进行详细阐述。由于篇幅有限,文中所举示例未必详尽,但能够说明一些问题。
表1列举了几种PET放射性金属核素的物理性质和生产方式,其中几种高纯度核素目前已可在临床应用。
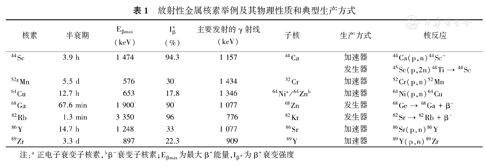
放射性金属核素举例及其物理性质和典型生产方式
放射性金属核素举例及其物理性质和典型生产方式
| 核素 | 半衰期 | Eβmax(keV) | Iβ+(%) | 主要发射的γ射线(keV) | 子核 | 生产方式 | 核反应 |
|---|---|---|---|---|---|---|---|
| 44Sc | 3.9 h | 1 474 | 94.3 | 1 157 | 44Ca | 加速器 | 44Ca(p,n)44Sc- |
| 发生器 | 45Sc(p,2n)44Ti → 44Sc | ||||||
| 52gMn | 5.5 d | 576 | 30 | 1 434 | 52Cr | 加速器 | 52Cr(p,n)52Mn |
| 64Cu | 12.7 h | 653 | 17.8 | 1 346 | 64Nia/64Znb | 加速器 | 64Ni(p,n)64Cu |
| 68Ga | 67.6 min | 1 900 | 90 | 1 077 | 68Zn | 发生器 | 68Ge → 68Ga + β- |
| 82Rb | 1.3 min | 3 350 | 96 | 776 | 82Kr | 发生器 | 82Sr → 82Rb + β- |
| 86Y | 14.7 h | 1 248 | 33 | 1 077 | 86Sr | 加速器 | 86Sr(p,n)86Y |
| 89Zr | 3.3 d | 897 | 22.3 | 909 | 89Y | 加速器 | 89Y(p,n)89Zr |
注:a正电子衰变子核素,bβ-衰变子核素;Eβmax 为最大β+能量,Iβ+为β+衰变强度
对于显像应用而言,放射性核素的半衰期应与其所标记靶分子的体内生物半衰期相匹配。例如,物理半衰期短的核素应与生物半衰期也同样较短的靶分子搭配(如小分子或肽类);而长半衰期核素适合标记抗体等大分子(免疫PET)用于显像缓慢的生物进程[1]。发射较低能量的β+射线是另外一个重要方面,因为正电子能量强度及正电子在组织中的穿透深度(直至湮灭)决定了PET图像的分辨率。合适的正电子核素衰变过程应具有高的正电子发射分支比,尽量少地伴随其他衰变类型。伴随发射高能量γ射线或粒子(α,β-)的衰变会影响PET图像质量,并增加受检者不必要的辐射损伤。
PET放射性金属核素的生产和应用在过去的20年中不断增长(图2),其原因主要有以下几点:首先,在21世纪早期,商用68Ge/68Ga发生器的推广以及68Ga-DOTATOC/TATE制备体系建立,使得诸多研究人员将目光投放于基于68Ga金属核素放射性探针的制备和研究上[2];其次,2010年左右开始的99Tcm供应危机刺激了PET核素的研究和生产[3];最后,89Zr和64Cu商业供应来源以及研究人员对于抗体类靶向分子研究兴趣的增加同时促进了这些核素的使用。
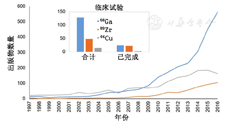

比较临床试验的数量就能看出68Ga的重要性及流行程度(图2)。有趣的是,虽然64Cu的文献报道更多,但89Zr相对于64Cu的临床试验更多。同时可以发现,89Zr的应用大多涉及对抗体进行标记,这表明89Zr已成为免疫PET的首选金属核素。
在放射性药物研究开发中,使用放射性金属核素的1个重要优点是可采用治疗用核素替代诊断用核素,从而将显像探针转化为放射靶向治疗探针。这种策略目前被称为诊疗一体化[4],不同文献对诊疗一体化有着不同的定义。
其中1个对于诊疗一体化的定义是:应用可以同时发射用于诊断和治疗2种射线的核素,例如177Lu [β-, γ][5]或64Cu[β-, β+][6]。这样可以通过调整注射剂量,应用同1个放射性药物进行显像以及放射靶向治疗,还可实现在治疗期间进行影像监测。
另一个定义是:应用相同的药效结构,分别络合诊断性核素或治疗性核素,进而实现显像和放射靶向治疗的目的。例如,99Tcm/186/188Re组合以及时下最常用的68Ga/177Lu组合[4]。除此之外,其他的诊断核素与治疗核素组合也不断地被报道。但要注意,二者需保持相似的体内药代动力学性质,最好可以达到理想化的完全相同。然而大部分情况下,二者之间存在部分性质上的差异[7]。
第3种定义是使用同一元素的不同核素进行显像诊断和治疗的应用,例如86Y(β+)和90Y(β-)。该法使2种药物在化学性质方面完全相同,进而保证了其相似的生物学代谢特性[8]。同时,对于辐射剂量计算,这种配对具有明显优势[9]。
不管定义(或其他方面)如何,诊疗一体化的出现为放射性药物和核医学研究的未来创新提供了令人兴奋的前景[9]。
在18F广泛应用前,68Ga已可通过68Ge/68Ga发生器方便获取[10]。事实上,早在20世纪60年代初,Anger和Gottschalk[11]便应用68Ga对世界上第1台正电子显像系统进行了测试。然而,直到21世纪,68Ga才受到关注并在临床广泛应用。目前,68Ga已成为1种应用最为突出的PET放射性金属核素[2]。原因为:(1)68Ga可通过发生器获取,方便易得;(2)目前已开发出多种基于68Ga的放射性示踪剂,且性能优异[9]。
在21世纪初,随着Obninsk发生器的引入,68Ga开始普及[10]。约在同一时间,神经内分泌肿瘤显像剂68Ga-DOTA-TOC/TATE的第1次临床试验结果也随之发表[12,13]。这些因素共同推进了68Ga化学研究的迅速发展,从相关的出版物数量上即可看出(图2)。目前,已有多种针对临床相关靶点的68Ga标记放射性药物发表并获得临床应用。例如68Ga标记放射性药物用于显像多种受体,包括整合素受体、胃泌素释放肽受体、胰高血糖素样肽1受体、血管内皮生长因子受体、Ⅳ型趋化因子受体和PSMA受体[2,14]。其中,靶向PSMA受体的放射性探针(如68Ga-HBED-cc-PSMA)在68Ga PET显像领域中最具影响力。68Ga的主要来源是68Ge/68Ga发生器,其中68Ga由其长半衰期母体核素68Ge(半衰期,270.9 d)连续衰变产生。最近通过68Zn(p,n)68Ga反应使用回旋加速器生产更高活度68Ga已被报道,并引起广泛关注[15]。尽管在连续使用1年后,发生器的68Ga产量会降到初始的一半左右,但仍具有引人注目的优点。例如,发生器可以在1 d内多次淋洗获得68Ga核素,因为2次淋洗间仅需间隔大约3个68Ga的半衰期,方便临床应用。目前最大容量的商用发生器1次淋洗可获得1.8 GBq的68Ga,每天淋洗3次,每次制备3人份的药物。但与回旋加速器生产的18F相比,产量仍有限[9]。正如最近发表的综述中讨论的那样,这种局限性(以及其他一些因素)使作者得出结论,仅在某些情况下,基于68Ga的放射性药物比18F放射性药物更经济。尽管如此,相对于拥有回旋加速器的大型医院来讲,通过发生器生产68Ga使得医院在生产常规放射性药物的同时,也可生产一些应用不频繁的PET放射性药物。另一方面,68Ga为小型医院提供了非常好的机会,可以不依赖于回旋加速器就能为患者提供少量但种类不同的PET示踪剂。
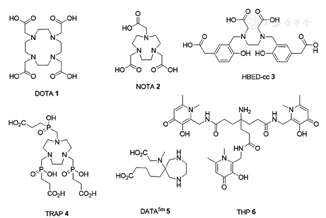
从化学角度来看,68Ga3+是1种典型的易与含有N和O的配体形成复合物的放射性金属核素。因此,可以通过常用的螯合剂,例如DOTA、1,4,7-三氮杂环壬烷-1,4,7-三乙酸(1,4,7-triazacyclononane-1,4,7-triacetic acid, NOTA)和HBED-cc对68Ga进行快速定量的放射性标记(图3)。最近有研究表明,除了这些经典的螯合剂外,应用TRAP、DATA和THP等螯合剂可在室温、温和pH值条件以及较低的底物浓度情况下进行68Ga标记,这些特性都有利于未来68Ga药盒的制备[16]。

最后,放射性核素发射的正电子能量对于PET显像质量也存在着决定性作用。相对于18F(0.634 MeV)来讲,68Ga最大正电子能量相对较高(1.9 MeV)[17]。因此,68Ga的分体积效应强,这会降低基于标准摄取值定量的准确性,尤其是对于小病变来说。但是,实际上表观图像质量的差异不太明显,可能是2种PET放射性核素在临床PET仪上观察到的差异可以忽略的原因。
最近89Zr PET研究流行的背后驱动原因是由于89Zr自身的物理性质最为适合基于抗体的免疫PET显像。89Zr的半衰期与大多数抗体的生物代谢周期匹配良好,因此适用于对抗体或抗体偶联物进行体内药代动力学的研究(表1)。
89Zr用于抗体标记的免疫PET显像早在1997年便被证实可行[18]。在这篇开创性的研究报告中,作者报道了1项使用89Zr标记靶向EpCam抗体323/A3的研究,并成功用于荷瘤裸鼠显像。2006年,第1篇关于89Zr免疫PET临床应用的文章被发表[19],其报道了89Zr标记的抗体U36可对鳞状细胞癌患者体内肿瘤病灶进行清晰显像。之后,使用89Zr免疫PET的靶向肿瘤显像取得了令人瞩目的发展。
到目前为止,临床应用于89Zr放射性标记的唯一螯合剂为去铁胺(hexadentate siderophore desferrioxamine, DFO),其通过3-异羟肟酸酯基团与89Zr4+进行配位(图4)。最近发表的一些综述涵盖了目前用于免疫PET显像的89Zr-DFO标记抗体的发展历史,也突显了人们对89Zr免疫PET的兴趣日益增加[20,21]。然而,诸多临床前研究结果表明,89Zr-DFO复合物的体内稳定性较差。小鼠生物分布实验结果显示,89Zr-DFO复合物注射入体内一段时间后存在89Zr脱落现象,表现为明显的放射性骨摄取[22]。89Zr-DFO复合物在体内不稳定的缺点限制了其临床大规模应用,大量脱落的89Zr会导致其浓聚于辐射敏感的骨组织中,影响了显像图像的信噪比,也引发了人们对其在临床应用中的担忧。
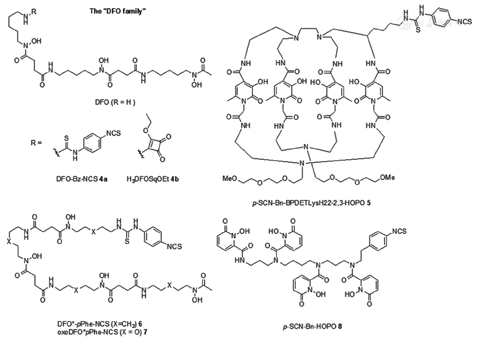

在过去的几年中,几种备选的可用于89Zr标记的BFCA被报道。这些报道共同目标是提高89Zr标记复合物的体内稳定性。新一代的BFCA化学结构独特,具有8个配位原子以满足89Zr的八配位特性(图4)。由于DFO的成功,包含有异羟肟酸酯结合基团的BFCA成为流行的设计选择,并基于此设计理念开发出了DFO*[23]。DFO*是在DFO骨架结构上进一步扩展,引入额外的异羟肟酸基团而形成的新型八齿螯合剂。后续研究报道证明,新一代89Zr螯合剂DFO*-pPhe-NCS 6(图4,X=CH2)能与曲妥珠单克隆抗体(trastuzumab)结合,并具有与商品化的DFO-pBz-NCS 4a相同的标记效率[24]。89Zr-DFO*-trastuzumab的体内外性质明显优于89Zr-DFO-trastuzumab。荷瘤裸鼠注射标记物后144 h,肿瘤对2种药物摄取水平相似,但89Zr-DFO*-trastuzumab在骨骼、皮肤、肝、脾及肠道的摄取明显更少,表明其体内代谢优势明显。目前,对于DFO*系统的研究主要集中于增加其水溶性,进而促进其生物联接化学的研究(如oxoDFO* 7;图4,X=O)[25]。
也有研究报道,通过方酰胺酯4b对DFO进行修饰,进而得到性质优越的89Zr螯合剂[26]。小鼠实验显示,对于人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)阳性肿瘤显像来说,89Zr-4b-trastuzumab比89Zr-DFO-trastuzumab具有更高的肿瘤/骨比值,但其在脾的放射性摄取很高。由多个HOPO单元组成的89Zr螯合剂的稳定性明显高于基于异羟肟酸酯的DFO系统[27],因此开发了以HOPO-pBn-NCS 8为螯合剂的89Zr-trastuzumab放射性探针[28],与DFO作为螯合剂相比,虽然HOPO-pBn-NCS 8的引入降低了骨骼的放射性摄取,但肿瘤的摄取也随之减少。同时,基于HOPO基团的双功能大分子螯合剂p-SCN-Bn-BPDETLysH22-2,3-HOPO 5研究数据表明[29],与89Zr-DFO-trastuzumab相比,89Zr-5-trastuzumab在小鼠体内具有相近的肿瘤摄取,但肝和骨骼的摄取增高。
目前关于新型89Zr螯合剂的研究集中在与DFO进行各方面性质的比较。下一步则需要在已开发的众多八齿螯合剂中进行相互比较,并选择1个性质最优的螯合剂转化至临床。
大部分关于89Zr的研究都集中于免疫PET方面,也有一些是关于89Zr标记肽类[如精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp, RGD)、exendin-4][30,31]、蛋白质(如白蛋白、转铁蛋白)[32,33]和纳米颗粒[34,35]。近来,应用89Zr对不同类型细胞进行标记也引起了人们的关注,例如89Zr-oxine或89Zr-DFO-p-Bn-NCS可以用于离体细胞的放射性标记[36,37]。
64Cu发射的2种射线中,β+(17.9%)可用于PET显像,β-(39.0%)可用于放射靶向治疗。64Cu低能β+衰变以及相对较长半衰期(12.7 h)的特点使之适用于免疫PET研究,受到核药学以及核医学界的广泛关注。目前已有很多关于64Cu应用的报道,均是将64CuCl2通过相应的螯合剂对小分子、多肽、抗体甚至纳米颗粒进行标记[38]。尽管目前还没有基于64Cu的标记化合物成为临床常规用药,但相关研究一直在深入进行中。
不同于其他放射性药物使用的核素(如68Ga3+或90Y3+),Cu(Ⅱ)在生理条件下并非氧化还原惰性。当其暴露于还原条件下(如肿瘤的低氧环境)时,Cu(Ⅱ)会被还原为Cu(Ⅰ),并表现出不同的配位特性[38,39]。由于氧化数变化的原因,导致其与DOTA(图3)或1,4,8,11-取代四氮杂环十四烷-1,4,8,11-四乙酸 (1,4,8,11-tetraazacyclotetradecane-1,4,8,11-tetraacetic acid, TETA;图5)形成的配合物变得不稳定,导致肝脏等器官出现非特异性放射性浓聚。为了开发更稳定的64Cu螯合剂,关于新型螯合剂diamSar 11或跨桥大环结构的CB-TE2A 10(图5)的研究陆续被报道。例如与64Cu-DOTATATE相比,64Cu-CB-TE2A-Y3-TATE具有更好的生物学性质。同样,应用diamSar 11或者CB-TE2A 10作为螯合剂标记的RGDyK与对应DOTA和TETA偶联的前体相比,具有更好的肿瘤靶向显像能力及在肝脏和血液中的清除能力[38]。
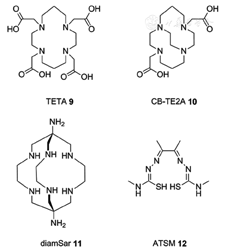

64Cu标记的二乙酰基-双(N(4)-甲基硫代氨基甲酸二甲酯[diacetyl-bis(N(4)-methylthiosemicarbazone, ATSM 12;图5]是目前研究用于乏氧显像的一类放射性药物。在发生乏氧的细胞中,Cu2+被还原为Cu+后,导致铜离子从螯合剂中释放并滞留在细胞内。乏氧的发生是导致肿瘤耐药、侵袭以及发生转移的重要原因,同样也是反映放射治疗敏感性的重要指标[40]。虽然目前64Cu-ATSM对乏氧显像的研究仍存争议,但目前相应的临床试验仍在进行中(ID:NCT00794339)[41]。
尽管许多文献强调64Cu(β+,β-)的衰变特性使其可以成为一种诊疗一体化核素,但据笔者所知,目前还没有关于64Cu标记的放射性药物用于治疗的研究报道。唯一例外的1项是将64CuCl2用于2例宫颈癌患者治疗的初步研究[42]。
除了68Ga、89Zr和64Cu外,还需提及其他几种PET放射性金属核素。82Rb可以通过发生器生产,在临床上以82RbCl的形式作为钾离子(K+)的模拟物用于心肌灌注显像[43]。82Rb过短的半衰期(1.3 min)使其应用受限,但其用于心肌显像是有效的,因为其PET分辨率远高于SPECT,显像效果也优于SPECT显像剂99Tcm-甲氧基异丁基异腈(methoxyisobutylisonitrile, MIBI)[43]。
86Y(β+)/90Y(β-)是1对诊疗一体化概念核素,其开发的主要原则可参见最近发表的1篇综述[44]。
44Sc是最近受到关注的另1种PET放射性金属核素,其可通过44Ti/44Sc发生器或回旋加速器生产获得(表1)[45,46]。44Sc与68Ga有相似的衰变特性,但前者具有更长的物理半衰期(3.97 h),这使其成为1种更适合临床应用的PET金属核素。同时有研究表明,44Sc-DOTATOC制备简单易行,且其对于神经内分泌肿瘤的显像质量可与68Ga-DOTA-TOC相媲美。
当进行包括PET显像在内的多模态显像研究时,一些不太常见的金属核素也显示出潜力。例如顺磁性锰(natMn2+)被认为是目前基于钆的MRI造影剂(natGd3+)的潜在替代品。有研究对natMn和PET放射性金属核素52gMn用于PET/MR成像进行了观察。特别是螯合剂反式1,2-环己烷二胺四乙酸(trans-1,2-cyclohexanediaminetetraacetic acid, CDTA)的引入为Mn配合物的在稳定性和弛豫性之间提供了良好的平衡点[47]。
最近报道的PET金属核素的其他例子还有152Tb和43Sc[48,49],后者因为与44Sc具有相似的半衰期,且发射的γ射线少而β+与γ能量又相对较低,尤为引人瞩目。
本文所讨论的PET放射性金属核素有其各自的优缺点,因为理想的放射性核素并不存在。在选择PET金属核素前,需结合应用目的多方面考虑。例如,所选的核素是否容易制得,其物理半衰期是否与需标记的靶分子生物半衰期匹配,与核素相对应的BFCA是否可通过商业途径购买获得?若想采取诊疗一体化手段,是否有相应的治疗性核素与之匹配?所选放射性金属的临床使用需考虑哪些监管[例如药物生产质量管理规范(good manufacturing practices, GMP)规范等]等等。
由于符合GMP规范68Ge/68Ga发生器可商业化供应,68Ga已快速成为临床上标准的PET放射性金属核素。其他一些新兴的但非标准的PET金属核素(如64Cu和89Zr)也已被证实在核医学领域具有很好的应用潜力。综上,PET放射性金属核素在放射性药物和核医学领域方面的研究将不断深入,并在未来更进一步。



























