
目前已有多种影像学检查可用于肌肉骨骼感染的诊断。X光片作为常规检查,即便有时不能提供诊断性信息,但可提供感兴趣区的解剖概况,利于后续影像学方法的选择和诊断。MRI的灵敏度很高,可提供详细的解剖细节。骨显像可不受基础病变的影响,准确诊断骨髓炎。67Ga主要用于脊柱骨髓炎的诊断。体外标记白细胞显像作为一种放射性核素检查方法,可用于糖尿病足骨髓炎和人工关节感染等复杂性骨髓炎的诊断,但不能用于诊断脊柱骨髓炎。抗粒细胞抗体和抗体片段具有一定的局限性,且不能广泛供应。111In-生物素可用于脊柱骨髓炎的诊断。放射性标记抗菌肽泛素合成片段是一种有前景的特异性感染显像剂。18F-脱氧葡萄糖(FDG)可用于脊柱骨髓炎的诊断,但其在糖尿病足骨髓炎和人工关节感染诊断方面的价值尚不明确。初步研究表明,68Ga或可用于肌肉骨骼感染的诊断。124I-fialuridine最初被认为可用作特异性感染显像剂,但随后的研究结果令人失望。PET/CT和SPECT/CT显像融合了解剖成像和功能显像,彻底改变了诊断影像学。这2种融合显像系统可提高诊断的准确性,并影响患者治疗方案的选择,从而重新定义了诊断学组在疑似或确诊感染和炎性反应患者中的价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性骨髓炎由细菌血行感染或直接感染引起。局部危险因素包括开放性骨折、近期手术史和骨科金属植入物。全身危险因素包括糖尿病、免疫抑制及药物滥用[1]。急性骨髓炎的诊断有时并不明确,影像学检查可辅助诊断。尽管目前已有多种影像学检查供选择,但没有任何一种检查可适用于所有情况。本文回顾总结了各种放射性药物在肌肉骨骼感染疑似患者中的应用。
1.X线摄影。X线摄影检查被用作对骨髓炎疑似患者的初步检查。早期表现包括软组织肿胀和邻近脂肪间隙模糊。骨小梁溶解、皮质破坏和骨膜反应在1周后或许仍不出现(补充图1;补充内容请访问http://jnmt.snmjournals.org)。尽管X线摄影的灵敏度和特异性分别只有50%~75%和75%~83%,但可提供感兴趣区的解剖概况,利于后续影像学方法的选择和诊断[2]。
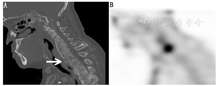

2.MRI。MRI最早可在感染发病2 d内发现异常,影像学表现为T1加权成像(weighted imaging, WI)低信号,脂肪抑制T2WI高信号,这是由骨髓炎性水肿所致(补充图2)。骨膜反应和邻近软组织水肿出现较晚。静脉注射对比剂可评估脓肿程度,有助于鉴别滑膜液与滑膜增厚。该检查阴性预测值很高,可除外骨髓炎;但阳性预测值较低,在鉴别骨髓炎和其他可引起骨髓信号异常的非感染性病变方面的能力较低[2]。

3.CT和超声检查。CT和超声检查不常用于骨髓炎的诊断。急性骨髓炎在CT上表现为髓腔内局灶性密度增高,伴有脂肪间隙模糊、骨膜反应和骨皮质缺失[2]。
超声检查主要用于检查部位内有骨科植入物者和有MRI检查禁忌证者。超声检查可通过对骨膜下脓肿的探查来诊断急性骨髓炎。在骨膜下脓肿形成前,超声检查可能会漏诊,且骨骼周围的软组织水肿有时也会被误诊为骨膜下脓肿[2]。
1.骨显像。骨显像的显像剂是99Tcm标记的双膦酸盐,其摄取量取决于血流量和新骨形成的速度。三相骨显像常被用于骨髓炎的诊断,包括血流相、软组织相和注射后2~4 h采集的骨骼相。局部高灌注、局部充血和局部骨显像剂摄取增高是骨髓炎的典型表现。该检查可除外正常骨骼,兼具灵敏度和特异性。但伴有如骨折、骨科植入物和邻近软组织感染等病变时,其特异性会降低[3]。
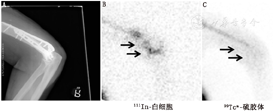
2.67Ga显像。感染病灶通过多种方式摄取67Ga。67Ga在注射后约有90%存在于血浆中,且几乎所有血浆中的67Ga最初都与转铁蛋白结合。血流量和血管壁通透性的增加会促使67Ga在感染病灶内的积聚。乳铁蛋白存在于大多数感染中,67Ga可与之结合。已有研究报道称,细菌可直接摄取67Ga。铁载体是细菌生成的一种螯合物,可与67Ga结合。铁载体-镓复合体可被转运到细菌内,并被巨噬细胞吞噬。部分67Ga可由循环血液中的白细胞进行转运。67Ga显像通常在注射后18~72 h进行。目前,67Ga显像主要用于脊柱骨髓炎的诊断(图1)[3]。
3.标记白细胞显像。(1)体外标记白细胞。体外标记白细胞最常用的是111In(111In-oxyquinoline)和99Tcm(99Tcm-exametazime)。感染病灶对标记白细胞的摄取取决于白细胞完好的趋化性、标记白细胞的数量和类型以及对特定刺激的细胞应答。为了获得诊断水平的图像,循环血液中的白细胞计数应不少于2 000个/μl。大多数标记的白细胞是中性粒细胞,因此标记白细胞显像对于中性粒细胞相关的感染最为灵敏。标记白细胞显像时,注射后不久肺内即会出现放射性浓聚,这是由于标记过程中的细胞活化会阻碍标记白细胞通过肺血管系统[4]。
111In放射性标记白细胞的优点包括:标记稳定性好,注射后24 h放射性分布局限于肝、脾和骨髓,可进行延迟显像。与骨髓显像联合显像时,骨髓显像可在111In标记白细胞显像之前、同时或之后进行。该显像的缺点包括分辨率有限及注射后18~30 h方可进行显像[4]。
99Tcm标记白细胞的生物分布多变,因为部分Tc会从白细胞中洗脱出来,并通过肾脏和肝胆系统排出体外。因此,显像过程中除了可看到网状内皮系统显影,通常还可看到尿路、肠道和胆囊显影。99Tcm标记白细胞显像的优点包括图像分辨率较高和注射后不久即可进行显像。缺点包括标记的不稳定性和99Tcm半衰期短导致无法进行延迟显像。99Tcm标记白细胞显像与骨髓显像间需间隔2~3 d[4]。
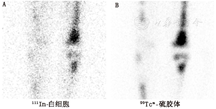
白细胞在感染病灶和骨髓中均有浓聚,因此标记白细胞显像很难对两者进行区分。99Tcm-硫胶体骨髓显像可用于两者的鉴别。这2种放射性药物都会在骨髓中浓聚,但只有标记的白细胞会在感染病灶中浓聚。当标记白细胞图像上的放射性浓聚区在骨髓显像中表现为放射性缺损时,可诊断为骨髓炎(图2,图3)。标记白细胞/骨髓显像的准确性约为90%[5]。标记白细胞在注射后3~4 h和20~24 h的双时相显像已被推荐作为标记白细胞/骨髓显像的替代方法[6]。

(2)体内标记白细胞。Besilesomab是一种与粒细胞及粒细胞前体细胞膜上的交叉反应抗原-95结合的鼠源性单克隆免疫球蛋白(immunoglobulins, Ig)G1抗体。约10%的99Tcm-besilesomab与中性粒细胞结合;20%以未结合形式在血液中循环,并通过非特异性机制在感染病灶中浓聚。99Tcm-besilesomab显像的一大缺点是重复注射显像剂时,患者出现人抗鼠抗体反应的发生率超过30%[7]。
Sulesomab是一种与IgG1类小鼠单克隆抗体结合的抗原片段(Fab9),相对分子质量为50 ×103,可与白细胞上的交叉反应抗原-90结合。99Tcm-sulesomab注射后,3%~6%与循环血液中的中性粒细胞结合,24 h后约35%积聚在骨髓中。早期研究数据表明,感染病灶对99Tcm-sulesomab的摄取包括99Tcm-sulesomab与血液循环中的中性粒细胞结合及与感染部位的白细胞结合。但后续研究表明,99Tcm-sulesomab在感染病灶中的浓聚是非特异性的[7]。
白细胞介素8是一种可与白细胞上的α-趋化因子受体1和2结合的趋化因子,可在感染病灶中迅速浓聚。少数研究表明,该显像剂可对肌肉骨骼感染进行准确诊断[7]。
4.111In-生物素。生物素又称维生素B7,在葡萄糖代谢中起重要作用,同时也是细菌的生长因子[8]。111In-生物素单独或与链霉亲和素结合已被用于感染显像。其优点是当日显像,很少或几乎不伴有骨髓摄取。此外,经抗生素治疗也不会影响其灵敏度[7]。
5.放射性标记抗生素。放射性标记抗生素曾是研发感染特异性显像剂的重要尝试。研究最广泛的放射性标记抗生素是99Tcm-环丙沙星。早期研究表明,其具有高度的灵敏度和特异性。但后续研究对其特异性提出了严重质疑,且目前研究者对于放射性标记抗生素的研究热情已消退[7]。
6.放射性标记抗菌肽。抗菌肽是大多数生物先天免疫防御的一部分,其相对分子质量小,带正电荷,且具有两亲性(亲水性和疏水性)。其可以恒定表达,也可在与微生物接触时诱导表达;可由循环血液中的白细胞进行输送。抗菌肽可杀死微生物,但对哺乳动物的细胞无害,其在诊断和治疗方面的价值还在研究中[7,9,10]。泛素合成片段存在于鼠巨噬细胞中,是目前研究最广泛的抗菌肽[7,10,11]。99Tcm-泛素29-41在对肌肉骨骼感染的诊断方面兼具灵敏度和特异性,并有望用于疗效监测[7]。68Ga标记的泛素29-41可成功探测到细菌感染病灶[11]。
7.18F-脱氧葡萄糖(fluorodeoxyglucose, FDG)。18F-FDG通过葡萄糖转运蛋白被转运到细胞内,被己糖激酶磷酸化为18F-2′-18F-FDG-6-PO4后不能进入下一步代谢。白细胞对18F-FDG的摄取取决于细胞代谢率和葡萄糖转运体数量。炎性反应细胞被激活后,葡萄糖转运蛋白的数量和表达增加,且转运蛋白对18F-FDG的亲和力增强[3]。18F-FDG PET是一种分辨率相对较高的影像学检查,可精确定位放射性药物浓聚区域。小分子18F-FDG可迅速进入灌注不良区。18F-FDG通常在注射后约1 h进行显像。18F-FDG的摄取在创伤或手术后3~4个月内多可恢复正常;退行性骨骼改变仅表现为18F-FDG摄取轻度增加[3]。
8.18F-FDG标记白细胞。为了研发更具特异性的PET显像剂,研究者们尝试在体外用18F-FDG标记白细胞。其缺点包括:18F的半衰期110 min,难以满足非即时标记和延迟显像,标记效率较111In-oxine低且不稳定,另外18F-FDG会从白细胞中快速洗脱[3]。
9.68Ga-柠檬酸盐。尽管68Ga-柠檬酸盐显像效果优于67Ga,但两者摄取机制是相同的。67Ga显像的缺点是炎性反应、创伤和肿瘤对其均有摄取,68Ga-柠檬酸盐显像在这一方面同样存在不足。另一个缺点是半衰期很短(68 min)。68Ga-柠檬酸与多肽形成复合物后或可克服以上不足[12]。
10.124I-fialuridine。124I-fialuridine是细菌胸苷激酶的一种特异性底物。早期研究发现,124I-fialuridine在全部8例肌肉骨骼感染患者的感染灶中浓聚,而对照组未见异常摄取[13]。但随后的研究结果令人失望[14,15]。
没有一种显像剂适用于所有的骨骼疾病,因此需要根据临床表现选择最合适的显像方法。在成人患者中,肌肉骨骼感染可分为3类:脊柱感染、糖尿病足和人工关节感染。
1.脊柱骨髓炎。脊柱骨髓炎属于血源性感染,可直接由外部感染或邻近组织感染扩散所致,且在感染后会向相邻的软组织扩散。血源性化脓性脊柱骨髓炎最常累及腰椎。结核感染更常见于胸椎,且多累及2个以上椎体[16]。
放射性核素显像可辅助MRI用于脊柱骨髓炎的诊断。虽然骨显像已被用于脊柱骨髓炎的筛查,但常出现假阴性。骨显像在探查脊柱感染伴随的软组织感染方面灵敏度低。在感染痊愈后,骨显像在一段时间内可能仍为阳性。67Ga显像的特异性比骨显像高,还可能比骨显像更快发现感染的骨病灶及伴随的软组织感染[3,17,18]。67Ga SPECT/CT显像可降低假阳性率和假阴性率,并能探查到软组织感染[3]。
67Ga显像的缺点在于67Ga的物理特性和生物分布会干扰对图像的判读。尽管其在注射后不久即可呈阳性,但通常在注射后18~72 h才可进行显像。67Ga在炎性反应、肿瘤和外伤病灶中同样会有浓聚,且上述病灶有时与脊柱骨髓炎同时存在,鉴别较难。
标记白细胞显像在脊柱骨髓炎的诊断方面没有应用价值。约50%的患者表现为局灶性非特异性放射性分布减低[4]。
111In-生物素可准确诊断脊柱骨髓炎。SPECT/CT显像能准确区分骨和软组织感染,并可用于指导治疗[19,20]。
18F-FDG显像优于骨显像、67Ga显像、抗粒细胞抗体显像和MRI[21,22,23,24,25,26,27,28,29,30]。Gratz等[22]报道18F-FDG PET对轻度脊柱炎/椎间盘炎的诊断优于MRI。Stumpe等[25]报道18F-FDG PET对腰椎椎体终板异常诊断的灵敏度和特异性均为100%,而MRI的灵敏度为50%,特异性为96%。一项研究表明,18F-FDG PET/CT对常规显像诊断不清者的诊断的灵敏度、特异性和准确性分别为81.8%、100%和89.5%,而MRI的灵敏度、特异性和准确性分别为75%、71.4%和74.1%[26]。Fuster等[27]对比了18F-FDG PET/CT和MRI对脊柱骨髓炎的诊断价值。18F-FDG PET/CT诊断的灵敏度和特异性分别为83%和88%,而MRI诊断的灵敏度和特异性分别为94%和38%。对于布鲁氏菌感染的脊柱骨髓炎患者,18F-FDG PET/CT可识别出MRI上显示的所有感染病灶,并在3例患者中发现了更多脊柱病变、受累的椎旁软组织和硬膜外肿块。额外的信息可改变患者的治疗方案[29]。Nakahara等[30]报道18F-FDG PET/CT在定位感染病灶和指导微创手术方面优于MRI。
18F-FDG在脊柱骨髓炎的疗效监测方面具有一定价值。Riccio等[31]报道称骨和软组织的18F-FDG摄取持续增高者疗效较差。治疗后18F-FDG摄取局限于病灶的边缘者并不代表感染。对于布鲁氏菌感染的脊柱骨髓炎患者,18F-FDG摄取显著降低与治疗有效相关[29]。Skanjeti等[28]报道称18F-FDG PET/CT在疗效方面评估比MRI(90%与61.5%)更为准确。
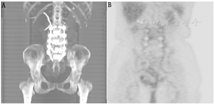
18F-FDG可能不太适用于以下情况。18F-FDG可能难以鉴别肿瘤与感染或肿瘤伴发感染。退行性脊柱疾病偶尔会出现局灶性18F-FDG的高摄取[3]。脊柱植入物周围的异物反应也可能导致18F-FDG摄取增加(图4)[32]。尽管已发表的研究均支持18F-FDG显像用于脊柱骨髓炎的诊断,但尚需更多研究论证其是否可作为脊柱骨髓炎的首选检查。

关于68Ga-柠檬酸盐用于诊断脊柱骨髓炎的研究较少。Nanni等[33]报道称68Ga-柠檬酸盐显像的灵敏度为100%,特异性为76%。假阳性结果与肿瘤病变有关。
2.糖尿病足骨髓炎。糖尿病患者在出现明显的足部感染时全身可无反应,且骨髓炎的诊断易被临床忽视[34]。标记白细胞显像是放射性核素诊断糖尿病足骨髓炎的"金标准"。111In标记白细胞平面显像的灵敏度和特异性分别为72%~100%和67%~100%。99Tcm标记白细胞平面显像的灵敏度和特异性分别为86%~93%和80%~98%[3]。放射性标记的抗粒细胞抗体和抗体片段的诊断价值相似[35,36,37]。
SPECT/CT在疑似足骨髓炎患者中具有一定的临床价值[38,39,40,41,42]。Heiba等[39]发现联合111In标记白细胞/99Tcm-甲基双膦酸盐SPECT/CT显像和骨髓显像诊断的准确性明显高于平面显像和单核素SPECT/CT显像,且有助于标记白细胞精确定位病灶和提高阅片者的信心。另一项研究表明,双核素SPECT/CT显像在感染的诊断和定位方面比传统显像方法更准确,有助于指导患者的治疗,并与较短的住院时间相关[40]。
Filippi等[41]报道称99Tcm标记的白细胞SPECT/CT显像改变了一半以上患者的诊断,确诊或排除了骨髓炎,并准确划定了感染范围(图5)。Erdman等[42]制订了99Tcm标记白细胞SPECT/CT显像的严重程度指数,其与治疗效果成反比,且根据严重程度指数将骨髓炎患者分为阳性或阴性组进行研究后,预后评估更为准确。
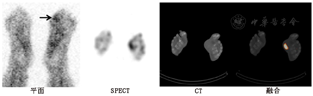

Vouillarmet等[43]用99Tcm标记白细胞SPECT/CT显像监测糖尿病足骨髓炎患者的疗效。22例患者显像呈阴性,7例患者呈阳性,阳性患者中有5例出现复发,其监测骨髓炎复发的灵敏度、特异性、阳性预测值和阴性预测值分别为100%、91.5%、71.5%和100%。Lazaga等[44]报道称99Tcm标记白细胞SPECT/CT显像评估疗效的灵敏度为90%,特异性为56%。
目前,绝大多数研究都在关注标记白细胞显像,Aslangul等[45]报道称67Ga SPECT/CT诊断糖尿病足骨髓炎的灵敏度为88%,特异性为93.6%。
部分研究评估了18F-FDG在糖尿病足感染中的应用价值[46,47,48,49,50,51,52,53]。Basu等[46]报道称18F-FDG PET显像在骨髓炎和软组织感染与神经性关节病的鉴别诊断方面的准确性为94%。Nawaz等[47]报道称18F-FDG PET诊断足骨髓炎的准确性为81%。Kagna等[49]报道称18F-FDG PET/CT诊断足骨髓炎的准确性为96%。
Yang等[50]报道称18F-FDG PET诊断足骨髓炎的准确性为93.8%。18F-FDG PET对血糖水平高于1.5 g/L和低于1.5 g/L的患者的诊断灵敏度几近相同,分别为88.9%和88.3%。研究者据此推测血糖水平轻到中度升高不会降低18F-FDG PET诊断的灵敏度。
Shagos等[51]报道称18F-FDG PET诊断骨髓炎的特异性比骨显像高,而骨显像在诊断神经性关节病方面的灵敏度高于18F-FDG PET。Schwegler等[52]研究发现,18F-FDG PET在7例骨髓炎患者中仅检出了2例(灵敏度为29%)。研究者推测低灵敏度可能与研究人群的炎性反应降低或胰岛素抵抗导致的骨骼对18F-FDG的摄取减少有关。运动伪影和空间分辨率低也可能是原因之一。
Familiari等[53]将18F-FDG PET/CT与99Tcm标记白细胞平面显像进行比较,18F-FDG PET/CT诊断的准确性为54%,融合CT图像后准确性提高到62%,99Tcm标记白细胞平面显像的准确性为92%。
18F-FDG在糖尿病足骨髓炎诊断方面的作用尚不明确。现有研究均存在一定的局限性,包括方法学不同、研究群体不同、与MRI的相关性不一致、缺乏统一的诊断"金标准",以及少有研究与标记白细胞显像进行对比[54,55]。Treglia等[55]的荟萃分析显示,18F-FDG诊断的灵敏度和特异性分别为74%和91%,研究者认为后续非常有必要开展以骨活组织检查(简称活检)为"金标准"的大型多中心研究。
3.人工关节感染。无菌性松动是人工关节失败最常见的原因,通常是由人体对1个或多个假体部件产生免疫反应造成的。免疫反应可伴随有大量白细胞浸润的强烈炎性反应。无菌性松动往往需要住院行关节置换手术进行治疗[56]。
首次植入手术的感染发生率为1%~2%,而再次植入手术时则升至5%。约有1/3的感染在术后3个月内(早期)发生,另有1/3在术后1年内(延迟)发生,其余则超过1年(晚期)才发生[56]。感染伴随的炎性反应与无菌性松动中的炎性反应相似,不同之处在于中性粒细胞在无菌性松动中通常不存在,而在感染中总是大量存在。治疗方法依次为关节切除成形术、抗生素治疗以及最后的关节修补成形术[56]。
无菌性松动和感染的鉴别非常困难,但二者的治疗方案截然不同,因此临床上需对二者进行准确区分。感染有时并无明显征象。实验室检查结果异常可提示感染,但不能确诊感染。关节腔穿刺活检与微生物培养具有特异性,但灵敏度不足[56]。X线摄影检查缺乏特异性。金属伪影在一定程度上影响了横断面成像。
放射性核素显像在关节置换术后感染的评估方面具有重要地位。骨显像的准确性为50%~70%,三相骨显像并不能提高其准确性[56]。骨显像联合67Ga显像的准确性为60%~80%,与单独骨显像相比仅略有提高[56]。标记白细胞/骨髓显像是目前最理想的影像学检查,准确性约为90%。目前已发表的研究均证实其具有高特异性和高灵敏度[56]。
99Tcm-besilesomab诊断关节置换术后感染的灵敏度和特异性分别为67%~91%和57%~75%。加做骨显像和半定量分析可提高其准确性[56]。
99Tcm-sulesomab诊断关节置换术后感染的灵敏度和特异性分别为75%~93%和65%~86%。双时相显像、时间-放射活性曲线分析和加做骨髓显像可提高其准确性[56]。
此外,SPECT/CT显像在诊断人工关节感染方面的价值同样令人期待[57,58,59,60,61,62]。Tam等[57]报道称SPECT/CT骨显像的CT显像可发现SPECT图像中放射性浓聚区相应部位的形态学异常。关节肿胀、关节囊积液和肌肉水肿是诊断感染灵敏且特异的表现,这些均可通过CT显像发现。Al-Nabhani等[58]报道称,SPECT/CT骨显像可为80%以上膝关节置换术后疼痛的患者提供有用信息。Filippi和Schillaci[59]报道称99Tcm标记白细胞SPECT显像诊断的准确性为64%,而SPECT/CT显像可提高到100%。SPECT/CT可精确定位浓聚的标记白细胞,利于软组织感染与骨骼感染的鉴别。Kim等[60]报道,标记白细胞平面显像的灵敏度、特异性和准确性分别为82.0%、88.0%和84.8%。而SPECT/CT显像的灵敏度、特异性和准确性可提高至93.3%。SPECT/CT显像可精确定位感染病灶,并准确划定感染范围(图6)。
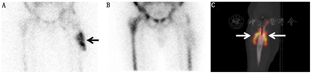

Graute等[62]报道,99Tcm-besilesomab平面显像的灵敏度、特异性和准确性分别为66%、60%和61%,而SPECT/CT显像的灵敏度、特异性和准确性分别提高至77%、89%和73%。
18F-FDG在诊断人工关节感染方面的价值尚未达成共识。部分研究认为,18F-FDG可用于人工关节感染的诊断。Zhuang等[63]报道,18F-FDG PET诊断髋关节和膝关节置换术后感染的准确性分别为89.5%和77.8%。准确诊断取决于显像剂摄取的部位而不是摄取量。Reinartz等[64]报道,18F-FDG PET诊断髋关节置换术后感染的准确性为95%。Basu等[65]报道,18F-FDG PET诊断髋关节置换术后感染的灵敏度和特异性分别为81.8%和93.1%,诊断膝关节置换术后感染的灵敏度和特异性分别为94.7%和88.2%。此外还有多项研究报道了相似的结果[66,67,68]。值得注意的是,部分研究者认为,股骨头和股骨颈周围的18F-FDG摄取并非感染的特异性表现,但也有研究者认为出现这种表现往往提示合并滑膜炎[56,69,70]。
目前也有多项研究认为,18F-FDG可能不适合用于人工关节感染的诊断[71,72,73,74,75,76,77]。Van Acker等[71]报道,18F-FDG PET诊断人工膝关节感染的灵敏度为100%,但特异性仅为73%。Stumpe等[73]报道,18F-FDG PET诊断人工髋关节感染的准确性仅为69%,且膝关节置换术后假体周围18F-FDG浓聚并非感染特异性表现[74]。Delank等[75]认为,18F-FDG PET对下肢关节置换术后感染的诊断没有特异性。另有研究表明,该检查对人工髋关节感染的诊断既不灵敏(64%),也不特异(67%)[76]。Love等[77]报道,18F-FDG对下肢人工关节感染诊断的准确性仅为71%。
关于18F-FDG PET显像、骨显像和标记白细胞显像的对比研究结果也未达成共识。部分研究表明,18F-FDG PET比骨显像更准确,但另有研究持相反意见[64,71,73]。Pill等[78]报道,18F-FDG PET诊断感染的灵敏度为95%,特异性为93%;亚组分析显示,标记白细胞/骨髓显像的灵敏度和特异性分别为50%和95.1%。Love等[77]发现,标记白细胞/骨髓显像比18F-FDG PET更为准确(95%与71%)。Basu等[65]对88例下肢关节置换术患者(59例髋关节,29例膝关节)的18F-FDG PET显像与标记白细胞/骨髓显像结果进行比较发现,尽管特异性相似,但18F-FDG PET诊断人工髋关节术后感染的灵敏度明显高于后者(76.9%与38.5%)。全部3例膝关节置换术后感染的患者在18F-FDG PET检查中均为阳性,而在标记白细胞/骨髓显像中仅1例呈阳性。
最近的一项荟萃分析表明,18F-FDG PET和PET/CT诊断下肢人工关节术后感染的综合灵敏度和特异性均为86%[79]。
特异性感染显像剂的研发将是对目前所有可用的放射性显像剂的重大变革。Aryana等[80]报道,99Tcm-泛素29-41诊断髋关节置换术后感染的准确性为100%。这一结果令人鼓舞,但尚须在更大范围内得到证实。
放射性核素显像将继续在肌肉骨骼感染疑似患者的诊断中发挥重要作用。骨显像和67Ga显像的地位随着时间的推移而逐渐下降,因为其已被更好的检查方法所取代,如标记白细胞显像及可用于诊断脊柱感染的18F-FDG显像。SPECT/CT和PET/CT融合显像不仅提高了诊断准确性,且有潜力用于疗效监测,从而重新定义了放射性核素显像在疑似或确诊肌肉骨骼感染患者治疗中的作用。尽管现有的特异性感染放射性药物(如放射性标记肽)会引起宿主反应,但其在感染的诊断和疗效监测方面均有一定的发展前景。


























