
神经核医学显像在近几十年中已被应用于原发性神经退行性疾病,如痴呆和帕金森综合征的临床和科研中。但是,其在对认知功能同样有远期影响的非神经退行性疾病的评估方面的应用相对较少。该文对近年来引起广泛关注的3种疾病,包括癌症和化疗相关认知功能障碍、创伤后应激障碍和创伤性脑损伤的临床和影像学表现进行综述,同时对目前应用神经影像学方法的研究进行了阐述,旨在更好地了解在这些情况下临床表现与脑结构和功能之间的关系。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前神经核医学显像在原发性神经退行性疾病认知功能影响方面的研究很多,但关于非神经退行性疾病的研究相对较少。本文主要对癌症和化疗相关认知障碍(俗称化疗性脑损伤;cancer- and chemotherapy-related cognitive impairment, CRCI)、创伤后应激障碍(posttraumatic stress disorder, PTSD)和创伤性脑损伤(traumatic brain injury, TBI)相关脑功能改变的文献进行了综述;对这3种情况的临床评估和治疗情况进行了较为详细的介绍。文中主要涉及脑PET以及部分SPECT显像研究,同时结合相关的功能MRI研究,力图从更多的角度来提高对上述疾病当前诊断和治疗的局限性认识。
在美国,大约有1 600万人有癌症病史[1],并且癌症患者在治疗结束后经常出现CRCI,其持续时间从治疗后的数月至数年不等[2,3]。CRCI所造成的负担随着癌症生存率的提高而增加,目前有高达35%的化疗患者正经历着长期的认知后遗症困扰[4]。认知研究中,关于CRCI记忆和执行功能改变的报道较多[5]。癌症治疗前患者可能会出现一些认知损伤,除了化疗外,手术、麻醉以及内分泌治疗或放疗干预等因素也可能引起。一般情况下,受其影响的化疗后患者会花费更多的精力来完成任务,特别是在面对多项任务且具有压力时。他们可能在以下方面出现问题,比如专注力、注意力、思维加工能力、工作记忆力、延迟记忆能力、找词能力、推理能力、解决问题能力以及会出现疲劳和情绪失调。CRCI与PTSD或TBI的典型神经心理特征比较见图1。
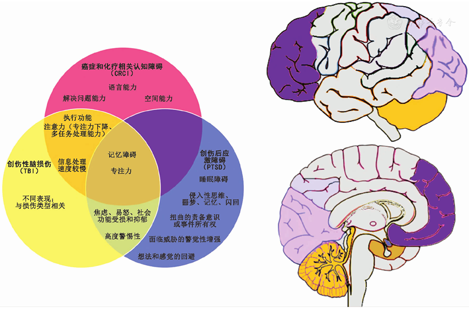

神经心理学评估包括口头和书面测试,备用表格用于重复测试。尽管患者主要的神经心理缺陷严重程度并不总与其总体表现密切相关,但与患者的记忆力和解决问题的能力直接相关[6]。并且有研究报道了化疗剂量依赖性不良反应:较大剂量的化疗暴露与较低的测试评分之间存在相关性[7]。
CRCI的治疗方案包括实施压力管理训练以及在家和工作地点建立住所以补偿损害并减轻痛苦。抗抑郁药、抗焦虑药和催眠药等药物可能有助于缓解CRCI。研究表明,使用莫达非尼[8]和哌醋甲酯[9]等兴奋剂可减轻化疗后的认知下降和疲劳程度。抗痴呆药(如多奈哌齐和美金刚)的疗效也在进一步验证中[10],前者通常对治疗记忆相关症状较为有效。此外,研究发现认知康复训练可以用来缓解特定的认知障碍[11],体育锻炼[12]和冥想练习[13]也可以用来减轻CRCI。
大多数CRCI患者的认知情况通常在1~2年内恢复正常。不同研究中CRCI的最终恢复率不同,部分原因是各研究所选择的认知评估方法的灵敏度和类型不同。CRCI可持续10~20年,关于CRCI患者短期和长期的脑功能改变情况已有相关影像学研究报道(表1)。近期发表的关于CRCI神经影像学综述主要集中在MRI研究上[14],尚无核医学相关综述,故本文将重点讨论核医学相关发现,特别是在该领域应用得较好的18F-FDG PET脑葡萄糖代谢研究。
癌症和化疗相关认知障碍(CRCI)研究中的神经影像学结果
癌症和化疗相关认知障碍(CRCI)研究中的神经影像学结果
| 研究 | 显像方法 | 使用的化疗药物 | 主要结果 |
|---|---|---|---|
| [15] | 15O-H2O PET和18F-FDG PET | 细胞毒性化疗a和他莫昔芬治疗a | 化疗患者短时记忆回忆任务中前额叶皮质和小脑的代谢增加;与短期记忆下降相关的前额叶皮质静息代谢降低;他莫昔芬+化疗治疗的乳腺癌患者与单纯化疗或未接受化疗者相比,基底节静息代谢降低 |
| [16] | 18F-FDG PET | 全身CHTa | 与非化疗组相比,早期高剂量化疗组前额叶皮质、白质、小脑、后内侧皮质和边缘系统代谢降低;早期高剂量化疗组较晚期低剂量化疗组右侧颞叶和前额叶皮质代谢降低;化疗周期数与这些区域的代谢率呈负相关;化疗结束后时间与这些区域的代谢率呈正相关 |
| [17] | 18F-FDG PET | CHTa | 化疗组前额叶皮质、小脑、内侧皮质和边缘系统代谢降低;这些区域的代谢与化疗周期数呈负相关,与化疗结束后时间呈正相关;化疗组额叶功能表现较差 |
| [18] | 18F-FDG PET | ABVD | 右角回(Brodmann 39区)代谢增加,双侧额叶皮质代谢减少 |
| [19] | 18F-FDG PET | 调强放疗 | 双侧基底节和枕叶代谢降低,即使在抗癌治疗结束后也是如此;双侧枕叶代谢相对恢复,双侧基底节进一步恶化;治疗期间和治疗结束时右前额叶皮质代谢增加 |
| [20] | 18F-FDG PET | CHT组:常规标准剂量化疗a;HL患者:羟基柔红霉素、ABVD;NHL患者:R-CHOP;NHL二线治疗:CNOP、VACOP和EPOCH;皮质类固醇和免疫治疗 | 化疗组前额叶-小脑系统代谢降低 |
| [21] | 18F-FDG PET | 卡铂/紫杉醇、卡铂/吉西他滨/贝伐单克隆抗体(简称单抗)、顺铂/依托泊苷、顺铂/吉西他滨、顺铂/酒石酸长春瑞滨、培美曲塞和卡铂/紫杉醇/贝伐单抗 | 全灰质的总代谢率平均降低22%;伴随着化疗脑室旁和皮质下白质、胼胝体和小脑白质的代谢降低;最严重的是双侧额叶皮质和嗅觉皮质的代谢降低 |
| [22] | 18F-FDG PET | 化疗、放疗和激素替代疗法 | 双侧内侧颞叶前部、左侧内侧颞叶后部和小脑区活动增加;芳香化酶抑制治疗后Broca区活性降低;右内侧颞叶代谢增加最大 |
| [23] | 18F-FDG PET | 化疗、放化疗和使用环磷酰胺、甲氨蝶呤和5-氟尿嘧啶或阿霉素的标准多药方案 | 与健康对照组相比,乳腺癌幸存者眶额部的代谢降低;他莫昔芬治疗患者右侧黑质受影响最重;接受治疗的患者左侧中央后回和胼胝体的代谢增加 |
注:a未详细说明。ABVD=阿霉素、博莱霉素、长春新碱、氮烯咪胺;CHT=内分泌治疗;CNOP=环磷酰胺、米托蒽醌、长春新碱和泼尼松;EPOCH=磷酸依托泊苷、泼尼松、硫酸长春新碱、环磷酰胺和阿霉素;HL=霍奇金淋巴瘤;NHL=非霍奇金淋巴瘤;R-CHOP=利妥昔单克隆抗体(简称单抗)加环磷酰胺、阿霉素、长春新碱和泼尼松(或泼尼松龙);VACOP=长春新碱、阿霉素、环磷酰胺、硫酸长春新碱和泼尼松
在第1项相关研究中,研究者对接受过化疗或未经化疗的乳腺癌患者和健康对照组进行了18F-FDG和15O-H2O脑PET显像,发现在最后1次化疗后的5~10年,先前接受过辅助治疗的患者前额叶皮质和小脑功能发生了变化;在短期言语记忆任务中,治疗组在额下回、额上回和小脑后部出现代谢增加;此外,化疗组左侧额下回的18F-FDG静息代谢活性每下降3%,对应的延迟回忆评分即下降1个标准差(P<0.000 5);同时接受内分泌治疗(他莫昔芬)的化疗患者在基底节区出现进一步代谢降低[15]。
随后的研究中,Baudino等[16,17]先后报道了血液系统肿瘤、实体恶性肿瘤及淋巴瘤患者脑代谢功能的改变情况。这些研究对局部脑区代谢变化与化疗疗程数和末次化疗后时间的相关性进行了探讨(表1)。2项研究均发现前额叶皮质、小脑和边缘系统区域的代谢活性与化疗周期数呈负相关,并且随着末次化疗后时间的延长而增加。
Chiaravalloti等[18]对霍奇金淋巴瘤患者进行了纵向显像研究:分别在诊断后1周、前2程化疗后约2周及4个为期1个月的化疗疗程后进行静态18F-FDG PET显像。该研究发现在前2程化疗后,患者背侧前扣带回、前额叶皮质和眶额叶皮质出现代谢减低。Hsieh等[19]对主要接受了放化疗的咽鳞状细胞癌患者进行了纵向显像研究,发现在不同治疗时间点双侧基底节等脑区出现了代谢异常(表1)。
D′Agata等[20]应用基于网络的分析方法对淋巴瘤患者的PET数据进行分析,发现在已定义的前额叶-小脑网络中代谢显著减少,这种方法还能够以80%的准确性区分不同的组。在1项进一步扩大癌症研究范围的纵向研究中,Horky等[21]对非小细胞肺癌患者在铂类化疗前和化疗后11 d进行显像,发现化疗后灰质区呈现广泛代谢减低,且以双侧额叶为著。
在另一纵向研究中,Hurria等[22]探究了芳香化酶抑制剂对老年乳腺癌患者的疗效,他们在治疗6个月前后将患者与健康对照进行对比,并对一部分患者进行了神经心理学评价和脑区代谢情况的计算。该研究发现,接受治疗后患者额下回后部近Broca区代谢减低,双侧颞叶和小脑代谢增高。Ponto等[23]对老年乳腺癌患者(包括部分接受他莫昔芬治疗的患者)与健康对照者进行了脑代谢研究,并发现了代谢增高和减低的脑区。最近,Shrot等[24]对患非霍奇金淋巴瘤的儿童进行了18F-FDG PET显像,同样发现了代谢增高和减低的脑区,但这可能与患儿经鞘内给药化疗等其他损伤机制有关。
从上述研究可见,前额叶皮质是CRCI患者脑区中受影响最严重的区域,其是大脑执行功能的关键部分。经神经影像学方法分析发现,边缘系统或颞叶以及小脑是第2个最常受影响的脑区,众所周知,这些区域与记忆力、语言能力和视觉空间功能密切相关[25]。
CRCI研究中涉及大量的化疗药物和治疗方案(表1),且由药物或剂量因素引起的神经心理障碍的具体风险和模式大多仍未阐明[26]。当比较患者服药剂量数[7]或剂量大小[27]的变化时,观察到化疗剂量-反应关系。并且一些药物可能会引起更严重的脑功能改变,如卡莫司汀、顺铂、阿糖胞苷、氟达拉滨、5-氟尿嘧啶和甲氨蝶呤等[28]。
引起脑代谢功能改变的机制是多方面的,包括某些化疗药物的直接毒性作用(可能由于其通过血脑屏障的能力较强)、氧化损伤、代谢紊乱以及免疫系统和炎性反应的激活(包括通过细胞因子的释放)。其中炎性反应与脑代谢直接相关。因为循环细胞因子水平的升高在癌症首次治疗后可持续数月至数年,且与神经毒性效应有关。在1项关于几种炎性反应标志物的系统检查中,化疗后出现的细胞因子水平可对即使1年后的脑代谢模式进行预测[29]。这些机制不一定是相互竞争的,也可以是协同工作的,可以是并行或先后进行的。例如,血浆超氧化物歧化酶升高介导的氧化应激可反过来触发能够穿透血脑屏障的神经毒性细胞因子的释放。此外,已知有多种化疗药物,包括蒽环类药物、抗代谢药物和烷化剂,都能产生类似影响,这有助于解释为什么化疗药物治疗癌症引起的认知功能障碍相关脑区和脑化学改变模式如此重叠。
PTSD被定义为一种持续的记忆障碍,其中患者"以非自愿形式重现创伤体验",令人痛苦的回忆是"生动的"和"持久的"[30]。美国全国共病再调查(National Comorbidity Survey Replication, NCS-R)数据显示,美国成年人的PTSD终生患病率约为7%[31]。世界心理健康(World Mental Health, WMH)调查报告显示,在全球范围内PTSD的患病率存在显著差异[32]。《精神障碍诊断与统计手册》(第5版)中,PTSD的标准要满足幸存者直接或间接经历创伤事件或受到创伤事件的威胁[33]。患者通过侵入性思维、噩梦、记忆、闪回以及其他创伤性回忆来重新体验事件;他们经常表现出对创伤事件的一种扭曲的责备意识、社交参与度降低、对可能面临威胁的警觉性增强、注意力不集中、烦恼、愤怒、失眠及高度警惕性;同时,症状必须持续至少1个月,并且严重影响个人行为功能,且与吸毒或其他疾病无关[33]。PTSD通常合并与其他疾病同时发生,如TBI[34]和抑郁症[35],这使得该疾病的诊治具有一定挑战性。
心理治疗是PTSD治疗的基础,通常还会进行不同类型的药物治疗,即便如此,仍需要开发新的治疗方法[36]。与去甲肾上腺素再摄取抑制剂一样,选择性5-羟色胺再摄取抑制剂在缓解症状和降低复发率方面有很好的疗效[37]。还有其他药物用于治疗PTSD和改善伴随症状,如α和β受体阻滞剂[38],以及最新药物疗法,如氯胺酮治疗[39]。认知行为疗法得到美国心理学会、美国国防部和退伍军人事务部的大力研究支持,被认为可以成功地减少PTSD患者的恐惧感和罪恶感[40]。认知行为疗法通常包括12次治疗,每次60~90 min,其重点在于改变患者对创伤的理解和认识。最近,改进版的认知行为疗法在治疗成功率和康复速度方面取得了很好的效果[41]。
神经影像学研究一直致力于了解构成PTSD病理生理基础的生化机制。神经影像学方法已检出PTSD中存在多个异常脑区,下面重点介绍功能MRI、PET及SPECT的最新研究。
1.PTSD的神经回路模型。下丘脑-垂体-肾上腺轴主要参与控制应激反应,并调节体内皮质醇的水平[42]。杏仁核、内侧前额叶皮质和海马的活动可激活下丘脑-垂体-肾上腺轴,这些区域的功能或结构异常在PTSD中被广泛报道。影像学研究表明,腹内侧前额叶皮质可抑制或调节杏仁核和前岛叶的活动,这是理解PTSD患者脑区间相互关系的基础[43]。下面将进一步阐述关键脑区的作用,详见表2。

创伤后应激障碍(PTSD)研究中的神经影像学结果
创伤后应激障碍(PTSD)研究中的神经影像学结果
| 研究 | 显像方法 | 主要结果 |
|---|---|---|
| [46] | 18F-FDG PET | 与对照组相比,危险创伤组右侧杏仁核代谢增加;与危险组相比,非危险创伤组楔前叶代谢增加 |
| [47] | 功能MRI | PTSD组基底外侧核相对于杏仁中央内侧核的激活增加 |
| [48] | 15O-CO2 PET | 退伍军人中PTSD患者较无PTSD者在内侧前额叶皮质局部脑血流量减少 |
| [63] | 静息态功能MRI | 与中性脚本驱动采集相比,催产素降低了创伤脚本驱动采集组杏仁核-左腹侧前额叶皮质的功能连接;催产素增加了2组杏仁核-岛叶功能连接,降低了杏仁核-腹侧前额叶皮质功能连接;安慰剂治疗组在创伤驱动采集后杏仁核-左腹侧前额叶皮质功能连接增加 |
| [50] | SPECT和18F-FDG PET | PTSD组左侧海马和基底节区血流灌注和代谢减少;PTSD组小脑代谢增加 |
| [51] | MRI和18F-AV-45 PET | 与对照组相比,创伤性脑损伤(TBI)+ PTSD组的顶上小叶体积略有减少;与对照组相比,PTSD患者中基于淀粉样蛋白SUV比值的淀粉样蛋白阳性概率降低;没有证据表明TBI与脑淀粉样蛋白沉积增加有关;PTSD或TBI与对照组对比,未见内侧颞叶萎缩的证据 |
| [54] | 功能MRI | 左腹侧前岛叶和前扣带回之间的功能连接降低;右后岛叶和左顶下小叶之间的功能连接降低 |
| [56] | SPECT | PTSD组默认网络增高,TBI组默认网络降低 |
| [55] | 11C-氟马西尼(flumazenil)PET和MRI | PTSD患者较健康对照组在楔前叶和背侧前扣带回皮质与苯二氮 受体结合增高 受体结合增高 |
| [57] | 18F-AV-45 PET | PTSD组在额叶、枕叶和颞叶淀粉样蛋白沉积增加,TBI+PTSD组白质、TBI组小脑和楔前叶淀粉样蛋白沉积增加 |
| [59] | 任务态MRI | 背侧前扣带回皮质、岛叶和杏仁核激活增加可预测治疗后PTSD症状的持续时间 |
2.杏仁核。杏仁核已被证实在PTSD中发挥重要作用,遇到创伤或恐惧刺激时杏仁核会过度激活[44]。最近研究主要探讨杏仁核活动的细微差别,包括研究不同类型的创伤,因为其与杏仁核子区域和杏仁核体积有关[45]。1项纳入患PTSD的美国现役陆军士兵的18F-FDG PET研究发现,经历过危险创伤的患者左侧杏仁核的代谢减低与PTSD的严重程度相关;而在没有危险创伤的患者中,右侧杏仁核的代谢减低与PTSD的严重程度有关[46]。最近的研究还探索了涉及情绪事件编码的杏仁核亚区,包括基底外侧核和中央内侧核[47](表2)。
3.内侧前额叶皮质。内侧前额叶皮质是参与情绪调节的重要区域,在PTSD患者中其不能抑制杏仁核,从而导致恐惧消退方面的损伤。1项15O-CO2 PET显像早期研究发现,在经历过战斗或在战区担任护士的越战退伍军人中,患有PTSD者较无PTSD者在内侧前额叶皮质的静息脑血流量减低[48]。总之,多项神经影像学研究表明,PTSD患者的前额叶皮质的活动减低。
4.海马。压力和创伤可能导致海马区的神经元萎缩和突触变性[45]。目前最大的PTSD有关神经影像研究——"经由Meta分析强化神经影像遗传学"(Enhancing Neuroimaging Genetics through Metaanalysis, ENIGMA)发现,PTSD受试者的海马体积比对照组小,在进行多重比较后差异仍然显著[49]。一些研究还发现PTSD患者的海马代谢和脑血流减少。尽管PTSD患者可能会出现认知功能障碍,并且罹患阿尔茨海默病(Alzheimer′s disease,AD)的风险增加,但与适合的对照个体比,在内侧颞叶萎缩和淀粉样蛋白沉积阳性方面,其相关的病理学特点与AD病理不同[50,51]。由于经历创伤事件并不都会导致PTSD,推测海马的功能和结构异常个体可能更容易患PTSD[52]。海马体积和代谢的减少与PTSD发生的先后有待进一步研究。
5.功能连接。在PET和功能MRI研究中,脑功能连接被定义为在多个时间点的个体受试者中互相联系的激活脑区[53]。许多研究已经对杏仁核、内侧前额叶皮质和海马之间功能连接的差异进行了探索。研究表明,PTSD的发病机制可能与杏仁核与内侧前额叶皮质、海马的连接增加以及杏仁核与下内侧前额叶皮质、岛叶的连接降低有关[54]。
在静息状态,人脑某些脑区的激活比较活跃;当脑受到刺激时,这些区域的激活一起下降,这些脑区构成的网络被定义为默认网络。一些研究显示,在静息和(或)刺激状态下,PTSD患者上述脑区表现出异常的活动水平。此外,11C-氟马西尼(flumazenil) PET显示,PTSD患者的背侧前扣带回、前扣带回上部和楔前叶上具有较高的苯二氮 受体结合率,已知这些区域在默认网络中起关键作用[55]。在患有PTSD或(和)TBI的退伍军人脑灌注SPECT研究中,发现默认网络可以区分PTSD(显示高灌注)和机械性轻度TBI(显示低灌注)[56]。但是,由于缺乏纵向MRI研究及样本量较小,无法确定这些发现与创伤发生时间的关系。还有研究者检测了如淀粉样蛋白沉积等可能影响默认网络活动的神经病理标志,基于体素的分析显示:在PTSD患者的颞叶出现局灶性淀粉样蛋白沉积,但在全脑皮质未见明显的淀粉样蛋白沉积[57,58]。
受体结合率,已知这些区域在默认网络中起关键作用[55]。在患有PTSD或(和)TBI的退伍军人脑灌注SPECT研究中,发现默认网络可以区分PTSD(显示高灌注)和机械性轻度TBI(显示低灌注)[56]。但是,由于缺乏纵向MRI研究及样本量较小,无法确定这些发现与创伤发生时间的关系。还有研究者检测了如淀粉样蛋白沉积等可能影响默认网络活动的神经病理标志,基于体素的分析显示:在PTSD患者的颞叶出现局灶性淀粉样蛋白沉积,但在全脑皮质未见明显的淀粉样蛋白沉积[57,58]。
6.PTSD治疗的影像学研究。由于30%~50%的PTSD患者对治疗没有积极反应,一些研究已开始用神经影像学方法来预测治疗效果。例如,1项对患和不患PTSD的退伍军人进行了功能MRI的研究发现,岛叶、背侧前扣带皮质和杏仁核的激活增加可预测治疗后PTSD症状的持续时间[59]。在监测治疗反应方面,心理治疗已被证实可增加前额叶背侧前扣带回和海马的活动,而减少杏仁核的活动[60];而对退伍军人进行的15O-H2O PET研究显示,正念治疗可增加前扣带回的活动,减少脑叶和楔前叶的活动[61]。杏仁核、脑叶和前扣带回皮质的变化情况也可预测心理治疗的反应,例如,杏仁核基线活动较高与治疗反应较差相关[62]。初步研究显示,鼻腔内注射催产素可能会减弱杏仁核和腹侧前额叶皮质的功能连接[63]。
TBI包括机械性的"创伤性脑功能紊乱",其特征至少包含以下1种:意识丧失、对事故周围事件的记忆丧失、事故发生时精神状态的改变或局灶性神经功能缺损。在美国,TBI患病数约为500万人,年发病率为200/100 000[64],但一些流行病学研究也指出,由于不同研究的年龄、性别、严重程度和研究方法的异质性,TBI的患病率和发病率的统计较为困难。此外,有些TBI没有被患者报告,或者没有被医务人员发现[65]。2008年RAND报告显示,在阿富汗和伊拉克服役的士兵中有7%患TBI,并伴有PTSD或抑郁症[66]。TBI的评价包括成套测试,如格拉斯哥昏迷评分,评估身体损伤、脑和神经功能、意识水平、讲话和语言能力,以及认知和神经心理学功能,如思考、推理、问题解决和记忆能力,从轻到重排序。本文主要介绍的轻度TBI是指任何意识丧失不超过损伤后30 min,记忆力丧失不超过24 h,格拉斯哥昏迷评分至少为13~15分。前期研究发现,中到重度TBI发展为痴呆症的风险增加。基于大量退伍军人的回顾性队列研究表明,即使没有意识丧失的轻度TBI患者,其患痴呆症的风险也较对照组增加1倍[67]。
轻度TBI通常影响的认知域包括注意力、记忆力、执行功能和信息处理能力[68]。焦虑、易怒和社会功能受损等行为和情感的改变会使诊断和治疗进一步复杂化,而抑郁症在受伤后1年内最常见。
TBI的治疗方案是根据患者的主诉和损伤程度制定的。药物治疗可能有助于缓解某些症状,并可降低癫发作和睡眠障碍等一些常见后遗症发生的风险。兴奋性药物,包括哌醋甲酯,可帮助处于急性期的患者提高专注力、注意力和运动记忆,并可缩短恢复时间。行为和认知疗法对一些患者也有效,包括身体、语言和职业治疗以及心理咨询、认知治疗和正念训练等[69]。
尽管影像检查是颅脑外伤后的一线处理措施,但其在TBI急性期和慢性期的应用仍然存在争议。TBI中许多因素的变异性给影像学研究带来了挑战。其中包括损伤机制、迟发后遗症表现的可变期以及伴随因素(PTSD或药物滥用等)的混杂效应[70]。
在颅脑损伤的急性期进行CT或MRI扫描以评估颅内出血和结构损伤情况至关重要。CT平扫是临床上评估中、重度TBI患者,以帮助选择入院治疗还是手术干预的首选方法。当CT检查结果不确定时,MRI可作为进一步的检查方法。MRI的高灵敏度有助于识别脑组织挫伤或进一步确认CT检查的阴性结果。然而,除可以显示存在的结构异常外,CT和MRI检查均不能较好地对轻度TBI患者进行有效的评估。
尽管研究者对18F-FDG PET和其他神经核医学显像模式在TBI中的应用很感兴趣,但其临床价值尚不明确。有研究显示创伤发生后立即引起全脑葡萄糖代谢改变,经受1次钝性创伤的患者会出现脑代谢模式的改变(前额叶和边缘系统为著),即使是在几年后[71]。其他研究显示,受冲击性损伤的TBI患者在部分脑区出现代谢异常降低,特别是小脑区域。然而,即使在损伤机制相似的患者之间,18F-FDG PET的初始显像模式也可能存在很大的不同,所以需要对个体进行长期的评估[72]。
由于对TBI和慢性创伤性脑病认识的深入,以及其与tau蛋白病的密切关系,更多的显像剂被用于相关研究。2-(1-{6-[(2-18F-乙基)(甲基)氨]-2-萘}-乙叉)-丙二腈(2-(1-{6-[(2-18F-fluoroethyl)(methy)amino]-2-naphthy}-ethylidene)malononitrile,18F-FDDNP)、2-((1E,3E)-4-(6-(11C-甲氨基)吡啶-3-基)丁-1,3-二烯基)苯并噻唑-6-羟基[2-((1E,3E)-4-(6-(11C-methylamino)pyridin-3-yl)buta-1,3-dienyl)benzo[d]thiazol-6-ol,11C-PBB3]、18F-THK5351和18F-flortaucipir(也称为18F-T807和18F-AV1451)已被用于脑内tau蛋白沉积的评估。例如,研究报道慢性创伤性脑病患者在灰质-白质交界处灰质区出现多处18F-flortaucipir摄取增高[73]。最近研究显示,不仅一些在多年前遭受过单次脑损伤的TBI患者18F-flortaucipir PET显像表现出显像剂摄取,其摄取形式多样,而且有症状的美国橄榄球联盟球员PET显像也表现出额叶、顶叶和颞叶区域18F-flortaucipir摄取增高[74,75]。需要对TBI和慢性创伤性脑病受试者进行进一步的研究,以评估这些放射性显像剂与临床症状的性质和严重程度的关系,以及个体间摄取模式的差异。
关于其他创伤后神经炎或多巴胺功能改变的PET显像,目前也在进行大样本队列评估[76,77]。在复发性头部创伤患者的早期研究中发现6-18F-氟-L-3,4-二羟基苯丙氨酸(6-18F-fluoro-L-3,4-dihydroxyphenylalanine, 18F-FDOPA)有助于区分创伤后帕金森综合征和帕金森病[76]。在几项研究中,已应用转位蛋白配体PET显像对TBI患者的小胶质细胞活化进行了评估。例如,研究发现在经受过1次损伤的慢性中、重度TBI患者中,其皮质下结构包括丘脑、壳核及部分白质区的N-[11C]甲基-N-(1-甲基丙基)-1-(2-氯苯基)异喹啉-3-氨甲酰[1-(2-chlorophenyl)-N-[11C]methyl-N-(1-methylpropyl)-3-isoquinoline carboxamide, 11C-PK11195]摄取增加[78]。此外,这些结果也在使用第2代转位蛋白配体11C-N,N-二乙基-2-[2-(4-甲氧苯基)-5,7-二甲基吡唑并[1,5-a]吡啶-3-基]乙酰胺(N,N-diethyl-2-[2-(4-methoxyphenyl)-5,7-dimethylpyrazolo[1,5-a]pyrimidin-3-yl]acetamide, DPA-713)、18F-N,N-二乙基-2-[2-(4-(2-氟乙氧基)苯基)-5,7-二甲基吡唑并[1,5-a]吡啶-3-基]乙酰胺[N,N-diethyl-2-(2-(4-(2-fluoroethoxy)phenyl)-5,7-dimethylpyrazolo[1,5-a]pyrimidin-3-yl)acetamide,DPA-714][79]和N-((2-(甲氧基-11C)-苯基)甲基)-N-(6-苯氧基-3-吡啶基)乙酰胺[N-((2-(methoxy-11C)-phenyl)methyl)-N-(6-phenoxy-3-pyridinyl)acetamide,11C-PBR28][77]的研究中得到了验证。
本文涉及的临床研究存在一些问题和限制。例如,在个体水平上应用脑区数据结果为临床诊断或预后提供帮助方面,目前还缺少可信数据支持的灵敏度或特异性信息。这些研究数据主要是在组间水平上获得的,以对所研究疾病相关症状的神经学基础进行探讨的数据。一般来说,这些发现不能通过人脑的视觉图像分析来确定,而是通过论文中使用的基于体素或基于ROI方法进行分析。因此,关于显像对象的选择以及如何选择更常规的临床显像方式是目前值得研究的问题。例如,对于处于神经退行性疾病的早期阶段患者(特别是在老年患者中),更多具有临床意义的特征性发现应该被记录下来;向CRCI患者提供是否合并有AD的信息是有价值的,识别该疾病的特征性神经影像学表现进而介入合适的治疗对患者来说也有重要意义。
即使是最常见的神经退行性疾病——AD,也需要30多年的神经核医学显像研究,通过前瞻性地建立大型数据库以获得系统性、全面性的研究发现,本文所讨论的疾病也是如此。目前CRCI神经核医学显像研究的局限性包括样本量相对小、化疗药物种类繁多、化疗药物组合不同以及难以匹配具有相似癌症组织类型和分期的患者。PTSD的神经影像学研究的特点是样本量小、患者合并精神疾病或其他疾病、遭受的事件类型多以及受使用的药物影响。同样,TBI的神经影像学研究往往受限于较小的样本量、多种疾病并存(包括PTSD)、缺乏相关神经病理学数据以及通常无法进行纵向评估。在许多方面,我们仍然处于了解这些疾病潜在神经生物学改变以及与其临床表现之间关系的相对早期阶段,在此阶段,基于影像学的研究方法发挥了主导作用。展望未来,随着对相关疾病脑显像结果的了解加深,对个体进行量化扫描将为临床上评估患者治疗和预后提供一定价值。



























