
良性甲状腺疾病继续教育文章的第2部分涉及结节性甲状腺肿、甲状腺功能减退症(简称甲减)和亚急性甲状腺炎。该文与第1部分(甲状腺功能亢进症的各种形式)一起,旨在为进行良性甲状腺疾病患者临床管理的核医学专科医师(该系列文章的主要读者)提供相关信息。甲状腺肿表现为甲状腺的肿大,是1种常见的内分泌异常。体质因素、基因异常或者饮食和环境因素可能会导致结节性甲状腺肿的发生。大多数非毒性结节性甲状腺肿患者没有症状或只有轻微的机械性症状(咽球症)。这些患者的诊断性检查包括促甲状腺激素、游离三碘甲状腺原氨酸(T3)、游离甲状腺素(T4)、甲状腺自身抗体检测,超声成像、甲状腺显像和对具有明确超声和显像特征的结节进行细针抽吸活组织检查。多结节性甲状腺肿的治疗包括补充膳食碘、手术、放射性碘治疗(缩减甲状腺大小)和微创消融技术。甲减的范围从罕见的黏液性水肿到更常见的轻度形式(亚临床甲减)。原发性甲减通常有1个自身免疫性病因。新生儿、儿童、成人和老年患者的临床表现不同。诊断性检查包括甲状腺功能检测和超声成像。核医学主要用于定位先天性甲减的异位甲状腺组织或通过高氯酸盐排泌试验检测碘有机化缺陷。治疗包括使用L-T4进行甲状腺替代治疗,根据患者个体代谢和激素需求来调整每日剂量。亚急性甲状腺炎是甲状腺的1种自限性炎性疾病,常伴有无痛性或疼痛性腺体肿胀和躯体体征或症状。炎性反应会破坏甲状腺滤泡细胞,导致储存的T4和T3快速释放,形成初期的甲状腺毒性阶段,随后通常会发生暂时或永久性的甲减。虽然亚急性甲状腺炎常与病毒感染有关,但尚未确定感染源。亚急性甲状腺炎可能是由于遗传易感者被病毒感染所引起的。诊断性检查包括实验室检查、超声成像和放射性核素显像。根据疾病的不同阶段,甲状腺显像可有不同表现,在甲状腺功能亢进期,甲状腺的显像剂摄取量极低或没有,到恢复后期时,甲状腺显像恢复正常。由于亚急性甲状腺炎是自限性的,治疗目的主要为缓解疼痛。大剂量非甾体类抗炎药通常是一线治疗药。如果剧烈疼痛持续存在,可能需要1个疗程的皮质类固醇治疗。高达15%的亚急性甲状腺炎患者会出现永久性甲减,甚至在发病1年后才出现。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
本文是良性甲状腺疾病继续教育系列的第2部分。该系列的第1部分[1]发表在2021年3月的《核医学杂志》(The Journal of Nuclear Medicine)上,涉及由Graves病、毒性多结节性甲状腺肿、毒性腺瘤和破坏性甲状腺炎引起的甲状腺功能亢进状态。第2部分主要讨论结节性甲状腺肿、甲状腺功能减退症(简称甲减)和亚急性甲状腺炎。这2篇文章为核医学专科医师在良性甲状腺疾病患者临床管理方面提供了信息。
1.流行病学和临床表现。甲状腺肿是指甲状腺肿大[>20 cm3(男性)或>15 cm3(女性)],伴或不伴有结节,其是最常见的内分泌异常之一。如果甲状腺功能正常,则被描述为非毒性和结节性甲状腺肿。在美国成年人中,每年新发结节性甲状腺肿占总人口的0.1%~1.5%[2]。女性相较于男性更容易发生甲状腺肿[3]。在碘缺乏地区,甲状腺结节的发病率随着年龄的增长而增加(没有性别相关的差异)[4];而在碘充足地区,结节性甲状腺肿的患病率随着年龄的增长而下降[5]。体质因素、基因异常、饮食或环境因素都可能导致结节性甲状腺肿的发生[3,4,5,6]。甲状腺结节可能成为自主性的,逐渐发展引起甲状腺毒症。
临床上,甲状腺肿分为弥漫性甲状腺肿、孤立结节性甲状腺肿或最常见的表型——多结节性甲状腺肿。大多数非毒性结节性甲状腺肿患者没有症状或仅有轻微的机械性症状(咽球症)。结节性甲状腺肿通常在因其他原因进行超声检查时被偶然发现。甲状腺肿如出现气管、食管、大血管和喉返神经压迫症状,则表明长期的结节性甲状腺肿已部分移位至胸骨后或上纵隔区域。
2.病因和病理生理学。在世界范围内,导致甲状腺肿最重要的环境因素是碘缺乏[3,4,7],且碘摄入量与甲状腺肿的患病率之间存在反比关系[8]。其他致病因素包括遗传易感性、女性、体质量增加和吸烟[7,9,10]。吸烟会促进甲状腺肿的发生,可能是因为香烟烟雾中的硫氰酸盐会阻止碘化过程,导致促甲状腺激素(thyroid-stimulating hormone, TSH)的分泌代偿性增加[11]。
3.实验室检查。应该检测TSH、游离甲状腺素(thyroxine, T4)和游离三碘甲状腺原氨酸(triiodothyronine, T3)。如果TSH降低,游离T4和(或)游离T3升高,则患者已经发展为毒性结节性甲状腺肿。在碘缺乏地区,甲状腺激素生成减少导致TSH升高而产生持续刺激作用,因此结节可能会变成自主性的。
当有甲状腺过氧化物酶、甲状腺球蛋白或TSH受体抗体存在时,提示桥本病和Graves病同时存在。
4.超声成像。超声检查用于确定甲状腺的体积和结节的回声、边缘、形状、实质、钙化、血管分布、大小和弹性,此外还有区域淋巴结的状况(图1;补充文件1;补充材料可见于http://jnm.snmjournals.org)。欧洲甲状腺协会[12]、美国放射学会[13]和美国甲状腺协会[14]根据甲状腺影像报告和数据系统(thyroid imaging reporting and data system, TI-RADS),发布了对甲状腺结节恶性风险进行分层的指南(各指南略有不同)。以超声为基础的标准(表1和表2)将甲状腺结节的恶性风险划分为5类,这与之前将超声恶性风险分为3类的共识指南[15]有所不同;使用不同的欧洲甲状腺协会甲状腺影像报告和数据系统(European Thyroid Association thyroid imaging reporting and data system, EU-TIRADS)评分的甲状腺结节例子见补充文件2。仅根据超声标准划分,大约50%的结节可以归类为良性,且低风险结节的假阴性风险仅为0.3%[12]。目前,关于哪个TI-RADS版本能提供更好的结果,仍然存在争议[16,17]。超声引导对于在细针抽吸活组织检查(fineneedle aspiration biopsy, FNAB)[18]和微创治疗过程中[19]的定位至关重要。
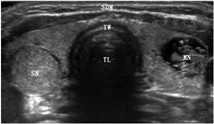

甲状腺结节的TI-RADS超声特征
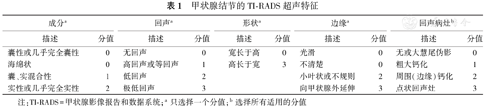
甲状腺结节的TI-RADS超声特征
| 成分a | 回声a | 形状a | 边缘a | 回声病灶b | |||||
|---|---|---|---|---|---|---|---|---|---|
| 描述 | 分值 | 描述 | 分值 | 描述 | 分值 | 描述 | 分值 | 描述 | 分值 |
| 囊性或几乎完全囊性 | 0 | 无回声 | 0 | 宽长于高 | 0 | 光滑 | 0 | 无或大慧尾伪影 | 0 |
| 海绵状 | 0 | 高回声或等回声 | 1 | 高长于宽 | 3 | 不清楚 | 0 | 粗大钙化 | 1 |
| 囊、实混合性 | 1 | 低回声 | 2 | 小叶状或不规则 | 2 | 周围(边缘)钙化 | 2 | ||
| 实性或几乎完全实性 | 2 | 极低回声 | 3 | 向甲状腺外延伸 | 3 | 点状回声灶 | 3 | ||
注:TI-RADS=甲状腺影像报告和数据系统;a只选择一个分值;b选择所有适用的分值
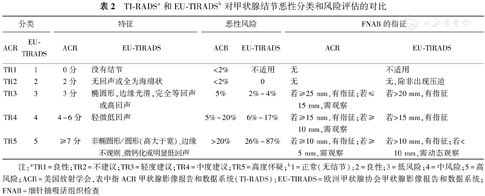
TI-RADSa和EU-TIRADSb对甲状腺结节恶性分类和风险评估的对比
TI-RADSa和EU-TIRADSb对甲状腺结节恶性分类和风险评估的对比
| 分类 | 特征 | 恶性风险 | FNAB的指征 | ||||
|---|---|---|---|---|---|---|---|
| ACR | EU-TIRADS | ACR | EU-TIRADS | ACR | EU-TIRADS | ACR | EU-TIRADS |
| TR1 | 1 | 0分 | 没有结节 | <2% | 不适用 | 无 | 不适用 |
| TR2 | 2 | 2分 | 无回声或全为海绵状 | <2% | 0 | 无 | 无,除非出现压迫 |
| TR3 | 3 | 3分 | 椭圆形,边缘光滑,完全等回声或高回声 | 5% | 2%~4% | 若≥25 mm,有指征;若≤15 mm,需观察 | 若>20 mm,有指征 |
| TR4 | 4 | 4~6分 | 轻微低回声 | 5%~20% | 6%~17% | 若≥15 mm,有指征;若≥10 mm,需观察 | 若>15 mm,有指征 |
| TR5 | 5 | ≥7分 | 非椭圆形/圆形(高大于宽)、边缘不规则、微钙化或明显低回声 | >20% | 26%~87% | 若≥10 mm,有指征;若≥5 mm,需观察 | 若>10 mm,有指征;若<10 mm,需动态观察 |
注:aTR1=良性;TR2=不建议;TR3=轻度建议;TR4=中度建议;TR5=高度怀疑;b1=正常(无结节);2=良性;3=低风险;4=中风险;5=高风险;ACR=美国放射学会,表中指ACR甲状腺影像报告和数据系统(TI-RADS);EU-TIRADS=欧洲甲状腺协会甲状腺影像报告和数据系统;FNAB=细针抽吸活组织检查
5.甲状腺结节的FNAB。在进行甲状腺肿评估的患者中,甲状腺癌的患病率为4%~18%[20]。对具有高风险超声特征的结节,特别是合并有下面进一步描述的核素显像特征的结节,应进行FNAB。表3总结了根据恶性风险对细胞学结果进行分类的2个最广泛使用系统的主要特征,即Bethesda系统和英国甲状腺协会系统。大约20%的甲状腺结节的FNAB有不确定的细胞学结果(Bethesda评分为Ⅲ,或英国甲状腺协会评分为Thy3a-f),恶性的概率为10%~30%[21]。基因突变的分子检测[例如B-Raf原癌基因丝/苏氨酸蛋白激酶(B-Raf proto-oncogene, serine/threonine kinase, BRAF)、大鼠肉瘤型三磷酸鸟苷酶家族(rat sarcoma type GTPase family, RAS)、ret原癌基因(ret proto-oncogene, RET)/甲状腺乳头状癌(papillary thyroid cancer, PTC)和过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor gamma, PPARg)]提高了FNAB在细胞学不确定结节中的准确性[22,23]。

Bethesda报告系统和英国甲状腺协会(BTA)报告系统对甲状腺结节FNAB后细胞学结果的预后分层对比
Bethesda报告系统和英国甲状腺协会(BTA)报告系统对甲状腺结节FNAB后细胞学结果的预后分层对比
| 分类 | 特征 | 恶性风险 | |||
|---|---|---|---|---|---|
| Bethesda | BTA | Bethesda | BTA | Bethesda | BTA |
| Ⅰ | Thy1 | 无诊断性 | 无诊断性 | 1%~4% | 4.5%~8.5% |
| Ⅱ | Thy2 | 良性 | 非肿瘤性的 | 0~3% | 0~3% |
| Ⅲ | Thy3a | 意义不明的非典型性病变/意义不明的滤泡性病变 | 非诊断性的非典型病变 | 5%~15% | ~10% |
| Ⅳ | Thy3f | 滤泡性肿瘤/疑似滤泡性肿瘤 | 疑似滤泡性肿瘤 | 15%~30% | 35%~40% |
| Ⅴ | Thy4 | 疑似恶性肿瘤 | 疑似恶性肿瘤 | 60%~75% | 68%~70% |
| Ⅵ | Thy5 | 恶性肿瘤 | 诊断恶性肿瘤 | 97%~99% | 98%~99% |
6.放射性核素诊断和治疗流程。(1) 123I或99Tcm-高锝酸盐甲状腺显像。甲状腺显像提供了功能性甲状腺实质的图像(图2),包括功能低下的结节(显像图上的冷区)或自主功能性结节(显像图上的热区,结节外的甲状腺实质表现为不同程度的摄取,直到完全抑制)。甲状腺显像结合超声检查可以确定哪些甲状腺结节应该用FNAB来定性[24]。在甲状腺显像中表现为温结节或热结节的病灶很少是恶性的[25],因此,不建议对此类结节进行FNAB(图3)。

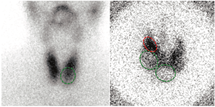

在膳食碘摄入充足的地区,当血清TSH正常时,对弥漫性、结节性或多结节性甲状腺肿患者没有必要进行甲状腺显像,因为在显像中所有此类结节通常表现为冷区,如果存在TI-RADS评分高且任意直径超过10 mm的结节,则应进行FNAB评估[26,27]。然而,在碘缺乏地区,仅凭血清TSH水平可能不足以排除自主功能性甲状腺结节的存在[28],因此应该对所有结节性甲状腺肿患者进行甲状腺显像。1项meta分析显示,在自主功能性甲状腺结节患者中,TSH值正常的发生率为50%(95%CI:32%~68%)[29]。
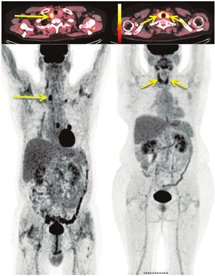
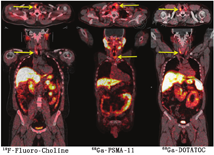
(2)结节性甲状腺肿患者18F-FDG PET/CT检查。在所有18F-FDG显像中,有1%~2%的偶发瘤——在因与甲状腺无关的原因行18F-FDG PET/CT显像时(通常在非甲状腺癌患者中)被发现甲状腺显像剂摄取增加。观察到2种18F-FDG摄取模式,分别为弥漫性和局灶性(图4)。甲状腺弥漫性摄取18F-FDG通常与自身免疫性甲状腺炎有关,几乎没有临床意义[30,31,32]。甲状腺局灶性摄取18F-FDG可见于结节性甲状腺肿,这些偶然发现的结节中约有35%是甲状腺癌[33]。因此,对这些病例应行进一步的检查,以明确结节的性质[34]。在PET/CT显像中意外发现甲状腺肿瘤并不是只有18F-FDG能做到,通过其他的PET肿瘤显像剂也能观察到,例如18F-氟胆碱、68Ga- 1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-苯丙氨酸1-酪氨酸3-奥曲肽(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid(D)-Phe 1-Tyr3-octreotide, DOTATOC)和68Ga-前列腺特异膜抗原配体(图5)[35,36,37]。


FNAB细胞学无法分类的甲状腺结节中,18F-FDG摄取增高的甲状腺结节比18F-FDG摄取未增高的结节更有可能是恶性的(图6);而18F-FDG摄取未增高的甲状腺结节则极不可能是恶性的[38,39,40]。尽管任何高于正常甲状腺背景的局灶性18F-FDG摄取都被解释为阳性,并且高SUVmax会增加恶性肿瘤的风险[39,41],但尚无特定的SUVmax阈值能可靠地区分恶性和良性甲状腺结节。

7.结节性甲状腺肿的治疗。(1)手术。美国甲状腺协会和德国普通外科及内脏外科学会指出,压迫症状是手术的主要指征[42]。
(2)放射性碘治疗缩减甲状腺肿体积。伴有机械性症状的弥漫性或结节性甲状腺肿患者因合并症而不能进行手术时[43],可以用放射性碘治疗。确定给予放射性活度的实用方法基于以下假设:在给药后24 h,每克功能性甲状腺组织达到3.7 MBq(100 μCi)放射性碘靶活度。初始估计值(即3.7 MBq乘以由甲状腺显像评估的功能性甲状腺组织体积)通过24h放射性碘的摄取值来校正。本继续教育文章的第1部分[1]讨论了用更加个性化的基于剂量学的方法,来确定达到治疗目标的放射性碘活度[44]。而在Graves病中,消融功能亢进的甲状腺组织所需要的目标吸收剂量在200~400 Gy之间;头颈部肿瘤的外照射治疗数据表明,100~150 Gy的吸收剂量足以消融正常的甲状腺实质[45,46]。
放射性碘治疗后1年内,可使甲状腺体积平均缩减30%~40%,并在第2年进一步缩减到初始甲状腺体积或质量的50%~60%[43]。为了增加多结节腺体对放射性碘的吸收,可使用重组人TSH(超说明书适应证使用),在放射性碘治疗前24 h肌内注射,单次剂量为0.3 mg[47,48,49,50,51]。治疗前使用重组人TSH的1个好处是,使用放射性碘的活度比治疗前不使用重组人TSH的情况要减少一半左右,从而减少了整体的辐射剂量[52,53]。
除孕期或哺乳期为常见禁忌证外,患者在接受这种治疗之前必须满足一些条件。在放射性碘治疗前必须进行恶性程度的评估(超声检查、甲状腺显像,必要时进行FNAB)。对于延伸至上纵隔的巨大甲状腺肿,必须对甲状腺体积和质量进行评估(可能需要借助MRI或CT平扫)。考虑到囊性病变和其他低摄取区域可能不会对放射性碘治疗产生反应,应通过甲状腺显像来评估功能性甲状腺组织的体积或质量。
由于大多数接受放射性碘治疗的患者在治疗后2~3年内会出现甲减,因此所有接受治疗的患者应每半年进行1次血清TSH检测[42,54]。
8.结节性甲状腺肿的内科治疗。一旦确定结节是良性的,小的结节性甲状腺肿可以通过定期随访监测,通常不需要治疗。由于碘摄入不足在甲状腺肿中起着关键作用,补充碘的摄入后可缩小甲状腺肿体积[55,56]。
过去通过使用L-T4抑制TSH对甲状腺实质和结节的刺激来治疗结节性甲状腺肿。尽管这种方法在过去被广泛使用[56,57,58,59],但对于其长期结果仍然存在争议[59]。目前美国甲状腺协会指南不建议常规使用L-T4治疗良性甲状腺结节[14],但TSH抑制对于轻度缺碘的年轻患者来说仍然是1种可行的选择[59,60]。
9.结节性甲状腺肿的微创治疗。组织消融技术已被用于诱导特定甲状腺结节的坏死或凋亡。最近的微创技术使用不同形式的能量诱导热消融,例如微波、射频、高强度聚焦超声或激光能量等[14]。
1.流行病学与临床表现。甲减是由一过性或永久性的甲状腺功能减退(原发性甲减)、TSH分泌减少(继发性或中枢性甲减)或外周靶组织抵抗引起的1种全身性疾病(补充文件3)。
甲减的范围从严重的临床甲减(黏液水肿)到较轻的亚临床甲减。原发性甲减占甲减的95%~99%,通常与自身免疫性疾病相关。垂体或下丘脑功能缺陷(继发性或三发性甲减)和外周靶组织对甲状腺激素的抵抗,或者由于自身抗体导致其失活是罕见的。
在美国,甲减(定义为TSH>4.5 mU/L)的患病数占总人口的3.7%[61]。在欧洲,临床甲减为0.65%(95%CI:0.38%~0.99%),亚临床甲减为4.11%(95%CI:3.05%~5.31%)[62]。
(1)先天性甲减。先天性甲减是最常见的先天性内分泌疾病(在活产婴儿中发病率为1∶2 200至1∶2 500)。延迟诊断会导致生长迟缓和严重的神经和精神损伤。
(2)儿童和青少年甲减。儿童和青少年甲减的特点是生长迟缓和身材矮小,学习成绩多变但通常下降,症状或体征与成人相似。除病史和体格检查外,实验室评估应包括TSH、游离T4和游离T3。如有异常发现,应将患者转诊至儿科内分泌医师。
(3)成人甲减。甲状腺激素不足会影响几乎每个系统器官的功能,这取决于甲减的程度(表4)。

中重度甲状腺功能减退症的主要病理生理和临床变化
中重度甲状腺功能减退症的主要病理生理和临床变化
| 靶组织或器官 | 甲状腺激素缺乏 |
|---|---|
| 所有组织和器官 | 基础代谢率和产热率降低(易寒)、体质量增加、疲劳 |
| 心血管和肾功能 | 心动过缓、心肌收缩力降低、劳力性呼吸困难、运动耐力降低、肾小球滤过率降低 |
| 神经系统 | 认知和记忆功能受损、嗜睡、眩晕、头痛、四肢麻木或刺痛、外周反射减弱 |
| 胃肠道 | 便秘或顽固性便秘,易形成胆结石 |
| 皮肤及附件 | 皮肤干燥;头发稀疏或脱落;手、脸、眼睑水肿;苍白 |
| 骨骼肌肉系统 | 肌无力;肌肉疼痛、压痛和僵硬;关节痛;腕管综合征 |
| 生殖系统 | 月经量减少、不孕(女性和男性)、流产 |
(4)老年甲减。老年人最常见的症状或体征是疲劳、肌无力、畏寒、皮肤干燥、脱发、便秘、食欲不振、抑郁或情绪低落、听力丧失、心脏增大和充血性心力衰竭。
(5)药物引起的甲减。胺碘酮(1种用于治疗快速性心律失常的富含碘的药物)释放出大量的碘,可能无法逃避Wolff-Chaikoff效应(在下一节中描述),从而导致碘诱导的甲减,尤其是在自身免疫性甲状腺炎的患者中[63,64]。锂剂治疗可能阻断甲状腺激素的释放和合成,从而导致甲减[65]。干扰素可通过加重自身免疫性甲状腺炎或对甲状腺滤泡细胞直接产生细胞毒性作用而诱发甲减[66]。酪氨酸激酶抑制剂也可能引起甲减,其机制尚不完全清楚[67]。
2.病理生理学。成人甲减最常见的病因是自身免疫性甲状腺炎(Ord-Hashimoto病)。其很可能是在易感遗传背景下,由外源性和内源性因素共同造成的[68]。淀粉样变、血色素沉着症、结节病、胱氨酸病、硬皮病或白血病对甲状腺组织的浸润也可能导致甲减和甲状腺肿。
甲减可能由严重碘缺乏或碘过量引起。在严重碘缺乏情况下,任何年龄段都可以观察到巨大甲状腺肿以及不同程度的甲减。过量碘摄入(>1~2 mg/d)会急性抑制碘有机化和甲状腺激素合成及释放(Wolff-Chaikoff效应)。在大多数甲状腺功能正常的受试者中,因为存在1种适应机制(通常在碘负荷后10 d出现Wolff-Chaikoff逃逸效应),因此摄取过量的碘不会导致甲减;然而,对于已有甲状腺功能异常的患者可能无法逃逸Wolff-Chaikoff效应,从而发展为甲减。
在使用抗甲状腺药物或放射性碘治疗甲状腺功能亢进症后,以及在甲状腺全切除术后或头颈部外照射治疗后,可以出现医源性甲减。
3.实验室检查。(1) TSH。原发性甲减以TSH升高和游离T4降低为特征;在亚临床甲减中,TSH升高(通常在5~10 mU/L之间),游离T4正常。在中枢性甲减中,游离T4降低,TSH降低或正常。
(2)抗体。甲状腺过氧化物酶抗体和甲状腺球蛋白抗体在大多数自身免疫性甲状腺炎患者中呈阳性。
(3)血脂。在临床和亚临床甲减中,脂代谢表现为低密度脂蛋白胆固醇水平升高,高密度脂蛋白水平升高或正常。三酰甘油水平正常或略有升高。
4.超声检查。在甲减中,甲状腺体积可以正常、增大(甲状腺肿)或减小(萎缩型慢性自身免疫性甲状腺炎、发育不全或半发育不全)(补充文件4)。不均匀低回声是慢性自身免疫性甲状腺炎的典型表现。超声检查还可以识别先天性甲减中的异位甲状腺组织。
5.放射性核素技术在甲减中的应用。由于甲减的诊断是基于体征或症状以及甲状腺激素水平(TSH、游离T3、游离T4),核医学目前在甲减中作用有限。放射性核素显像在甲减中的唯一应用涉及先天性甲减[69]。99Tcm-高锝酸盐甲状腺显像或123I甲状腺显像(首选123I)是确定甲状腺发育不全或寻找位于纵隔、舌根的异位甲状腺组织的最佳方法,尤其在新生儿或儿童中。
当先天性甲减患者的甲状腺处于正常位置时,甲减的原因可能是基因突变,目前已发现超过25个突变基因[70,71]。过氯酸盐释放试验可探查碘在甲状腺组织内的有机化障碍——先天性甲减的1个原因。被钠/碘转运体介导的主动转运捕获后,滞留在甲状腺内的碘与甲状腺球蛋白结合,因此不再需要主动转运来维持细胞内浓度。过氯酸盐离子抑制钠/碘转运体介导的碘转运和促进尚未与甲状腺激素结合的碘离子的释放。过氯酸盐引起的放射性碘释放可以评估甲状腺内碘有机化和结合障碍[69]。
6.甲减的甲状腺替代治疗。甲状腺每天分泌约85 μg的L-T4。在每日总T3生成量(在健康成年人中约为33 μg)中,约80%来自T4的外周转化,只有约20%直接来自甲状腺分泌。合成的L-T4是治疗甲减的首选药,具有疗效好、不良反应少、服用方便、肠道吸收好、血清半衰期长、成本低等优点。L-T4在体内转化为活性的T3。然而,研究显示在1组甲减患者中单用L-T4治疗的效果却不佳[72];在这些患者中,可考虑使用L-T4和碘塞罗宁(L-T3)联合治疗[73,74]。
内源性甲状腺分泌功能不足的甲减患者需要每千克体质量1.6~1.8 mg的L-T4(理想体质量是比实际体质量更好的预测指标)。对于L-T4需求远高于预期的患者,应评估是否存在胃肠道疾病,如幽门螺杆菌相关性胃炎、萎缩性胃炎、乳糜泻、乳糖不耐受症和肠贾第虫病。当开始服用苯巴比妥、苯妥英钠、卡马西平、利福平和舍曲林等药物时,建议进行血清TSH监测。
在没有进行生化评估的情况下,畏寒或皮肤干燥等症状缺乏灵敏度和特异性,不建议用作替代疗法的有效性评估。在调整L-T4剂量后约6~8周,建议检查血清TSH。
亚急性甲状腺炎是一种自限性的甲状腺炎,通常伴有无痛性或疼痛性的腺体肿胀以及发热、乏力等体征或症状[75]。无痛性亚急性甲状腺炎可能被忽视或误诊,尤其是在产后,偶尔与产后精神病或抑郁症相关[76]。
1895年,Mygind[77]最初将亚急性甲状腺炎描述为"单纯性甲状腺炎",1904年,瑞士外科医师Fritz de Quervain首次描述了亚急性甲状腺炎的病理学,因此后来以他的名字命名该病。炎性反应过程导致甲状腺滤泡细胞破坏,使得储存的T4和T3迅速释放,产生最初的甲状腺毒症期,随后常出现短暂或永久性甲减。
1.流行病学与临床表现。亚急性甲状腺炎的发病率为每年4.9/10万人[78],其患病率在中年妇女中最高(女性与男性比例范围为4∶1~7∶1)。亚急性甲状腺炎通常发生在上呼吸道病毒疾病之后,这被认为是引发该疾病的常见原因。
颈前疼痛是de Quervain甲状腺炎的主要特征。炎性反应可先从1叶开始,后发展到另1叶。患者偶尔有吞咽困难。触诊时腺体肿大、坚硬。在早期可出现甲状腺毒症的征象(心动过速、震颤、皮温升高),有时需要使用β受体阻滞剂。甲亢期之后可能会出现甲减,这通常是暂时的,但有时也可能是永久性的。对于出现甲减症状的患者,应开始L-T4替代治疗,并经常监测TSH以评估是否减量或继续行替代治疗。
2.病因及病理生理学。虽然亚急性甲状腺炎与病毒感染有关[79],但到目前为止还没有发现明确的感染因子[80]。亚急性甲状腺炎的腺体破坏可能会诱发具有遗传易感性患者的甲状腺自身免疫,偶尔会导致慢性自身免疫性甲状腺炎伴甲减[81]或Graves病[82]。
约72%的亚急性甲状腺炎患者存在人白细胞抗原(human leukocyte antigen, HLA)-BW35[83],家族性亚急性甲状腺炎可能与HLA-B35相关[84],这表明该疾病可能由遗传易感个体感染病毒引起。影响免疫系统的相关治疗可能也与亚急性甲状腺炎有关[85],如接受干扰素或利巴韦林治疗的慢性乙型或丙型肝炎患者[66]。
3.实验室检查。实验室检查显示白细胞中度增高,血红细胞沉降率升高,血清C反应蛋白水平升高。在甲状腺毒症期,血清TSH的降低与正常或升高的游离T3和游离T4相关,甲状腺毒性期通常持续4~8周。由于甲状腺滤泡细胞的破坏,甲状腺球蛋白水平也会升高。
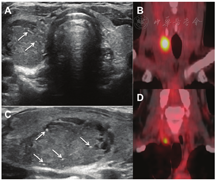
4.超声检查。甲状腺超声显示不均匀、弥漫、低回声和混合回声,彩色多普勒图像上血流信号无明显增加[86]。当病情缓解时,这些异常表现通常会恢复到接近正常(图7)。
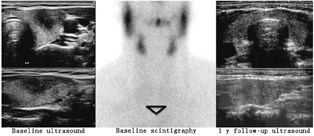

5.放射性核素显像。在甲状腺毒症期,甲状腺显像的特征是甲状腺组织显像剂摄取非常低或不显影,这也是其他破坏性甲状腺炎的特点。(例如:Ⅱ型胺碘酮诱发性甲状腺功能障碍)。根据疾病的不同阶段,可表现为整个腺体或部分腺体放射性分布缺损。即使亚急性甲状腺炎主要累及甲状腺的1叶,甲状腺显像也可能表现为整个腺体完全没有显像剂摄取(图7),这是因为在甲状腺毒症期TSH水平受到抑制。
6.亚急性甲状腺炎的治疗。由于亚急性甲状腺炎是自限性的,在大多数情况下,甲状腺会自发地恢复正常的甲状腺激素分泌状态。治疗的目的是减轻甲状腺疼痛。大剂量非甾体类抗炎药通常是一线治疗药[75]。如果几天后颈部疼痛没有改善,或者出现更严重的颈部疼痛,可以考虑使用糖皮质激素[80],可使疼痛在2d内改善。使用大剂量泼尼松5~7 d后,在接下来的2~4周内逐渐减量。随着剂量逐渐减少,大多数患者不会出现症状复发,但偶尔也会出现复发的情况,这时必须再次增加泼尼松的剂量。
亚急性甲状腺炎的短暂甲减期一般不需要补充甲状腺激素,除非患者有症状。然而,高达15%的患者会出现永久性甲减,甚至在发病后超过1年才出现[75]。































