
预靶向放射免疫诊断(PRID)和预靶向放射免疫治疗(PRIT)旨在利用药用放射性核素有效标记抗肿瘤靶向抗体而分别应用于提高肿瘤显像的对比度和肿瘤治疗指数(TI)。与传统的放射性免疫偶联物不同,预靶向策略将肿瘤靶向步骤与有效载荷步骤分开,在减少正常组织暴露的同时提高了肿瘤的摄取量。预靶向策略的关键参数除了对比度和TI外,还包括抗体的免疫原性和特异性、放射性核素的适用性以及在临床中使用的便利性。预靶向的每个步骤都可以单独优化,且作为模块化系统,预靶向策略可广泛地应用于不同的肿瘤靶点、肿瘤类型或放射性核素。然而,尽管预靶向的多功能性为肿瘤的诊疗提供了巨大的应用潜能,但其过程复杂,在临床转化及如何在患者体内达到最佳使用效果方面面临着较大的挑战。该文旨在简要回顾预靶向策略的起源和发展过程,重点阐述目前已被广泛研究的2种蛋白质递送系统(生物素-链霉亲和素及半抗原-双特异性单克隆抗体)、放射性半抗原和放射性核素。此外,该文还将重点阐述预靶向研究领域的创新成果,包括使用生物正交化学和新型蛋白质载体(如自组装-解组装蛋白质和亲和体分子)进行的预靶向。该文并不是对过去30年PRID和PRIT全面的回顾,而是突出阐述了预靶向发展过程中的里程碑成果,并从TI和毒性方面评价其在临床前模型和临床试验中的应用。相信预靶向策略能够帮助人们认识肿瘤临床诊疗一体化实施的障碍,重新激发人们对放射免疫疗法的兴趣,并指导预靶向研究的进一步发展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
单克隆抗体(简称单抗)可以利用其与肿瘤细胞表面靶标抗原之间的亲和力而有效地将其荷载的细胞毒性物质传递至肿瘤细胞。然而,肿瘤微环境的复杂性以及单抗在体内的药代动力学给放射免疫诊断(radioimmunodiagnosis, RID)与放射免疫治疗(radioimmunotherapy, RIT)带来了巨大挑战[1]。美国食品与药品监督管理局已批准4种放射性免疫偶联物应用于临床肿瘤显像或治疗,从1992年通过OncoScint扫描对肿瘤相关糖蛋白72(tumor-associated glycol-protein 72, TAG-72)的显像,到21世纪初用于靶向CD20治疗的替伊莫单抗(Zevalin)和托西莫单抗(Bexxar)。然而,由于受到医师偏好的影响[2]和放射性药物治疗普遍存在的诸多挑战[3],RIT在临床应用及商业化过程中遇到了诸多阻碍。
尽管RIT对放射性敏感的血液系统恶性肿瘤取得了成功,但其在治疗实体瘤方面尚未在临床中获得成功[1]。近来对α核素治疗的放射生物学探索揭示了其高度复杂的级联反应,包括直接效应、旁观者效应和全身效应[4],表明其对体积较大的肿瘤的治疗非常有效[5]。伴随着治疗核医学的发展和应用,这种级联反应推动了新一代靶向实体瘤抗原的单抗疗法的发展,特别是α核素偶联单抗,包括靶向肿瘤癌胚抗原(carcinoembryonic antigen, CEA)的特异性RIT制剂225Ac-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid, DOTA)-5MA(NCT05204147),靶向间皮素、前列腺特异膜抗原或人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)的227Th标记的RIT制剂(NCT03507452、NCT03724747、NCT04147819),靶向人激肽释放酶2的225Ac-DOTA-h11B6(NCT04644770),以及靶向胰岛素样生长因子1型受体的225Ac-FPI-1434等[6,7,8,9]。
尽管单抗RIT的临床试验效果值得期待,但放射性药物面临的一个常见难题是其偶联的放射性核素的血液系统毒性限制了其应用剂量[3,10]。实体瘤的RIT达不到所需的治疗指数(therapeutic indices, TIs;即肿瘤与正常组织吸收剂量的比值)的部分原因是单抗摄取不足(即实体瘤的亚治疗放射剂量),还可能是由于TIs不佳(导致骨髓毒性和肾毒性)而产生的剂量限制性毒性以及抗药物抗体[1]。目前,放射性免疫偶联物的放射性药理学尚未达到最佳TIs。因此,为了克服这些障碍,亟需在蛋白质工程和放射性配体化学领域取得突破性的研究成果。
预靶向RID (pretargeted RID, PRID)和预靶向RIT(pretargeted RIT, PRIT)通过将肿瘤靶向和放射性载体(如放射性半抗原)递送步骤分开而极大改善了肿瘤显像对比度和TIs,同时创建了易于个性优化的模块化系统(图1)。靶向肿瘤的双特异性蛋白可通过工程化而提高肿瘤的放射性摄取和TI,并可设计1种追踪分子或清除剂将血液中未结合的蛋白质运输至肝脏进而被代谢出体外。在经历数小时或数天的最佳预靶向时间间隔后,通过静脉注射具有高亲和力的配体寻找预定位的双特异性蛋白,而未结合的配体会在数分钟至数小时内从体内清除。
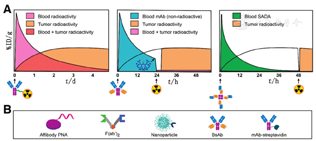

目前的PRID和PRIT方法充分利用了蛋白质工程和生物正交化学反应来克服以前的局限性。然而,PRID和PRIT系统在药物研发(需要开发至少2种产物或1种清除剂)和剂量方案优化(包括使用剂量和预靶向间隔时间)方面有较大的挑战。本文将从历史视角介绍PRID和PRIT的背景,并进一步探讨优化PRID和PRIT的潜在方法,旨在提高肿瘤放射性摄取剂量,并同时提高对放射性敏感的关键组织的TIs。
1.PRID和PRIT的概念。20世纪70年代末,经放射性标记的多克隆抗体在体内靶向肿瘤的研究基础上[11,12],并在单抗发现的推动下,基于单抗的RID的研究激增,RIT也随之兴起[13,14,15]。然而,尽管单抗具有抗原特异性,但大多数在体内不能对肿瘤进行高对比度的显像[15],其关键问题在于经放射性标记的单抗在肿瘤内摄取低,而在周围正常组织中摄取高。因此,研究者们早期就意识到需借助99Tcm血池显影试剂对131I-单抗显像进行计算机减影[16]。
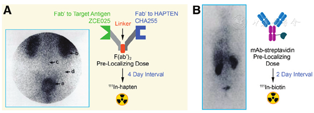
20世纪80年代中期,Goodwin等[17]设计的含有金属螯合物的特异性单抗开创了放射性核素进行预靶向的最早范例。涉及到的金属螯合物通常具有相对分子质量小、亲水性、可结合净负电荷、生理条件下动力学稳定性高等理化性质,同时具有极佳的体内药代动力学和生物分布。抗螯合单抗CHA255进入肿瘤并经过24 h的预靶向间隔后,可被金属螯合半抗原In-4-[N′-(2-羟乙基)硫脲基]-L-苄基-乙二胺四乙酸追踪[18]。螯合追踪是指使用药理学剂量的非放射性螯合半抗原来迫使肾脏快速排泄放射性物质,从而增强显像对比度,并使得正常器官的辐射暴露减少95%[18,19]。随后,Stickney等[20]构建了抗CEA/抗金属螯合半抗原系统的双特异性抗体(bispecific antibody, BsAb),并在高表达CEA的结直肠癌患者中开展了首个PRID临床试验,所获取的14例患者的数据证实了该方案的可行性。在另外21例结直肠癌患者中的肿瘤检出率为20/21,总灵敏度高达95%;在另外9例含有未知病灶的患者中,8例确诊,最快4 h即可观察到肿瘤放射性聚集现象(图2A)[20]。

2.使用生物素-链霉亲和素(biotin-streptavidin, BS)系统的PRID及PRIT的潜能。尽管基于BsAb系统的PRID显现出可观的前景,但由于半抗原的亲和力或活性不足而导致的TIs相关问题促使人们开发其替代品。链霉亲和素是1种来源阿维丁链霉菌(Streptomyces avidinii)的同源四聚体蛋白质,而从蛋清中发现的抗生物素蛋白也是四聚体蛋白质,这2种蛋白质的每个单独的亚基都能够以相似的亲和力与单分子生物素相结合。因其显著的高亲和力,BS系统成为预靶向策略中极具竞争力的候选系统。
1987年,Hnatowich等[21]设计了第1个应用于预靶向的BS系统:包括抗肿瘤单抗-链霉亲和素偶联物、追踪分子和放射性标记的生物素。在1987年至1988年期间,多个研究团队探索了多种BS试剂,并考察了生物素化或单抗-链霉亲和素的免疫反应性、在体内的归宿和药代动力学,以及经放射性标记的BS在动物体内的清除和安全性[22,23]。值得注意的是,Pimm等[22]的研究发现,放射性碘标记的抗生物素蛋白和链霉亲和素可通过肾脏从体内清除,但在肾脏中滞留时间较长。链霉亲和素的免疫原性以及在肾脏中的滞留(包括因此导致的低TI值)使其应用变得棘手,并同时存在剂量限制问题,促使研究者们通过化学修饰(如用琥珀酸酐或1,2-环己二酮)或重组链霉亲和素的方法来解决以上难题[24,25]。1990年,Kalofonos等[26]报道了BS在临床PRID中的可行性。研究人员在10例肺鳞状细胞癌患者中注射了靶向肿瘤的抗人乳脂球抗原1的单抗-链霉亲和素,并在2~3 d后注射了111In-生物素,最终在8例患者体内观察到肿瘤的放射性浓聚(图2B)[26]。
1991年,Paganelli等[27]对19例经组织学确诊的肿瘤患者进行了BS PRID临床研究,采用了包括生物素化抗CEA单抗、亲和素追踪和111In-生物素的三步法策略。除去1例真阴性患者,其余18例患者在注射111In-生物素后不到3 h即可通过γ-闪烁扫描术检测到肿瘤及其转移灶,且无毒性,并具有良好的对比度。
虽然PRID显示了较好的应用前景,但其发展很快被诊断肿瘤的18F-FDG PET/CT所取代[28]。此外,对于诊断来说,良好的显像对比度和单日显像过程可通过快速清除抗体探针来实现。RID仅需要在特定时间点实现肿瘤与正常组织的高对比度即可,而RIT需要在所有时间点上实现高对比度从而实现高TIs。PRID的主要考虑因素是其治疗诊断潜力:指导外科手术、量化靶点表达程度、预测PRIT对肿瘤的疗效。表1和表2分别总结了临床和临床前的PRIT研究,并在剂量测定和TIs方面进行了重点描述。

选取部分侧重剂量学的临床预靶向放射免疫治疗(PRIT)和靶向放射治疗(TRT)研究
选取部分侧重剂量学的临床预靶向放射免疫治疗(PRIT)和靶向放射治疗(TRT)研究

注:a依次给与免疫球蛋白G(IgG)-生物素/亲和素追踪剂/链霉亲和素/生物素化白蛋白糖类抗原/90Y-生物素;b难治性上皮性肿瘤,包括卵巢癌、结肠癌、前列腺癌和乳腺癌;c计量单位不是cGy/37 MBq,基于通过Monte Carlo-3D-RD剂量学程序包获得的肿瘤吸收剂量(0.46~4.52 Gy)和相应的给药剂量(0.46和4.52 Gy分别对应5.6和2.5 GBq),计算出肿瘤平均吸收剂量为0.30~6.69 cGy/37 MBq;CEA为癌胚抗原,DNL为对接-锁定,DTPA为二乙撑三胺五乙酸,hapten为半抗原,mAb为单克隆抗体,ND为未测定,RIT为放射免疫治疗,scFv单链可变片段,TAG-72为肿瘤相关糖蛋白72;所有治疗均为静脉注射
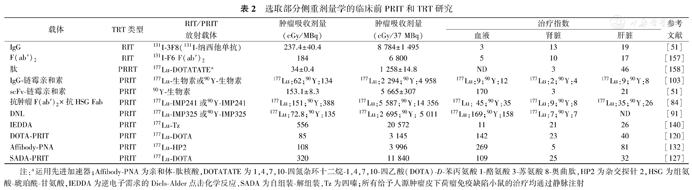
选取部分侧重剂量学的临床前PRIT和TRT研究
选取部分侧重剂量学的临床前PRIT和TRT研究

注:a运用先进加速器;Affibody-PNA为亲和体-肽核酸,DOTATATE为1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)-D-苯丙氨酸1-酪氨酸3-苏氨酸8-奥曲肽,HP2为杂交探针2,HSG为组氨酸-琥珀酰-甘氨酸,IEDDA为逆电子需求的Diels-Alder点击化学反应,SADA为自组装-解组装,Tz为四嗪;所有给予人源肿瘤皮下荷瘤免疫缺陷小鼠的治疗均通过静脉注射
Paganelli等[29]在1997年的临床试验性PRIT研究中使用111In/90Y-生物素结合抗CEA、抗TAG-72和抗肌腱蛋白单抗靶向治疗了多种类型的肿瘤,并获得了理想的TIs。在肿瘤、骨髓、肾脏和肝脏中的吸收剂量(计量单位cGy/37 MBq)分别为15.2±8.7、1.1±0.6(TI=13.8)、4.5±2.1(TI=3.4)和1.5±1.0(TI=10.1)。对11例肿瘤患者(包括乳腺癌、颅脑恶性肿瘤、结肠癌)使用了剂量范围为1.85~5.55 GBq的90Y-生物素,结果显示患者在治疗过程中耐受性良好,且没有观察到急性毒性;然而,在所有患者中均检测到了对链霉亲和素的抗药物抗体。
在接下来的10年里,多种BS PRIT给药方案和注射途径被研究[30]。值得注意的是,在1994年至2005年期间,有超过500例胶质母细胞瘤患者接受了BS PRIT。在1项Ⅰ/Ⅱ期临床试验期间[31],使用111In/90Y-生物素(90Y-生物素使用剂量范围为2.22~2.96 GBq/m2)对48例组织学确认的Ⅲ/Ⅳ级胶质瘤患者进行了五步法静脉抗肌腱蛋白PRIT,结果显示剂量限制性毒性是血液学毒性,最大耐受剂量(maximum tolerated dose, MTD)为2.96 GBq/m2,肿瘤、脑、肾、肝和骨髓的吸收剂量(计量单位cGy/37 MBq)分别为15.20±8.70、0.6±0.3(TI=25.3)、2.7±1.6(TI=5.63)、1.5±1.0(TI=10.1)和0.8±0.5(TI=19.0),并在所有患者中都观察到对链霉亲和素的抗药物抗体。
这些早期的临床研究激励了许多团队在20世纪90年代中后期探索BS在PRIT中的应用潜能[32,33],并致力于改进BsAb的设计,同时寻找除了生物素或金属螯合剂半抗原以外的第二种特异性替代物,其中包括使用互补寡核苷酸的预靶向系统[34,35,36]。Liu[37]已成功将吗啉类互补寡核苷酸应用于体内,但还未进行临床研究。
NeoRx公司开发了1种在使用放射性生物素之前预先靶向肿瘤的单抗-链霉亲和素融合蛋白。在20世纪90年代早中期,他们进一步开发了1种对上皮细胞黏附分子有特异性亲和力的单抗-链霉亲和素化学缀合物——单抗NR-LU-10,用于靶向多种类型的实体瘤[38]。2000年,他们展示了仅使用90Y-生物素PRIT即可有效治愈人源肿瘤(结直肠癌、肺癌和乳腺癌)荷瘤裸鼠的过程,且没有明显的毒性[39]。该研究虽然没有明确报告TIs,但与传统的RIT相比,PRIT的肿瘤与血液AUC比值在注射药物后120 h提高了约20倍(28.3和1.22)。对每只小鼠使用29.6 MBq的90Y-生物素时(未达到MTD),30只治愈小鼠中有28只出现瞬时骨髓抑制,但无明显后遗症。此外,注射后2~120 h,肾脏摄取和滞留量相对较低,约为每克注射剂量的2%。Ⅰ期剂量递增研究试验确定MTD为4.07 GBq/m2[40],5.18 GBq/m2的剂量限制性毒性是胃肠毒性,推荐的Ⅱ期剂量为4.44 GBq/m2。以上研究结果非常有意义,因为剂量限制性毒性不是血液性毒性,且在没有骨髓剂量限制性毒性或使用干细胞支持的情况下,90Y的使用剂量大约比传统RIT高5倍[41]。影像学和剂量学研究结果显示,肿瘤、小肠、大肠、肾脏、肝脏和骨髓中的吸收剂量(计量单位cGy/37 MBq)为16.4±13.2、49.2±25.3(TI=0.33)、34.8±17.9(TI=0.47)、11.5±5.6(TI=1.43)、3.0±1.8(TI=5.47)和0.34±0.08(TI=48.2)[42],其中胃肠道中高剂量的90Y-生物素是由单抗NR-LU-10与肠上皮细胞的交叉反应引起的。此外,在2例使用最高估计剂量(4 000~6 000 cGy)的肿瘤患者中观察到了肿瘤反应;在肠壁吸收剂量约为6 850~14 000 cGy的患者中观察到Ⅳ级腹泻;在接受了约2 170~3 072 cGy的患者中观察到了迟发性肾毒性。Knox等[43]报告了1项Ⅱ期临床研究,对25例转移性结直肠癌患者给予了单剂量为4.07 GBq/m2的经单抗-链霉亲和素预靶向的90Y-生物素[给药剂量为(3.941±0.381) GBq/m2],然而总体肿瘤缓解率低(8%),并观察到了血液性和非血液性毒性(30%的患者出现严重腹泻,2例患者出现迟发性肾毒性)。
NeoRx公司转而采用了另1种泛癌单抗/抗原系统,该系统使用单抗-链霉亲和素化学缀合物(对TAG-72具有特异靶向性的单抗CC49)来递送放射性生物素[44],并在20世纪90年代中期进了临床试验,如在12例患有转移性胃肠道癌患者中评价了111In/90Y-CC49的效果[45]。前期在人源肿瘤荷瘤裸鼠模型中进行的临床前预靶向研究获得了令人满意的结果,其中149Pm-、166Ho-和177Lu-生物素得到的肿瘤与血液的AUC比值分别达到了179、170和371(未报告TIs),并且在注射后1~168 h内,肾脏摄取很低,约为每克注射剂量的1%~2%[44]。在2005年,他们使用CC49-单链可变片段(single-chain variable fragment, scFv)4-链霉亲和素融合蛋白开展了临床Ⅰ期三步法策略的PRIT试验[46]。该研究对9例进展期的结直肠癌患者依次给予CC49-(scFv)4-链霉亲和素、清除剂和111In/90Y-生物素(90Y-生物素剂量为0.37 GBq/m2),影像学和剂量学研究显示90Y在肾脏中的平均辐射剂量(cGy/37 MBq)为7.02(3.36~11.2)、在肝脏中为3.75(0.63~6.89)、在骨髓中为0.22(0.12~0.34)、在肿瘤中为28.9(4.18~121.6),对应的肾脏、肝脏和骨髓的TIs分别为4.12、7.71和131。但该研究未提供关于MTD、剂量限制性毒性和推荐的Ⅱ期剂量的数据,且肾脏的低TI也可能会导致限制剂量。另外,Förster等[47]发现CC49-(scFv)4-链霉亲和素构建体的琥珀酰化可以减少肾脏的放射性摄取,但该结论尚未经过临床验证。
NeoRx公司针对PRIT研究的其他实体瘤单抗/抗原系统包括Lewis Y抗原(与213Bi-生物素[48]或90Y-生物素[49]协同使用)和间皮素(与177Lu-生物素或90Y-生物素[50]协同使用)。此外,他们还使用了1种新颖的抗双唾液酸神经节苷脂(disialog-anglio-side, GD2)-(scFv)4-链霉亲和素融合蛋白,并在人源肿瘤荷瘤裸鼠中用111In-生物素证明了其靶向GD2的高效性[51]。传统RIT和90Y-生物素PRIT的肿瘤吸收辐射剂量(cGy/37 MBq)分别为8 784±1 495和5 665±307。传统RIT获得血液、肾脏和肝脏的TIs分别为3、13和19,而使用90Y-生物素PRIT获得的血液TI有所改善(TI=170),但是肾脏TI降低(TI=3),肝脏TI无明显变化(TI=21)。尽管该系统可降低骨髓毒性,但肾脏的低TI限制了其临床转化潜力。
NeoRx公司还开发了治疗血液肿瘤的PRIT试剂。在20世纪90年代中期,研究显示靶向CD20单抗的RIT对复发性B细胞淋巴瘤患者治疗效果显著,但是需要高度积极配合的骨髓抑制治疗和恢复骨髓造血功能的治疗[52]。2002年,90Y-替伊莫单抗靶向CD20的RIT Ⅲ期研究结果显示该治疗方式耐受性良好,且在肿瘤的总缓解率和完全缓解率方面优于利妥昔单抗[53]。为了改善靶向CD20的RIT安全性,多家公司联合开发了靶向CD20的BS PRIT[54]。他们制备了用于PRIT的抗CD20链霉亲和素化学缀合物,并协同使用90Y-生物素在人B淋巴细胞瘤荷瘤裸鼠模型中进行了临床前研究,同时与传统RIT进行了比较[54]。尽管未披露详细的TIs,PRIT在24 h的肿瘤/血液比值明显得到提高(3和0.4)。此外,在PRIT过程中也表现出了明显的肿瘤放射性聚集。另外,传统RIT的致死剂量为14.8 MBq,所有接受治疗的动物在第10天死于骨髓抑制和感染;而接受90Y-生物素(29.6 MBq) PRIT的9只动物在第12天肿瘤完全缓解,最终8只得到了治愈(在140 d的观察期内没有复发),且毒性也很小。
这些极具前景的临床前PRIT研究推动了非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)患者的Ⅰ/Ⅱ期临床研究[41]。7例复发或难治性NHL患者接受了111In/90Y-生物素治疗(90Y-生物素剂量为1.11或1.85 GBq/m2),结果显示肿瘤、肾脏、肝脏和骨髓中的吸收剂量(cGy/37 MBq)分别为29±23、5.0±1.7(TI=5.8)、1.6±0.5(TI=18)和0.16±0.1(TI=181),且PRIT获得的肿瘤与全身剂量比(38∶1)显著高于传统RIT。此外,给予3倍于传统RIT MTD的90Y剂量,也没有引起明显的骨髓抑制;7例患者中有6例实现了肿瘤缓解,包括3例完全消退和1例部分缓解。另外,在整个过程中,仅观察到了Ⅰ/Ⅱ级非血液毒性,7例患者中有5例出现了暂时的Ⅲ级血液毒性,10例患者中有6例检出抗药物抗体。虽然未定义MTD,但依据剂量限制性的血液学毒性,MTD预估可能超过1.85 GBq/m2,其中肾脏中的摄取最高[(5.0±1.7) cGy/37 MBq],未结合的放射性生物素为1.3 cGy/37 MBq[55]。
为了获得明确同质的融合蛋白,并同时尽可能地简化流程,该研究团队进一步开发了基于基因工程的第二代产品—抗CD20-链霉亲和素融合蛋白,如(scFv)4-链霉亲和素融合蛋白B9E9FP[56]。该融合蛋白在人B淋巴细胞瘤荷瘤裸鼠中得到的肿瘤与血液的AUC比值超过60,并在B-细胞NHL患者中开展了Ⅰ期临床试验[57]。15例NHL患者依次接受了B9E9FP、清除剂和111In/90Y-生物素(90Y-生物素剂量为0.555 GBq/m2),结果显示在肿瘤、肾脏、肝脏和骨髓中的吸收剂量(cGy/37 MBq)分别为26±4、7.7±1.7(TI=3.4)、1.2±0.2(TI=22)和0.25±0.04(TI=104)。MTD、剂量限制性毒性和推荐的Ⅱ期剂量未界定,3例患者中检出大量抗药物抗体,5例患者出现瞬时的低抗体反应。
NeoRx公司开发的针对其他血液肿瘤并用于PRIT的单抗/抗原系统包括CD25(与90Y-生物素或213Bi-生物素协同使用[58])和CD45(与90Y-生物素协同使用[59])。Pantelias等[60]评估了单抗(抗CD20、抗人类白细胞抗原DR、抗CD22)-链霉亲和素协同111In-生物素的多抗原PRIT的疗效。然而,相比较多抗体组合治疗,针对靶向肿瘤抗原表达且经优化的单一抗体治疗获得了最为有利的肿瘤与正常器官摄取放射性比值[60]。另外,抗CD45抗体已在另1个PRIT系统中进行了临床评估。
3.含有多价半抗原的第二代BsAb的PRIT。在20世纪80年代后期,随着BS PRIT的发展,研究者们致力于通过提高半抗原对肿瘤内BsAb而不是循环中的BsAb的选择性来优化对比度。1989年,Le Doussal等[61]在表达CEA的结直肠癌PRID中评估了二价半抗原显像剂的显像效果。二价半抗原通过与肿瘤内BsAb的协同交联使其对肿瘤细胞表现出更大的亲和力,从而提高了肿瘤吸收剂量[61]。此外,不需要额外的追踪分子或清除剂即可得到高对比度的显像,从而极大简化了预靶向方案。Goodwin等[62]在同一时间报道了1种二价Janus半抗原,用于抗螯合单抗的预靶向。
1993~1998年间,Immunotech公司使用抗CEA单抗/金属螯合物特异性单抗BsAb进行了临床PRID研究。其中的金属螯合物特异性单抗可靶向In-二乙撑三胺五乙酸(diethylene triamine pentaacetic acid, DTPA)。研究发现使用二价111In-diDPTA-酪氨酰-赖氨酸放射性半抗原[diDTPA(In)-hapten]的PRID在结直肠癌[63]、甲状腺髓样癌[64,65]以及小细胞肺癌[66]中可获得高对比度的图像。然而使用的鼠源BsAb导致在约60%患者中检测到了抗药物抗体[63]。此外,在使用131I的PRIT中,通过亲和处理合成131I-diDTPA(In)-hapten和其类似物,用于螯合99Tcm和188Re[67,68,69]。在人甲状腺髓样癌荷瘤裸鼠中,相比较传统的RIT,使用92.5 MBq的131I-diDTPA(In)-hapten的PRIT可显著延迟肿瘤生长,且毒性更低[70]。这种方法也在患者体内进行了评估。
最初在甲状腺髓样癌[71]或小细胞肺癌[72]患者中开展的2项Ⅰ/Ⅱ期临床试验中评估了131I-diDTPA(In)-hapten的PRIT疗效,其中所使用的BsAb是1种F(ab)′×F(ab)′化学共轭物。26例甲状腺髓样癌患者接受了1~3次的131I-diDTPA(In)-hapten治疗,剂量范围为0.888~2.220 GBq/m2[71],结果显示在肿瘤、肾脏、肝脏和骨髓中的吸收剂量(cGy/37 MBq)分别为44.33±53.39、5.61±2.02(TI=8.36±10.02)、5.19±2.23(TI=10.86±13.55)、1.60±0.82(TI=29.62±35.32)[71]。骨髓抑制是剂量限制性毒性的关键因素,其MTD和推荐的Ⅱ期剂量为1.78 GBq/m2[71]。在17例可评估的患者中,5例肿瘤负荷较小的患者出现轻微的肿瘤反应[71],有9例(53%)检测到抗药物抗体[71]。在第2个临床试验中,14例小细胞肺癌患者接受了131I-diDTPA(In)-hapten治疗,剂量范围为1.48~6.66 GBq,结果显示在肿瘤、肾脏、肝脏和骨髓中的吸收剂量(cGy/37 MBq)分别为1.8~32.2、3.9~5.0、1.6~5.0和0.4~1.7,不需要血液抢救的MTD为5.55 GBq;在12例患者中,2例患者的肿瘤得到部分缓解,1例超过24个月未复发,尽管没有详细说明Ⅱ期推荐剂量,但据报告显示剂量可增加到11.1 GBq,另外在5例可评估抗药物抗体的患者中,1例患者在2个月后出现明显的抗药物抗体,并持续至12个月[72]。
随后,Kraeber-Bodéré等[73]在35例表达CEA的肿瘤患者中开展的临床试验中优化了人源化BsAb的给药剂量和给药时间:BsAb剂量为10~100 mg/m2,131I-diDTPA(In)-hapten的剂量范围为1.9~5.5 GBq,预靶向间隔为5或7 d。优化后的PRIT方案,如40 mg/m2的BsAb和5 d的预靶向间隔,5.5 GBq的131I-diDTPA(In)-hapten具有良好耐受性,且没有出现骨髓侵犯的症状[73]。
在1项对22例CEA阳性表达的肿瘤患者的随访研究中,Kraeber-Bodéré等[74]采用了不同剂量的人源化BsAb(40~75 mg/m2)和131I-diDTPA(In)-hapten(1.8~2.9 GBq/m2;1.9~5.5 GBq)来评价其抗肿瘤的有效性和毒性。结果表明,骨髓抑制呈BsAb剂量依赖性,剂量为75 mg/m2时会导致高血液毒性,非血液毒性是肝脏毒性(瞬时Ⅰ级或Ⅱ级),并导致较高的全身和肝脏平均辐射剂量(分别为0.38和1.9 Gy);当剂量为40 mg/m2时,全身和肝脏平均辐射剂量较低,分别为0.33和1.4 Gy;此外,平均肿瘤剂量并没有随着BsAb剂量的改变而发生显著变化(75 mg/m2,10.7 Gy,1.7~53.5 Gy;40 mg/m2,18.5 Gy,2.4~49.3 Gy)[74]。该临床试验治疗效果一般,肿瘤并未完全缓解或部分缓解[74]。131I-diDTPA(In)-hapten在甲状腺髓样癌患者体内的MTD为3 GBq,而在非甲状腺髓样癌患者中的数据未披露(超过5.5 GBq)[74]。在1例患者(8%)中观察到人抗小鼠抗体升高,在4例患者(33%)中观察到人抗人抗体[74]。
2006年,Chatal等[75]比较了接受PRIT[1.9~5.5 GBq的131I-diDTPA(In)-hapten]的晚期甲状腺髓样癌患者与同期未经治疗患者的生存情况(后者的数据由法国内分泌肿瘤小组收集),结果显示接受PRIT治疗的患者生存优势更为明显,表明PRIT在临床中具有巨大的应用前景[75]。
除了用于高表达CEA肿瘤的PRID,二价半抗原也用于肾细胞癌的显像:抗肾细胞癌/抗In-DTPA半抗原BsAb和经改善的111In-diDTPA-苯丙氨酸-赖氨酸-酪氨酸-赖氨酸(111In-diDTPA-FKYK),该二价半抗原表现出高效的肿瘤靶向性[76,77]。111In-DTPA和111In-diDTPA-FKYK的比较研究发现,二价半抗原显著改善了肿瘤摄取:在人肾细胞癌荷瘤裸鼠中注射4 h后,二价半抗原和单价半抗原治疗得到的肿瘤吸收剂量分别为每克注射剂量的78%和2%,并具有良好的肿瘤/血液比值[76]。研究者还用D-氨基酸制备了111In-diDTPA-FKYK,使其不易被体内肽酶所消化,并延缓了125I在PRIT期间的衰减[78]。通过这种方法还证明了二价半抗原靶向CEA的有效性[79]。然而,与抗半抗原的单抗相比较,抗螯合单抗正在逐渐失去优势。
4.第三代BsAb PRIT:含有抗组氨酸-琥珀酰-甘氨酸(histidine-succinyl-glycine, HSG)单抗和通过对接-锁定(dock-and-lock, DNL)技术制备的BsAb(图3)。由于抗111In-DTPA半抗原的制备方法受到单抗特异性的限制,因此不能用于靶标90Y或177Lu[80]。尽管已制备了很多抗螯合单抗(如抗Cu-三乙基-四胺和抗Y-DOTA[81]),包括抗2,4-二硝基苯[61]和抗HSG假肽[82]在内的抗半抗原单抗在PRIT中的应用也已有所评估。此外,大约在同一时期还有研究报道了与抗In-DTPA Fab′化学偶联、且具有与二价肿瘤抗原[如抗CEA免疫球蛋白(immunoglobulin, Ig)G或抗CEA F(ab′)2]结合属性的新型BsAb[83]。值得注意的是,用抗CEA IgG或抗In-DTPA Fab′预靶向可获得更为有效的肿瘤摄取及肿瘤滞留,但需要使用清除剂才能达到能够接受的肿瘤/血液比值[83]。因此,就平衡肿瘤摄取和清除而言,不需要清除步骤的F(ab′)2-Fab′ BsAb被认为是进行预靶向最佳的选择[83]。

2003年,Sharkey等[84]开发了1种新型的BsAb[如可与抗CEA F(ab′)2或抗HSG Fab化学偶联的抗结肠特异性抗原-p F(ab′)2]和适用于靶标各种临床相关放射性核素的HSG肽(IMP241用于靶标90Y、111In和177Lu,IMP245用于靶标99Tcm和188Re),从而大大推进了使用HSG PRIT的发展[84]。在人源肿瘤荷瘤裸鼠模型中,使用90Y-或177Lu-IMP241预靶向结直肠癌抗原p,肿瘤吸收剂量为5 587~14 356 cGy/37 MBq,血液、肾脏和肝脏相应的TIs分别为35~45、8~9和26~35[84]。相比较于临床使用的99Tcm标记的靶向CEA抗原的特异性F(ab′)2,HSG预靶向方案在人结直肠癌荷瘤裸鼠的显像方面具有明显优势[85]。此外,2006年研发出了1种在肾脏内滞留较少的可替换IMP241的肽支架。IMP288和经124I标记的PRID也已有所报道[86]。
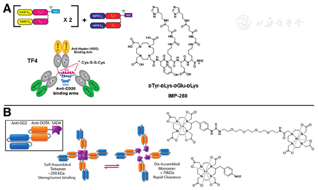
正如单抗-链霉亲和素融合物取代BS那样,重组抗肿瘤/抗半抗原BsAbs正在取代化学偶联物。2003年,Rossi等[87]介绍了1种包含二价CEA和单价HSG的三价BsAb——hBS14,但是通过转基因骨髓瘤细胞工程得到的产率较低。不久之后,他们使用了DNL方法(即利用调节蛋白激酶A二聚化和对接结构域,并利用A-激酶锚定蛋白的锚定结构域),组装合成了多价三功能BsAb(tri-Fab, TF)抗肿瘤/抗HSG半抗原BsAb (图3A)[88,89]。有趣的是,由于DNL法合成的BsAb缺乏使新生Fc受体再循环的CH2结构,其血液清除速度比IgG快很多。目前已用DNL法研发出了针对各种肿瘤抗原的BsAbs,包括针对CEA的TF2、针对CD20的TF4和针对滋养层细胞表面抗原2的TF12[28,90]。IMP325即用非放射性In饱和的IMP288)预靶向表达CEA的LS-174T人结直肠癌皮下肿瘤,其肿瘤吸收剂量测定结果显示效果非常显著:血液和肾脏的TIs分别为169和7,肿瘤吸收剂量约为2 695 cGy/37 MBq[91]。
在1项使用DNL-PRIT的临床前研究中协同使用了90Y-IMP288和抗PAM4-抗原的BsAb TF10[92],并在人胰腺癌Capan-1荷瘤裸鼠模型中证明该PRIT可以安全地与吉西他滨联合使用,并可以实现肿瘤的完全缓解[92]。该研究结果显示高达33.3 MBq的90Y-IMP288在9个月内耐受性良好,且未导致慢性肾毒性(未达到MTD),与最初使用90Y-IMP288的PRIT研究相比有明显改善[93]。
DNL法制备的BsAb的初步临床试验包括在2例疑似结直肠癌患者中使用131I-TF2治疗的0期临床研究(以期描述BsAb的清除动力学)和在1例转移性结直肠癌患者中进行的首次使用111In-IMP288的PRID研究[94]。尽管TF2的剂量需进一步优化,该研究报道使用90Y-IMP288进行PRIT的剂量学测定结果非常理想(肾脏为1.4 cGy/37 MBq;骨髓为0.1 cGy/37 MBq)[94]。随后进一步开展了使用111In/177Lu-IMP288的PRIT临床试验。
1.使用BS系统的PRIT。2013年,Mawad等[95]报道了在接受了异体造血细胞移植的高危急性髓系白血病/骨髓增生异常综合征患者中使用111In/90Y-生物素的临床PRIT试验。基于111In-生物素预处理剂量测定法,5例患者先接受0.7 mg/kg的抗CD45单抗-链霉亲和素,48 h后再接受1.3 mg/m2的90Y-生物素(中位数为2.775 GBq;范围为2.294~4.144 GBq) [95]。临床试验期间,无任何患者因毒性及不良反应而退出研究。2例3级胃肠道不良事件(小肠结肠炎、盲肠炎)被认定为可能与PRIT有关的意外事件,唯一1例4级事件是预期可能发生的与造血细胞移植相关的血细胞减少症[95]。1例患者在治疗1年后肿瘤完全缓解,其他4例患者死于肿瘤进展,中位复发时间为28 (12~155) d[95]。
2015年,1项使用了抗CD20 B9E9和111In/90Y-生物素的PRIT临床试验在高危型B细胞恶性肿瘤患者中进行,目的在于评估PRIT与卡莫司汀、依托泊苷、阿糖胞苷、美法仑化疗和自体干细胞移植联合使用的安全性(NCT02483000)。
Paganelli等[96]对11例乳腺癌患者进行了局部使用PRIT的临床试验:在肿瘤周围注射亲和素,然后静脉注射111 MBq 90Y-生物素。值得注意的是,针对抗生物素蛋白产生的抗药物抗体已被证实不是影响治疗的限制性因素[97]。De Santis等[98]报道了1种抗生物素蛋白变体AvidinOX,其与在组织中半衰期为2 h的天然抗生物素蛋白相比较,半衰期延长到了2周,并且表现出对细胞和间质蛋白的趋向性,从而可综合性增强PRIT的疗效。除了在临床前研究中表现出一定的治疗应用前景[98,99,100,101],使用AvidinOX的PRIT临床试验也已开展(NCT02053324和NCT03188328),但2个项目均因招募人数太少而终止。
PRIT在临床前的应用研究也一直在开展,例如有研究比较了协同211At-生物素-琥珀酰化多聚-L-赖氨酸[102]的177Lu和90Y通过靶向CD20治疗B细胞淋巴瘤的PRIT疗效[103]。1项比较了使用抗CD20 BS的PRIT和使用具有超高亲和力的抗Y-DOTA scFv抗体(C825)的新型BsAb PRIT的"头对头"临床研究表明BsAb PRIT是未来临床试验中的首选治疗方式[104,105]。
2.BsAb预靶向策略。DNL系统在临床前(主要用于开发新型半抗原)和临床中得到了广泛的研究,目前已开展了多项应用DNL法制备的抗CEA TF2和放射性标记的IMP288的试验。已借助DNL法研发的2种新型半抗原包括了1种可在多种肿瘤手术中发挥影像导航作用的新型放射性/近红外多模态半抗原RDC018[106],以及1种用于α-PRIT的213Bi-IMP288[107]。
2013年,1项临床Ⅰ期PRIT研究在20例表达CEA的结直肠癌患者中使用了111In/177Lu-IMP288[108]。根据111In-IMP288的预处理剂量测定,177Lu-IMP288在骨髓中的剂量不超过1.25 Gy,在肾脏中的剂量不超过15 Gy(3.7~7.4 GBq)。基于剂量试验,肾脏中的吸收剂量低于1.85 cGy/37 MBq,骨髓中的吸收剂量范围为0.029 6~0.222 cGy/37 MBq[109];肿瘤剂量为0.46~4.52 Gy,红骨髓剂量范围为0.12~0.97 Gy(平均TI为4.68)[110]。此外,研究人员预估经90Y-IMP288治疗得到的骨髓TI大约比177Lu-IMP288高25%(90Y-IMP288的平均TI为5.41)。该试验中的限制剂量性毒性主要为血液学毒性,未披露推荐的Ⅱ期试验剂量。由于TF2是人源化的并且不含Fc结构,理论上不会产生抗药物抗体,然而在大约50%的重复给药患者中意外地观察到了抗药物抗体,但通过降低输注速率和提前使用预防药物可有效减少相关的不良事件。目前1项针对转移性结直肠癌患者的90Y-IMP288 PRIT试验正在进行(NCT02300922)。
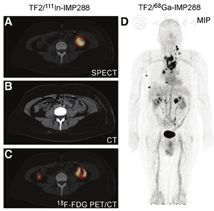
随后,2015年报道了1项在9例表达CEA的小细胞肺癌患者中使用111In/177Lu-IMP288的临床Ⅰ期PRIT研究[111],并于2016年报道了在甲状腺髓样癌患者中首次使用TF2/68Ga-IMP288的PRID研究[112]。在过去的2年里,在结直肠癌患者[113]和HER2阴性/CEA阳性的转移性乳腺癌患者中开展了使用TF2/68Ga-IMP288的临床PRID研究[114]。2021年,Bodet-Milin等[115]公布了在甲状腺髓样癌患者中使用TF2/68Ga-IMP288的临床PRID数据,证明了其对转移病灶检测的灵敏度优于18F-L-二羟基苯丙氨酸PET/CT显像。近期有关TF2/IMP288的临床PRID研究的精选案例见图4。

在过去10年中,除了DNL法开发的BsAb预靶向系统外,另外2种使用超高亲和力(pmol到fmol水平)的抗螯合单抗的BsAb预靶向策略也取得了重大进展。Orcutt等[116]改进了抗DOTA螯合物单抗2D12.5的亲和力,并将其重新改造成scFv,命名为C825。C825已被证明能以相似的亲和力(低于pmol范围)与Lu、Y和Ga的DOTA络合物相结合[116]。
此外,Orcutt等[117]还报道了高度模块化的四价IgG-scFv BsAb结构,并对多种候选DOTA-放射性半抗原进行了筛选,以确定哪种在PRIT中具有最佳的体内特性。经估算,90Y标记的半抗原在人体肝脏、肾脏和红骨髓的剂量分别为0.130~0.192、0.703~0.999和0.029~0.048 cGy/37 MBq[118]。此外,在人结直肠癌LS174T荷瘤裸鼠模型中的研究表明在联合应用葡聚糖-半抗原清除剂的情况下,177Lu-或111In-半抗原抗CEA单抗/C825预靶向效率较优[119]。因为这些研究的缘故,抗螯合剂BsAb平台被称为DOTA-based PRIT或DOTA-PRIT。2014~2018年间,Cheal等[120,121,122]发现使用177Lu-DOTA-半抗原的DOTA-PRIT可靶向多种实体瘤(抗原靶点包括GD2[120],糖蛋白A33[121],HER2 [122])。最近,该团队还开发了1种用于α-PRIT的225Ac-DOTA-半抗原[123]。在人源肿瘤荷瘤裸鼠中使用177Lu-DOTA-半抗原的DOTA-PRIT结果显示,血液TIs为28~142,肾脏TIs为7~23,肝脏TIs为12~47,肿瘤吸收剂量约为1 476~8 473 cGy/37 MBq[120,122,124]。值得注意的是,以内源化著称的抗HER2 DOTA-PRIT在血液、肾、肝中的最低TIs分别为28、7、12,肿瘤吸收剂量约为1 476 cGy/37 MBq[122]。有研究还借助将C825 BsAb平台使用90Y-DOTA-半抗原预靶向了多种血液肿瘤靶点(如CD20[104],CD45[125]以及CD38[126]),血液TIs为6.75~21.4,肾脏TIs为15.9~24.9,肝脏TIs为5.52~7.24,肿瘤吸收剂量范围约为3 981~7 781 cGy/37 MBq。
Santich等[127]还报道了1种新型的BsAb平台,该平台将自组装-解组装(self-assembling-and-disassembling, SADA)结构域与串联的单链BsAb融合而实现高效的两步法放射性半抗原预靶向策略(图3B)。在人源肿瘤荷瘤裸鼠中联合使用抗GD2 SADA-PRIT与177Lu-DOTA-半抗原,不仅可获得高效的肿瘤靶向性,还可达到高TIs(血液TIs为100,肾脏TIs为25,肝脏TIs为32),肿瘤吸收剂量约为11 840 cGy/37 MBq。此外,该团队还开创了安全且能达到抗肿瘤目的的抗GD2 SADA-PRIT联合177Lu-DOTA-半抗原或225Ac-DOTA-半抗原的预靶向策略[127]。抗GD2 SADA-PRIT联合177Lu-DOTA-半抗原的初步临床试验计划于2022年在表达GD2的复发或难治性转移性的实体瘤患者中进行,包括小细胞肺癌、肉瘤和恶性黑色素瘤(NCT05130255)。
2018~2019年间,基于抗1,4,7,10-四(氨甲酰甲基)-1,4,7,10-四氮杂环十二烷[1,4,7,10-tetrakis(carbamoylmethyl)-1,4,7,10-tetraazacyclododecane, DOTAM]抗体对Pb-DOTAM复合物具有fmol级别的亲和力,有研究展示了1种新型的BsAb抗肿瘤/抗螯合半抗原预靶向策略(抗原靶点为CD20,HER2和CEA)[128]。其中,抗CEA/DOTAM BsAb PRIT-0213与Pb-DOTAM或Bi-DOTAM的解离常数分别为0.84 pmol和5.7 pmol[128]。该研究在人源肿瘤荷瘤裸鼠中确定了212Pb-DOTAM在三步法预靶向策略中(使用清除剂)的使用剂量为0.74 MBq。在相对生物有效性为5的基础上,估算人原位胰腺癌细胞BxPC3的吸收剂量为99.55 Gy,血液、肾脏和肝脏的TIs分别为28、14和91。此外,该研究还强调了临床前抗CEA PRIT的治疗结果,并证明3个周期剂量为1.11 MBq的治疗可显著抑制肿瘤生长并延长生存期[129]。
3.使用亲和体分子作为PRIT载体。尽管基于IgG的单抗和BsAb可作为传统的PRIT载体,但其在体内的长期循环会使其很难被完全清除,从而可能会导致意外的旁观者毒性。随着蛋白质工程的飞速发展,可供替换选择的蛋白质构建体也随之出现,如微抗体、双抗体和工程支架蛋白,这些较小的构建体特别适合作为放射性核素显像的载体[6]。亲和体分子是一类非常有前景的工程支架蛋白,因为可通过优化而使其具有高亲和力和缓慢的内化动力学。111In(111In-ABY-025)标记的抗HER2亲和体已应用于临床中表达HER2的弥散型乳腺癌的显像[130]。然而,作为RIT的载体,亲和体分子并不是最理想的选择,因为其在体内残留的放射性金属标记物会导致显著的肾脏摄取[131]。
2016~2021年间,大量研究报道了使用亲和体的PRID和PRIT[132,133]。图5描述并对比了几种预靶向系统:包括99Tcm PRID研究中使用合成的DNA模拟体——肽核酸(peptide nucleic acids, PNAs)[35],以及后续研究中使用点击化学反应的生物正交方法(在下一节中描述)。PNA链与靶向载体共价结合,其中的靶向载体为亲和体,放射性核素有效荷载在互补的PNA链上并进行递送,并在预靶向16 h后注射[132]。互补PNAs的杂交反应作为1种预靶向技术有如下几个优点:高亲和力(pmol解离常数)、低免疫原性和抗体内降解的特性[132]。研究人员在人源肿瘤荷瘤裸鼠中考察了177Lu-PNA[177Lu-杂交探针2(hybridization probe 2, HP2)]的PRIT疗效,结果显示肿瘤的吸收剂量约为3 996 cGy/37 MBq,血液、肾脏和肝脏的TIs分别为269、5和81[132],且这些结果是通过不使用清除剂的两步法预靶向策略实现的。在皮下人卵巢腺癌细胞SKOV-3荷瘤裸鼠模型中,采用了分段PRIT方法(每只小鼠注射96 MBq 177Lu-HP2)。与对照组相比,PRIT治疗组小鼠的中位生存期明显延长,且治疗耐受性良好,无肾脏毒性[132]。有趣的是,研究表明使用了生物正交点击化学方法的亲和体PRIT的疗效较差。尽管该试验未披露小鼠剂量测定数据,但肿瘤与肾脏的AUC比值仅为1.4[133]。然而,该策略较传统的亲和体RIT已经有了明显的改善,因为在传统疗法中肿瘤与肾脏的AUC比值小于1,这也表明了PRIT有希望通过使用工程支架蛋白大幅减少放射性金属在肾脏中的累积[132]。
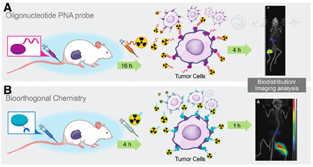

4.使用生物正交反应的预靶向策略。具有亲和捕获属性的预靶向系统是由具有互补反应基团的抗体/配体构成的,当其彼此靠近时,会形成共价连接。Krebs等[134]将此方法应用于以抗螯合单抗为基础的报告基因显像,从而用于嵌合抗原受体T细胞的无创性示踪。与亲和捕获相比,生物正交化学领域中逆电子需求的Diels-Alder点击化学反应的动力学非常迅速(k2>103 L·mol-1·s-1),因此探针可与经化学修饰的抗体直接反应而实现标记[135,136]。2010年,有研究报道了应用逆电子需求的Diels-Alder反应的首次在体PRID研究[137]。不久之后,许多研究团队对此产生了兴趣。早期的研究内容包括可被多种放射性核素标记的新型四嗪基放射性前体、已经改良药代动力学和生物分布特性的第二代放射性标记的四嗪分子、示踪步骤/清除过程的简化合并[138]。
使用经反式环辛烯修饰的单抗并通过逆电子需求的Diels-Alder反应得到的放射性四嗪分子在PRIT中的应用研究也取得了重大进展。2017年,研究者在表达TAG-72的人结直肠癌荷瘤裸鼠中证明了212Pb-四嗪PRIT的有效性[139]。2017~2018年间,177Lu-四嗪[140,141]和225Ac-四嗪[142]的PRIT疗效在多种人源肿瘤(结直肠癌和胰腺)荷瘤裸鼠模型中得到证实。在人源肿瘤荷瘤裸鼠中,177Lu-四嗪PRIT得到的血液TIs为10.4~17.7、肾脏TIs为12.0~19.9、肝脏TIs为19.0~40.1,肿瘤吸收剂量范围为9 472~30 821 cGy/37 MBq[140,143]。此外,最近还有使用64Cu/67Cu进行PRIT的报道,并证明了连续有效给药的放射性四嗪在诊疗过程中的安全性和有效性[144]。使用67Cu-四嗪的PRIT研究得到的血液TIs为6.5~9.7、肾脏TIs为7.2~9.1、肝脏TIs为4.0~4.2,肿瘤吸收剂量范围为2 116~2 331 cGy/37 MBq,以上参数取决于预靶向的时间间隔[144]。
近期的生物正交反应-预靶向策略开发方面的研究集中于新型化学物质(如金刚烷/葫芦脲[145])、新型载体(如纳米粒子[146],更多细节可从近期的综述中获得[147]),以及放射性标记四嗪的持续优化[148]。生物正交反应-PRIT的临床试验正在进行中(NCT04106492),生物正交反应-PRID的临床试验也计划在近期开展[149]。
PRIT的目标是治愈肿瘤的同时避免对正常组织产生过度的毒性。为了实现这一目标,需要更好的方法来测量体内放射性辐射源的剂量。更为详细的基本原理可从以下网址获取:http://jnm.snmjournals.org。
如果要实现对实体瘤的高概率治愈,则需要达到定量的放射生物学目标[1]。因为肿瘤中的所有细胞必须吸收足够的辐射剂量,同时应尽量减少正常组织吸收的剂量(即TI最大化)。尽管RIT的效果取决于多种因素,包括肿瘤大小、靶密度、肿瘤结构(如液态瘤或实体瘤、肿瘤微环境)、放射性核素的类型、靶向部位的异质性和修复放射损伤的能力,但仍可根据实验室和临床经验为后续有效治疗提供一系列合理的基准。
PRIT若要达到治疗实体瘤的目标,需实现单个肿瘤病灶吸收的辐射剂量累计达8 000~10 000 cGy,同时最大限度地减少对辐射敏感组织的剂量,如骨髓(<150 cGy; TI为40~100)、小肠(<250 cGy; TI为40~60)、肾脏(<1 500 cGy; TI为6~10)[1]。需要控制的2个关键参数是肿瘤大小和靶密度,因为它们直接影响肿瘤剂量和TIs。这些PRIT可实现的特性集合称为最佳点,各种形式的PRIT都有可能达到兼备高肿瘤辐射剂量和高TIs的最佳点(如表1和表2)。一些案例也支持了这些观点,如具有中等能量的β发射体131I-NaI也可有效地治疗某些甲状腺癌[150],并在荷载人源异种移植瘤的动物模型中达到抗肿瘤目的,同时没有造成组织病理学上的放射性毒性。
PRIT是1种体内给予放射性药物(内源化治疗的放射性核素或非密封的放射性核素)的靶向放射治疗策略。抗肿瘤载体(如亲和体、单抗或纳米粒子)是靶向肿瘤的载体,并被加以修饰从而可在靶向肿瘤的过程中实现放射性核素的捕获特性。PRIT是1项具有突破性的成就,因为其药物组分可以按时间顺序给药,从而最大限度地增加对肿瘤的辐射,同时使得正常组织受到的辐射最小化。本文介绍了PRIT的现状,并重点阐述使用了放射性半抗原捕获(如使用抗半抗原BsAb或BS的可逆结合)、生物正交反应(不可逆结合)以及亲和体-PNA的预靶向策略,这些技术在人源肿瘤荷瘤动物模型中显示出高TIs值。在以上3种方法中,修饰的抗肿瘤蛋白提供了靶向肿瘤的特异性。此外,目前关于与放射性配体捕获互补的其他抗肿瘤载体和放射性核素的研究也越来越多(图1)。
靶向载体和放射性半抗原/载体的放射性药理学是PRIT获得高TI的关键因素。诸如单抗/半抗原亲和力和免疫原性不足的问题可通过蛋白质工程和单抗人源化来解决。后续的研究可通过更为精确地平衡亲和力、分子大小和抗体载体的物理化学特性来改善肿瘤定位和渗透,同时加快肾脏清除而减少在正常组织中的滞留。此外,随着BsAb设计的创新,无需借助追踪分子或清除剂即可获得足够的对比度和TI值,从而大大简化给药的步骤和试剂。
另一个令人振奋的新领域是高线性能量转移辐射,因为PRIT在该领域中的量化指标较少。尽管目前还不能够完全确定使用剂量,α核素225Ac已经显示出巨大的应用前景[151],且α核素在PRIT中的相对生物有效性的评估工作正在启动[152]。
综上所述,核医学中的预靶向已经实现了许多里程碑式的成果,还包括一些早期临床试验(详细信息可从以下网址获取:http://jnm.snmjournals.org)。具有开创性意义的临床PRIT的安全性已得到证明,并且在招募的患者中可以获得有意义的肿瘤治疗剂量,但是使用剂量依然会受到不佳的TI值、抗药物抗体和方法复杂性的限制。尽管如此,PRIT和放射诊疗学的临床研究表明,患者的选择和治疗计划的制定允许在PRIT期间优化剂量(表1)。通过个性化的剂量测定可能会预测得到最佳使用剂量,从而降低肿瘤治疗剂量不足(导致治疗失败)和正常组织摄取剂量过多(导致放射性毒性)的风险。本文参考文献具体见http://jnm.snmjournals.org。



























