
患者女,51岁,1个月前无明显诱因出现发热,体温最高38.9 ℃,伴畏寒及腰痛;当地医院诊断为大肠杆菌脓毒症,抗感染治疗后恢复正常;因腹部超声提示右上腹脓肿可能,为进一步诊治至本院就诊。入院实验室检查(括号内为正常参考值范围):白细胞和中性粒细胞计数未见升高,铁蛋白481.58(4.63~204.00) μg/L,降钙素原>200.00(0~0.05) μg/L;血培养及骨髓培养:阴性;尿培养:屎肠球菌阳性。胸腹部CT示:双肺弥漫性薄壁囊性病变(性质待定),肝脏多发错构瘤,双肾错构瘤。腹部MRI示:肝脏多发错构瘤,双肾错构瘤、右肾包膜下脓肿(图1A)。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,51岁,1个月前无明显诱因出现发热,体温最高38.9 ℃,伴畏寒及腰痛;当地医院诊断为大肠杆菌脓毒症,抗感染治疗后恢复正常;因腹部超声提示右上腹脓肿可能,为进一步诊治至本院就诊。入院实验室检查(括号内为正常参考值范围):白细胞和中性粒细胞计数未见升高,铁蛋白481.58(4.63~204.00) μg/L,降钙素原>200.00(0~0.05) μg/L;血培养及骨髓培养:阴性;尿培养:屎肠球菌阳性。胸腹部CT示:双肺弥漫性薄壁囊性病变(性质待定),肝脏多发错构瘤,双肾错构瘤。腹部MRI示:肝脏多发错构瘤,双肾错构瘤、右肾包膜下脓肿(图1A)。
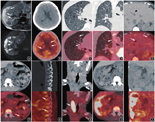

18F-FDG(本中心自行制备,放化纯>95%)PET/CT(荷兰Philips Ingenuity TF型)显像(图1B,图1C,图1D,图1E,图1F,图1G,图1H,图1I,图1J)示:双侧侧脑室室管膜下多发钙化灶,SUVmax为2.3;双肺弥漫分布大小不一囊状影,SUVmax约0.6;肝脏及双肾多发错构瘤,SUVmax约2.1;全身多发骨质密度增高区,SUVmax约2.3;以上征象考虑为结节性硬化症(tuberous sclerosis, TSC)。右肾包膜下"新月"状混杂密度影,SUVmax约5.9,考虑为感染。临床诊断为TSC伴右肾包膜下脓肿。根据尿培养及药敏试验结果,选择万古霉素、头孢哌酮钠舒巴坦钠、美罗培南联合抗感染,患者体温平稳后出院,3个月后随访患者未诉明显不适。
TSC是1种较为罕见的多系统常染色体显性遗传综合征,该疾病由TSC1或TSC2基因突变以及雷帕霉素机制靶点通路过度激活导致[1,2],皮肤、脑实质、眼、心肌、肾等多个器官的良性肿瘤是该疾病的主要特点[3]。累及不同器官会导致不同的临床症状:累及神经系统会导致癫痫[3];累及肺导致肺淋巴管肌瘤病(pulmonary lymphangioleiomyomatosis, PLAM),造成气胸、气促[4] ;累及心肌会导致心肌横纹肌肉瘤,造成心律失常、瓣膜缺损或心力衰竭等[2]。依据国际TSC共识大会制定的2012版TSC诊疗指南(以下简称指南)[5],本例患者有以下主要临床特征:(1)室管膜下结节;(2) CT示双肺呈PLAM表现;(3)双肾多发错构瘤。该患者虽然未行基因检测,但已经达到临床诊断标准。
本例患者首先进行了胸腹部CT及腹部MRI检查,2种检查均诊断肝脏及双肾错构瘤,CT发现多发薄壁囊性病变,未做定性诊断。CT空间分辨率及密度分辨率高,显示病灶形态、分界较为清晰,能准确显示肺内弥漫囊性病变、肝脏及双肾内脂肪和软组织成分,但CT软组织分辨力不及MRI。MRI进一步明确肝脏及肾脏的错构瘤中各种组织成分,但扫描时间长,对肺部疾病的诊断价值受限。PET/CT通常行全身显像,能显示病灶的代谢和解剖信息,本例中,其在发现全身病灶、提示TSC诊断及其伴发感染中有着重要的价值。
TSC的PET/CT显像以个案报道为主,有学者认为PET/CT可以发现TSC是否合并恶性肿瘤[6,7]。由于TSC造成的各器官病灶多为良性病灶,PET/CT能通过葡萄糖的代谢提示其是否合并了恶性及炎性病灶,从而避免延误治疗。本例患者右肾包膜下脓肿首次被MRI发现;由于CT平扫对软组织分辨率和鉴别价值有限,在肾脏形态失常伴错构瘤的背景下,难以发现合并的感染,从而出现漏诊;而多数炎性及感染病灶葡萄糖代谢增高[8],PET/CT通过反映代谢信息能清晰分辨本例右肾包膜下脓肿(图1I,图1J)。该患者在当地医院诊断脓毒血症并进行抗生素治疗后症状有所缓解,虽然本院就诊时WBC及中性粒细胞处于正常范围内,但结合MRI T2加权成像(weighted imaging, WI)高信号、弥散加权成像(diffusion-weighted imaging, DWI)扩散受限表现及PET/CT高代谢表现,临床诊断为右肾包膜下脓肿,后续抗生素联合治疗后患者痊愈出院及3个月后随访进一步确立了该诊断。
常规的影像学以局部检查为主,临床较少利用CT、MRI及超声进行全身检查,对于TSC等累及全身的疾病往往仅能发现一隅;而PET/CT作为1种常规全身(颅顶至股骨中上段)检查,对于累及全身的疾病通常能给予较为准确的诊断及分期[9]。由于本例未行CT及MRI颅脑扫描,PET/CT首次发现该病颇具特征性的室管膜下结节(图1B),为临床确立诊断提供了重要的信息。此外,该病常伴随有癫痫[3],PET/CT在诊断TSC所致癫痫方面较传统影像学检查更具优势[10,11]。随着PET/MR的应用增加,以癫痫为主要症状的TSC报道逐渐增加,Chandra等[12]利用PET/MR确定致痫灶更加精确;Wu等[13]认为PET/MR作为非侵入检查可以有效指导手术切除范围。笔者认为PET/MR设备较少、价格昂贵限制了其在TSC的应用,PET/CT联合MRI或异机融合可弥补其不足。
虽然指南[5,14]对于椎体内高密度结节(图1G)未进行详细描述,Boronat等[15]认为此类病灶为硬化性骨病损,与神经嵴细胞有关,笔者认为此征象也可以作为诊断TSC的征象之一。TSC常伴随甲状腺乳头状癌[5,14],本例患者甲状腺右侧叶肿大伴代谢增高(图1H),由于颈部未行其他影像学检查,笔者推测甲状腺右侧叶病变为功能性腺瘤可能性大。
综上,PET/CT作为1种分子影像学全身检查,诊断TSC等全身性疾病较传统影像学检查有独特的优势,并可以发现一些传统影像学难以发现的病灶,对于疾病的随访及疗效评价有着不可替代的作用。
所有作者声明无利益冲突


























