
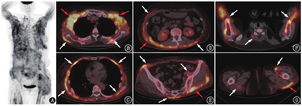
患者女,64岁,主诉发现臀部结节1年,皮疹8个月,发热6个月。患者1年前左侧臀部无明显诱因出现质硬结节,后因频繁搔抓导致局部皮肤破损,伴结节红肿、触痛,当地医院予抗生素治疗后症状未缓解。8个月前患者左侧臀部皮损较前明显增大,同期出现额部、眼睑及双上肢皮疹,伴乏力,外院予外用及口服药物治疗(具体不详)后皮疹逐渐消退。7个月前患者于当地医院行左侧臀部皮损清创术,术后病理提示:皮肤表面溃疡,皮下纤维组织增生及急、慢性炎性细胞浸润。清创术后患者臀部伤口未愈合,再行负压引流(vacuum sealing drainage, VSD)联合游离皮瓣移植术后创面愈合。6个月前患者出现间断发热,最高体温39.3 ℃,每日3~4个热峰,伴乏力、全身肌肉酸痛和右侧膝关节肿痛,外院反复抗感染治疗后症状无明显改善。既往史:患者10年前诊断为原发性高血压,规律服用降压药物,血压控制水平可。家族史:丈夫患有髋关节结核,孙女曾患结核性胸膜炎。患者为进一步诊治就诊本院,入院后查WBC计数10.46(括号内为正常参考值范围,下同;3.50~9.50)×109/L,C反应蛋白(C-reactive protein, CRP) 154.40 (>8.00;提示急性炎性反应) mg/L,肌酸激酶(creatine kinase, CK) 25(24~170) U/L,血培养阴性,类风湿因子、抗核抗体、抗中性粒细胞胞质抗体阴性,肿瘤标志物正常。双大腿MRI提示双侧臀部、髋关节周围及大腿各组肌肉多发异常信号,考虑炎性病变可能。体格检查四肢近端肌肉压痛明显。临床为排查肿瘤并明确发热原因行18F-FDG PET/CT显像(图1),结果示躯干和四肢近端骨骼肌代谢弥漫不均匀增高,肌肉周围筋膜代谢增高更明显,部分受累肌肉密度略减低,SUVmax 8.4;受累肌肉周围皮下脂肪间隙可见多发代谢增高的软组织影及条索影,SUVmax 7.3;另外双肺可见少许陈旧性斑片、条索影,双肺门及纵隔可见炎性淋巴结,密度较高,部分伴钙化,SUVmax 5.9;甲状腺右叶亦见一代谢增高的结节,SUVmax 13.7,考虑为甲状腺原发病变,建议患者进一步行超声检查。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,64岁,主诉发现臀部结节1年,皮疹8个月,发热6个月。患者1年前左侧臀部无明显诱因出现质硬结节,后因频繁搔抓导致局部皮肤破损,伴结节红肿、触痛,当地医院予抗生素治疗后症状未缓解。8个月前患者左侧臀部皮损较前明显增大,同期出现额部、眼睑及双上肢皮疹,伴乏力,外院予外用及口服药物治疗(具体不详)后皮疹逐渐消退。7个月前患者于当地医院行左侧臀部皮损清创术,术后病理提示:皮肤表面溃疡,皮下纤维组织增生及急、慢性炎性细胞浸润。清创术后患者臀部伤口未愈合,再行负压引流(vacuum sealing drainage, VSD)联合游离皮瓣移植术后创面愈合。6个月前患者出现间断发热,最高体温39.3 ℃,每日3~4个热峰,伴乏力、全身肌肉酸痛和右侧膝关节肿痛,外院反复抗感染治疗后症状无明显改善。既往史:患者10年前诊断为原发性高血压,规律服用降压药物,血压控制水平可。家族史:丈夫患有髋关节结核,孙女曾患结核性胸膜炎。患者为进一步诊治就诊本院,入院后查WBC计数10.46(括号内为正常参考值范围,下同;3.50~9.50)×109/L,C反应蛋白(C-reactive protein, CRP) 154.40 (>8.00;提示急性炎性反应) mg/L,肌酸激酶(creatine kinase, CK) 25(24~170) U/L,血培养阴性,类风湿因子、抗核抗体、抗中性粒细胞胞质抗体阴性,肿瘤标志物正常。双大腿MRI提示双侧臀部、髋关节周围及大腿各组肌肉多发异常信号,考虑炎性病变可能。体格检查四肢近端肌肉压痛明显。临床为排查肿瘤并明确发热原因行18F-FDG PET/CT显像(图1),结果示躯干和四肢近端骨骼肌代谢弥漫不均匀增高,肌肉周围筋膜代谢增高更明显,部分受累肌肉密度略减低,SUVmax 8.4;受累肌肉周围皮下脂肪间隙可见多发代谢增高的软组织影及条索影,SUVmax 7.3;另外双肺可见少许陈旧性斑片、条索影,双肺门及纵隔可见炎性淋巴结,密度较高,部分伴钙化,SUVmax 5.9;甲状腺右叶亦见一代谢增高的结节,SUVmax 13.7,考虑为甲状腺原发病变,建议患者进一步行超声检查。

在临床工作中,PET/CT图像上骨骼肌的代谢情况有时会被忽略,这主要是因为骨骼肌本身的病变比较少,而肌肉的代谢容易受活动等生理性因素的影响。静息状态下骨骼肌的主要能量底物是脂肪酸,18F-FDG PET/CT图像上骨骼肌表现为对称、轻度、均匀的代谢,SUVmax一般为0.5~2.2[1]。葡萄糖转运蛋白(glucose transporter, Glut)-4在骨骼肌葡萄糖转运和代谢过程中发挥重要作用,在运动刺激或胰岛素介导下,骨骼肌细胞中的Glut-4从细胞浆的囊泡中转运到细胞膜上并参与葡萄糖转运,从而增加了骨骼肌葡萄糖或FDG的摄取,因此骨骼肌的代谢会不同程度地增高[2,3]。这也是18F-FDG PET/CT检查前需要控制血糖(更主要是为了控制胰岛素水平)和避免剧烈活动的原因。
肌肉的生理性活动增加是最常见的引起骨骼肌代谢增高的原因。例如检查前健身会导致相应肌肉代谢增高,在FDG注射后的等待期间咀嚼口香糖会导致咀嚼肌代谢增高,呼吸困难的患者可出现呼吸肌(主要是膈肌和肋间肌)代谢增高(图2),慢性阻塞性肺疾病患者的呼气肌(主要是腹肌)会代谢增高,一些不自主的运动(如寒战、焦虑等造成的肌紧张)也可导致肌肉代谢增高[4]。患者在检查前进行适当的准备可避免肌肉代谢增高的情况。
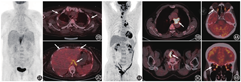

肌肉生理性摄取的变化有时有一定的病理提示意义。在FDG注射后的等待期间说话可以导致双侧声带代谢对称性增高;单侧声带的代谢增高在除外声带病变后,需要考虑一侧喉返神经麻痹导致的对侧声带代偿性代谢增高,而喉返神经麻痹有时可因颈部或纵隔主肺动脉窗的肿瘤侵犯喉返神经引起(图3)。正常情况下,眼外肌的生理性活动活跃,FDG代谢比较高(尤其是内直肌),当一侧眼外肌代谢明显减低时,需要考虑眼外肌麻痹的可能,在阅片时注意颅底动眼神经、滑车神经、外展神经等走行区是否存在病变(图4)。另外,由于失神经支配可能导致骨骼肌的葡萄糖代谢增加,周围神经病变可能会导致所支配的肌肉代谢增高,如颈部手术若损伤了副神经,可能导致同侧的斜方肌代谢增高[5]。
本例患者受累肌肉范围广泛,代谢不均匀,并且代谢增高区以骨骼肌表面的筋膜为主,部分肌肉有密度改变,因此考虑肌肉代谢增高的原因是病理性的。导致肌肉代谢增高的疾病有炎性病变和肿瘤性病变。肌肉原发良性肿瘤(如侵袭性纤维瘤、背部弹性纤维瘤、黏液瘤、横纹肌瘤等)和恶性肿瘤(如横纹肌肉瘤)的代谢可增高,良性病变的代谢通常低于恶性病变,且病变多单发[2]。骨骼肌转移瘤多表现为肌肉局灶性代谢增高,主要见于肺癌、肾细胞癌和结肠癌[1]。患者一般有明确病史,通常发生肌肉转移时肿瘤已全身广泛转移,PET/CT比较容易诊断。淋巴瘤累及肌肉较罕见,多为T细胞淋巴瘤,常见受累部位为大腿和上臂肌肉,可表现为局灶性肿块或弥漫性肌肉浸润,FDG摄取通常明显增高(图5)[2]。本例患者肌肉病变无明显占位效应,并且筋膜病灶比肌肉本身更重,既往也没有肿瘤病史,不支持肌肉肿瘤性病变的诊断。
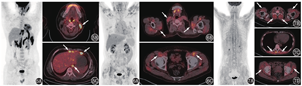

肌肉感染或非感染性炎性反应也可以表现为肌肉代谢增高。结核性肌炎非常少见,仅占所有结核病的1%~3%[6],病原菌血行播散是其主要感染途径。结核性肌炎常起病隐匿,可表现为发热、局部包块、皮疹、肌痛、肌无力等,可累及几乎所有肌肉,常累及骨盆和下肢肌肉群。该病可伴全身其他脏器的结核病变,也可为单发[6]。FDG摄取与疾病炎性反应活动程度有关。结节病是一种原因不明的系统性疾病,病理特点是非干酪样肉芽肿性炎,病变FDG摄取非常高。结节病可累及全身各脏器,最常受累的是淋巴结和肺,肌肉受累少见[1,7]。皮肌炎是一种特发性炎性肌病,多数患者表现为肌无力和肌肉炎性反应,同时伴有特征性的皮肤损害,主要累及肩胛带肌和骨盆带肌,有时也可以累及颈部、喉部肌肉,甚至消化道肌肉和膈肌[8]。肌炎特异性抗体阳性可见于45%~85%的患者,与肌炎疾病的独特临床表型和组织病理学表现相关[9]。皮肌炎的肌肉病理学可见肌纤维变性、坏死,肌束膜区域和血管周围有明显炎性细胞浸润[10]。18F-FDG PET/CT表现为四肢近端肌肉及肢带肌对称性代谢增高(图6),代谢程度和累及范围与炎性反应累及程度和疾病活动度相关(图7)。
本例患者就肌肉病变的影像特征来看,要考虑炎性病变的可能。患者之后行肌电图提示双下肢可疑肌源性损害,肌炎相关抗体抗黑色素瘤分化相关基因5(melanoma differentiation associated gene 5, MDA5)抗体阳性。临床诊断为抗MDA5抗体阳性的皮肌炎,予足量激素联合甲氨蝶呤治疗后,患者体温逐渐恢复正常,四肢近端肌肉压痛好转,炎性指标也降至正常范围。20d后,患者再次出现发热,最高体温39.0 ℃,CRP 302.71 mg/L,血二代测序(next-generation sequencing, NGS)检测到结核分枝杆菌。为进一步明确诊断,患者行右侧股四头肌活组织检查,病理提示肌肉组织炎性改变,肌纤维变性、坏死,局灶肌外膜及肌束间可见淋巴细胞及中性粒细胞浸润,可见较多抗酸及弱抗酸染色阳性的杆菌,考虑结核感染。最终临床诊断为皮肌炎合并血流播散性结核,考虑发热与结核感染相关,加用五联抗结核治疗后患者症状明显改善。由于特殊的免疫基础及长期接受激素和免疫抑制剂治疗,皮肌炎患者也容易合并各种感染[11]。特发性炎性肌病住院患者的感染发生率为27.6%,其中细菌感染是最常见的感染类型[12]。值得注意的是,特发性炎性肌病合并分枝杆菌感染的发生率为3.69%,以结核分枝杆菌最常见;播散性结核病(46.58%)和肺结核(49.07%)的发生率相当,且肌肉受累较为常见,可能的原因为结核分枝杆菌容易在特发性炎性肌病患者变性或坏死的肌肉组织中种植[6,13]。本例患者的肌肉病变不完全符合皮肌炎多对称受累的特点,并且肌肉周围的筋膜受累比肌肉本身更重,因此PET/CT显像上的病变特点还是要考虑合并感染的可能,皮肌炎合并肌肉感染能够解释本例全貌。
骨骼肌病变虽然不如其他器官或组织的病变多见,但也值得关注和学习。作为核医学医师,首先要掌握肌肉生理性和病理性代谢增高的各种原因和模式,其次要熟悉肌肉常见病变的表现并建立鉴别诊断思路。在分析肌肉影像学表现时,需要结合肌肉的生理功能、神经支配和临床病史等综合考虑,思考相应原因或疾病能否解释病变全貌,方能正确诊断。
所有作者声明无利益冲突


























