
新型PET和SPECT显像剂的研发主要针对于未能满足的临床诊断需求,这一需求体现了心血管医学中与分子表征和个性化治疗相关的全系统趋势。该文将分2部分讨论一些新型的放射性显像剂,其可能有助于解决心血管医学核心领域中尚未解决的诊断方面的需求,如心力衰竭、心律失常、瓣膜病、动脉粥样硬化和血栓。该文第1部分回顾了与心血管放射性显像剂研发相关的关键技术要点,并综述了用于心肌灌注显像和心脏神经显像的新型放射性显像剂,重点讨论了包括新型PET心肌灌注显像剂2-叔丁基-4-氯-5-[4-(2-氟-18F-乙氧基甲基)苯基甲氧基]-3(2H)-哒嗪酮(18F-flurpiridaz)、18F标记心脏神经显像剂(如18F-氟溴苯胍)等的研发;第2部分主要讨论了包括用于炎性反应、纤维化、血栓形成、钙化和心脏淀粉样变显像等的新型放射性显像剂。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
尽管对患者的护理水平明显进步,心血管疾病仍是导致患病和死亡的主要原因。诊断、治疗和风险管理水平的提高改变了患者护理的局面,却可能导致慢性心血管疾病患病率的上升,如心力衰竭(简称心衰)患者的数量预计将从2012年的580万增加到2030年的850万[1]。患者人口统计学的发展以及对心血管病理生理学认识的提高,填补了心血管疾病中许多当前诊断和风险分层的空白。新兴的分子显像技术有望解决许多临床尚未解决的问题(表1)。

尚未满足的心血管疾病诊断需求
尚未满足的心血管疾病诊断需求
| 临床领域 | 尚未满足的需求 |
|---|---|
| 心力衰竭和心肌病 | 射血分数保留的心力衰竭:表型特征,治疗进展 |
| 射血分数减低的心力衰竭:预后,精准治疗方法 | |
| 心肌梗死后心室重构:预后 | |
| 免疫治疗/化疗相关的心脏毒性:预测、早期识别、预后和疗效评估 | |
| 心肌淀粉样变:单次扫描诊断和分型(轻链型和转甲状腺素蛋白型) | |
| 心脏结节病:减少对饮食准备的依赖,与其他类型心肌炎/非特异性摄取的鉴别 | |
| 遗传性心肌病:无症状或表型阴性携带者和携带未知意义变异者的风险分层 | |
| 心脏纤维化:可重复的量化,区分活动期和稳定期病变 | |
| 左心辅助装置:预测左心室心肌的恢复 | |
| 新型药物治疗(如血管紧张素受体脑啡肽酶抑制剂、钠-葡萄糖协同转运蛋白2抑制剂):确定作用机制,疗效追踪评价 | |
| 心律失常 | 心源性猝死:危险度分层,植入式心脏除颤器获益的预测 |
| 遗传性心律失常综合征:无症状或表型阴性携带者和携带未知意义变异者的危险度分层 | |
| 心房颤动:消融/复律/抗心律失常药物的患者选择 | |
| 瓣膜病 | 瓣膜返流/狭窄:确定病变进展的风险,预测介入治疗的最佳时机,药物治疗的选择,疗效追踪评价 |
| 心内膜炎或器械感染:检测 | |
| 血管疾病 | 动脉粥样硬化:危险度分层 |
| 主动脉瘤:危险度分层,预测术后渗漏 | |
| 血栓形成和血栓栓塞:全身检测,慢性转归的确定 | |
| 灌注:高空间分辨率的绝对血流定量显像,灌注/血管造影融合显像 | |
| 外周动脉疾病:危险度分层,介入治疗获益的预测 |
传统核心脏病学检查方法主要包括心肌灌注显像(myocardial perfusion imaging, MPI)、存活心肌显像和平衡法放射性核素心血管造影。然而,由于分子显像技术的进步、替代诊断技术的出现以及不断涌现出的对现有冠状动脉疾病诊断和风险分层方法质疑的证据,心血管核医学技术的使用模式开始发生变化。心血管PET和SPECT显像在生理学及分子水平精准应用方面具有灵敏、通用和可定量等多种优势,这在PET和SPECT分子显像技术在临床上已常规用于心脏结节病和淀粉样变诊断上是显而易见的。此外,对神经、器械感染进行显像的可行性也已被证明,但其在患者管理中的具体作用仍有待确定。PET和SPECT在许多其他心血管中的应用仍处于临床前和临床研发的早期阶段,其是否能够成为主流临床应用,关键取决于其显像剂的物理、化学和生物学性能。
在接下来的2部分综述中,将选择性讨论一些新兴的显像剂,这些显像剂可能有助于解决心血管疾病中尚未解决的关键临床诊断问题。简单起见,本文按一般病理生物学过程进行阐述,不按特定疾病描述。本综述的第1部分回顾了与心血管显像剂开发相关的关键技术要点,以及用于灌注和神经显像的放射性显像剂的发展(表2);第2部分包括用于炎性反应、纤维化、血栓形成、钙化和心脏淀粉样变显像的新型放射性显像剂。
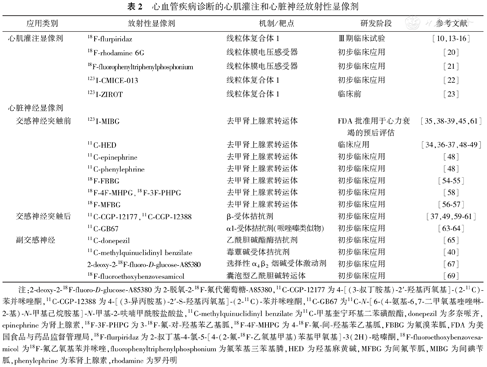
心血管疾病诊断的心肌灌注和心脏神经放射性显像剂
心血管疾病诊断的心肌灌注和心脏神经放射性显像剂
| 应用类别 | 放射性显像剂 | 机制/靶点 | 研发阶段 | 参考文献 |
|---|---|---|---|---|
| 心肌灌注显像剂 | 18F-flurpiridaz | 线粒体复合体1 | Ⅲ期临床试验 | [10,13-16] |
| 18F-rhodamine 6G | 线粒体膜电压感受器 | 初步临床应用 | [20] | |
| 18F-fluorophenyltriphenylphosphonium | 线粒体膜电压感受器 | 初步临床应用 | [21] | |
| 123I-CMICE-013 | 线粒体复合体1 | 初步临床应用 | [22] | |
| 123I-ZIROT | 线粒体复合体1 | 临床前 | [23] | |
| 心脏神经显像剂 | ||||
| 交感神经突触前 | 123I-MIBG | 去甲肾上腺素转运体 | FDA批准用于心力衰竭的预后评估 | [35,38-39,45,61] |
| 11C-HED | 去甲肾上腺素转运体 | 临床应用 | [34,36-37,48-49] | |
| 11C-epinephrine | 去甲肾上腺素转运体 | 初步临床应用 | [48] | |
| 11C-phenylephrine | 去甲肾上腺素转运体 | 初步临床应用 | [48] | |
| 18F-FBBG | 去甲肾上腺素转运体 | 初步临床应用 | [54-55] | |
| 18F-4F-MHPG,18F-3F-PHPG | 去甲肾上腺素转运体 | 初步临床应用 | [58] | |
| 18F-MFBG | 去甲肾上腺素转运体 | 初步临床应用 | [56-57] | |
| 交感神经突触后 | 11C-CGP-12177,11C-CGP-12388 | β-受体拮抗剂 | 初步临床应用 | [37,49,59-61] |
| 11C-GB67 | α1-受体拮抗剂(哌唑嗪类似物) | 初步临床应用 | [63-64] | |
| 副交感神经 | 11C-donepezil | 乙酰胆碱酯酶拮抗剂 | 初步临床应用 | [65] |
| 11C-methylquinuclidinyl benzilate | 毒蕈碱受体拮抗剂 | 初步临床应用 | [40] | |
| 2-deoxy-2-18F-fluoro-D-glucose-A85380 | 选择性α4β2烟碱受体激动剂 | 初步临床应用 | [67] | |
| 18F-fluoroethoxybenzovesamicol | 囊泡型乙酰胆碱转运体 | 初步临床应用 | [69] |
注:2-deoxy-2-18F-fluoro-D-glucose-A85380为2-脱氧-2-18F-氟代葡萄糖-A85380,11C-CGP-12177为4-[(3-叔丁胺基)-2′-羟基丙氧基]-(2-11C)-苯并咪唑酮,11C-CGP-12388为4-[(3-异丙胺基)-2′-S-羟基丙氧基]-(2-11C)-苯并咪唑酮,11C-GB67为11C-N-[6-(4-氨基-6,7-二甲氧基喹唑啉-2-基)-N-甲基己烷胺基]-N-甲基-2-呋喃甲酰胺盐酸盐,11C-methylquinuclidinyl benzilate为11C-甲基奎宁环基二苯磺酸酯,donepezil为多奈哌齐,epinephrine为肾上腺素,18F-3F-PHPG为3-18F-氟-对-羟基苯乙基胍,18F-4F-MHPG为4-18F-氟-间-羟基苯乙基胍,FBBG为氟溴苯胍,FDA为美国食品与药品监督管理局,18F-flurpiridaz为2-叔丁基-4-氯-5-[4-(2-氟-18F-乙氧基甲基)苯基甲氧基]-3(2H)-哒嗪酮,18F-fluoroethoxybenzovesamicol为18F-氟乙氧基苯并咪唑,fluorophenyltriphenylphosphonium为氟苯基三苯基膦,HED为羟基麻黄碱,MFBG为间氟苄胍,MIBG为间碘苄胍,phenylephrine为苯肾上腺素,rhodamine为罗丹明
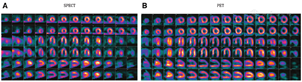
显像剂、仪器设备和图像分析等众多因素均影响核医学显像的数据结果。与SPECT相比,PET空间分辨率更高、定量技术更成熟,在心血管显像方面优势明显[2];而SPECT通常成本更低、临床应用更广泛,且近年来随着如心电呼吸门控和碲-锌-镉(cadmium-zinc-telluride, CZT)探测器[3,4,5]等SPECT技术的进展,SPECT和PET之间的差距逐步缩小。在心血管分子显像方面,SPECT相对于PET的1个潜在优势是其可进行多核素同时显像(图1)[4,6,7,8]。CZT SPECT相机比传统Anger相机空间和能量分辨率更高,能够实现多核素显像[5]。
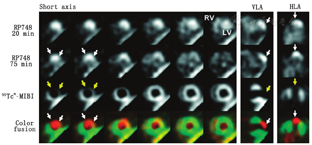

心脏作为体积较大的器官,PET和SPECT显像容易实现,但心脏的移动位移仍是挑战。血管体积小,显像困难,可通过CT或MRI融合显像得到解决,CT或MRI可提供解剖学定位,有助于校正部分容积效应。MPI这类依靠相对的放射性摄取进行评估的半定量技术,不适用于常见的热点显像,而改进定量方法更有利于心血管分子显像的临床应用。
显像剂的动力学性能决定采集方案并极大地影响数据质量。血液清除快、靶本比高,是大多数非血池显像的理想性能。对于灌注显像,理想的显像剂是靶器官组织提取率高和滞留时间长,而周围器官摄取少或洗脱快。对于分子显像,相对于背景本底的高水平特异性靶向结合对于获得有用的数据至关重要。放射性的摄取取决于显像剂如何在体内传输以及在靶器官的表达水平、结合亲和力,也给比较不同灌注水平的心肌摄取高低带来难度。与动力学建模所获得的局部血流灌注数据相结合,可能会提高分子显像技术的准确性。
放射性核素的化学和物理学性质同样会影响药物合成和图像采集方案,并影响数据质量(表3)。放射性核素的化学性质会影响其与有机显像剂分子的结合,或影响无机显像剂(如82Rb)的生物学摄取[9]。短半衰期的放射性核素非常适合药代动力学快、放射性计数率高的应用。更短的半衰期可减少患者和工作人员的辐射吸收剂量,也能提高显像效率。这一优势对灌注显像尤其突出,可最大程度地减少负荷与静息显像之间的时间间隔。但是短半衰期的放射性核素并不总是实用的,如放射性标记抗体的药代动力学比小分子慢,其与低水平表达分子的靶向结合可能需要数小时才能产生高质量信号;因此,使用抗体进行分子显像通常需要使用半衰期较长的放射性核素,如64Cu(半衰期12.7 h)或89Zr(半衰期78.4 h)。半衰期较长的放射性核素的使用方案更灵活,如配备现场发生器和回旋加速器的单位,半衰期较长的放射性核素有利于单位剂量的运输;但在工作量较低的单位,成本效益比并不高[10]。半衰期更长的放射性核素还扩大了给药前对显像剂进行化学修饰的选择。对于MPI,长半衰期放射性核素允许进行运动负荷试验[10],并且可能有利于一些如影像引导下的介入操作等非传统的应用[11]。然而,长半衰期放射性核素带来的更高辐射暴露量和工作中实际操作流程仍是限制其应用于心血管系统的主要因素,因为在心血管应用中,风险获益考虑与恶性肿瘤的显像可能不同。在PET显像中,正电子核素的能量会影响图像的分辨率。发出能量较低β射线的核素(如18F和64Cu)在组织中正电子射程较短,因此易于产生比发出高能正电子核素(如82Rb和68Ga)空间分辨率更高的图像[12]。在更易受部分容积效应影响的小目标(如血管壁)中,高分辨率显像的优势最大。PET相机硬件技术、运动校正有望改善图像分辨率,因此放射性核素正电子射程的影响可能变得更为显著。
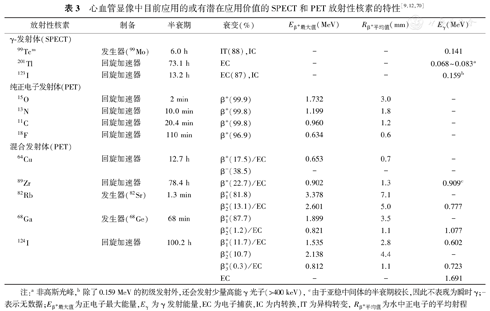
心血管显像中目前应用的或有潜在应用价值的SPECT和PET放射性核素的特性[9,12,70]
心血管显像中目前应用的或有潜在应用价值的SPECT和PET放射性核素的特性[9,12,70]
| 放射性核素 | 制备 | 半衰期 | 衰变(%) | Eβ+最大值(MeV) | Rβ+平均值(mm) | Eγ(MeV) | |
|---|---|---|---|---|---|---|---|
| γ-发射体(SPECT) | |||||||
| 99Tcm | 发生器(99Mo) | 6.0 h | IT(88),IC | - | - | 0.141 | |
| 201Tl | 回旋加速器 | 73.1 h | EC | - | - | 0.068~0.083a | |
| 123I | 回旋加速器 | 13.2 h | EC(87),IC | - | - | 0.159b | |
| 纯正电子发射体(PET) | |||||||
| 15O | 回旋加速器 | 2 min | β+(99.9) | 1.732 | 3.0 | - | |
| 13N | 回旋加速器 | 10.0 min | β+(99.8) | 1.199 | 1.8 | - | |
| 11C | 回旋加速器 | 20.4 min | β+(99.8) | 0.960 | 1.2 | - | |
| 18F | 回旋加速器 | 110 min | β+(96.9) | 0.634 | 0.6 | - | |
| 混合发射体(PET) | |||||||
| 64Cu | 回旋加速器 | 12.7 h | β+ (17.5)/EC | 0.653 | 0.7 | - | |
| β- (38.5) | - | - | - | ||||
| 89Zr | 回旋加速器 | 78.4 h | β+ (22.7)/EC | 0.902 | 1.3 | 0.909c | |
| 82Rb | 发生器(82Sr) | 1.3 min | β1+ (81.8) | 3.378 | 7.1 | - | |
| β2+ (13.1)/EC | 2.601 | 5.0 | 0.777 | ||||
| 68Ga | 发生器(68Ge) | 68 min | β1+ (87.7) | 1.899 | 3.5 | - | |
| β2+ (1.2)/EC | 0.821 | 1.1 | 1.077 | ||||
| 124I | 回旋加速器 | 100.2 h | β1+ (11.7)/EC | 1.535 | 2.8 | 0.602 | |
| β2+ (10.7) | 2.138 | 4.4 | - | ||||
| β3+ (0.3)/EC | 0.812 | 1.1 | 0.723 | ||||
| EC | - | - | 1.691 | ||||
注:a非高斯光峰,b除了0.159 MeV的初级发射外,还会发射少量高能γ光子(>400 keV), c由于亚稳中间体的半衰期较长,因此不表现为瞬时γ;-表示无数据;Eβ+最大值为正电子最大能量,Eγ为γ发射能量,EC为电子捕获,IC为内转换,IT为异构转变,Rβ+平均值为水中正电子的平均射程
放射性核素的衰变模式也影响其显像特性。PET正电子核素(如11C、13N、15O和18F)是纯β+发射体,不会直接产生γ或β-射线[9,12]。传统而言,非纯PET放射性核素(如68Ga、82Rb和124I)产生的瞬时γ辐射一直被认为是不利的,因为其增加辐射暴露并且产生降低图像质量的虚假符合[12]。然而,在具有其他有利特性的放射性核素中,即使存在较小水平的瞬时γ辐射也是可以接受的,且可以通过校正来潜在地改善图像质量[12];此外,发出瞬时γ辐射的放射性核素发射信号特殊,可用于PET多核素显像[12]。
PET显像具有固有优势,而目前应用于临床的灌注显像剂[如99Tcm-甲氧基异丁基异腈(methoxyisobutylisonitrile, MIBI)、99Tcm-替曲膦(tetrofosmin)、82Rb和13N-NH3]存在局限性[13],18F标记的灌注显像剂引起了广泛的研究兴趣。18F(0.6 mm;在水中)比82Rb(7.1 mm)和13N(1.8 mm)的平均正电子射程更短,因此空间分辨率更高,更具有优势;此外,18F的半衰期(109 min)比82Rb(76 s)和13N(10 min)要长。虽然从剂量学的角度来看,这种特性可能不利,在静息与负荷显像之间需要有更长的延迟,但其提供了几个明显的优势。首先,18F的长半衰期允许单位剂量传递;此外,18F的较长半衰期既可以进行运动负荷也可以进行药物负荷的显像方案,而且可能在出现运动位移或心外显像剂摄取的情况下进行重复图像采集。
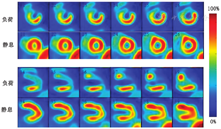
2-叔丁基-4-氯-5-[4-(2-氟-18F-乙氧基甲基)苯基甲氧基]-3(2H)-哒嗪酮(18F-flurpiridaz)是一种与线粒体复合体1结合的灌注显像剂,目前正在进行临床试验[10,13,14,15,16,17]。除上述特征外,在血流量较高的情况下,18F-flurpirdaz比传统的PET和SPECT灌注显像剂的心肌提取率更高,因此其摄取在心肌血流生理范围内线性偏差较小(图2)[18]。这种特性有望提高缺血检测的灵敏度,有利于血流定量。在最近的1项Ⅲ期临床试验中,与99Tcm-SPECT相比,18F-flurpiridaz PET对检测阻塞性冠状动脉疾病(有创冠状动脉造影血管管腔狭窄>50%)的灵敏度更高(71.9%和53.7%;P<0.001),但特异性未达到预设的非劣效标准(76.2%和86.6%,P>0.05)[10]。总体而言,与99Tcm-SPECT MPI相比,18F-flurpiridaz PET显示出对阻塞性冠状动脉疾病更好的区分能力(AUC:0.78和0.72;P<0.001)。即便辐射剂量更低[(6.1±0.4)和(13.4±3.2) mSv;P<0.001],18F-flurpiridaz也表现出比99Tcm-SPECT更好的图像质量[10]。值得注意的是,该比较仅限于心肌滞留图像,不包括18F-flurpiridaz心肌血流定量[19]。同样值得注意的是,该研究未将18F-flurpiridaz与其他PET MPI显像剂进行比较,毕竟一些差异可能来自于SPECT和PET技术之间的固有差异,如SPECT图像缺乏衰减校正等。在对比大小心腔的后续诊断试验分析中,该研究进一步说明了18F-flurpiridaz PET空间分辨率的影响。无论心腔大小,18F-flurpiridaz PET缺血诊断效能相似(AUC:0.79和0.77,P=0.490),但99Tcm-SPECT对于小心腔的诊断效能降低(AUC:0.75和0.67,P=0.030),这可能是由于SPECT较低的空间分辨率所致(图3)[17]。其他正在人体初步鉴定和评估的18F标记的PET灌注显像剂还包括18F-罗丹明(rhodamine) 6G(NCT04528758)[20]和18F-氟苯基三苯基膦(NCT02252783)[21]。
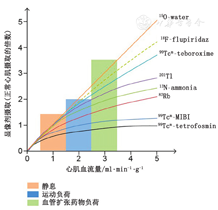


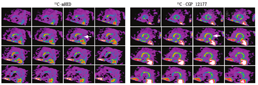
几种新的SPECT灌注显像剂也在开发中,包括123I标记的鱼藤酮衍生物123I-CMICE-013[22]和123I-ZIROT[23]。这些药物与18F-flurpiridaz类似,其靶向结合线粒体复合物1,通过在更大范围的生理血流量内心肌提取高、显像和辐射剂量性能良好来解决现有SPECT显像剂的缺点。此外,由于这些药物由123I标记而不是99Tcm,因此不需要担心99Tcm供应稳定性的问题。在对实验猪进行的初步临床前研究中,当血流量超过1.5 ml·min-1·g-1时,123I-CMICE-013显示出比常规SPECT显像剂201Tl、99Tcm-tetrofosmin和99Tcm-MIBI更高的心肌摄取(P<0.05)(图4)[22]。同样,当血流量大于1.5 ml·min-1·g-1时,123I-ZIROT显示心肌摄取高于201Tl和99Tcm-MIBI,摄取的线性关系延伸至更高的血流量[23]。123I-CMICE-013 Ⅰ期临床试验近期已完成(NCT01558362)。基于123I标记的灌注显像剂存在1个潜在的技术问题,即123I除了在主能峰159 keV外,还会发射小比例的高能光子(>400 keV),这些高能光子会穿透常规的低能-高分辨准直器而降低图像质量并影响定量分析。更厚的准直器可以用于123I SPECT显像,减少能够穿透准直器的光子,但同时会导致空间分辨率下降[24]。

尽管更多地使用PET进行灌注显像成为趋势,但SPECT显像剂的日益改进仍可能对临床产生重大影响。因为SPECT MPI成本低、普及性广,仍是未来几年临床最常用的灌注显像方式。此外,随着诸如衰减校正[25]和CZT晶体探测器[5]等技术的进步,现代SPECT显像系统比上一代设备的图像质量更佳、辐射剂量学性能更优。随着仪器设备的进步和心肌摄取特性更好的灌注显像剂的开发,基于SPECT的血流定量技术用于临床成为可能[26]。
这些新灌注显像剂的另一重要潜在应用和增长领域是骨骼肌灌注显像。外周动脉疾病影响全世界2亿多人[27],对临床评估和治疗构成重大挑战。利用传统显像剂的SPECT和PET灌注显像已被用于对外周动脉疾病辅助诊断、风险分层和疗效评估[28,29,30,31]。尽管目前尚不是外周动脉疾病管理的临床主流,放射性显像技术可提供补充信息,以更好地评估急性肢体缺血的风险和伤口愈合的可能性,以及指导血运重建的最佳方法。高空间分辨率、可定量、适于运动负荷方案的特点使得新型18F标记的显像剂应用于外周灌注显像具有吸引力。
心肌的神经信号传导通过调节电-机械作用、血管反应性、代谢和重塑,对维持心脏功能及稳态发挥关键作用[32]。神经信号通过自主神经系统的交感和副交感神经分支抵达心脏。心脏的交感神经激活主要是兴奋性作用,包括正性肌力和正向变时性[32]。节前交感神经元起源于脊髓,并将神经信号传输至支配心房、心室和冠状动脉的节后纤维。在刺激下,这些节后神经元的末端将储存的去甲肾上腺素释放到突触间隙中。交感神经的作用是通过去甲肾上腺素与心脏组织中突触后的α-和β-肾上腺素能受体结合来实现的。相反,副交感神经的激活往往是抑制性的,具有负向变时性,以及程度相对轻的负性肌力作用[32]。副交感神经信号通过迷走神经从延髓传递至心脏。节后迷走传出神经的末梢集中在心房和传导束,受刺激时释放乙酰胆碱。信号传递是通过乙酰胆碱与毒蕈碱型和烟碱型受体相结合而实现的。毒蕈碱型乙酰胆碱受体存在于心肌细胞和心内神经节中,受刺激时对心肌细胞起负性肌力和负向变时作用[33]。烟碱型乙酰胆碱受体存在于心肌和血管系统中,作用尚不明确[33]。除了传出性交感神经和副交感神经支配心脏外,还有许多用于感官和调节心脏反射的传入性交感神经和迷走神经纤维。
心脏神经活动的变化在心律失常、心肌梗死以及与各类型心肌病有关的心衰的病理生理学中起重要作用[34,35,36,37,38,39,40,41,42]。心衰时,交感神经活动长期慢性增加,导致突触前去甲肾上腺素再摄取转运体和突触后β-肾上腺素能受体的脱敏或下调,致使进行性的功能障碍、心脏重塑,成为心律失常发生的作用底物[43]。用于心脏神经支配各个方面的靶向性无创显像的放射性显像剂的发展,提高了对复杂心血管疾病的认识,有助于治疗的指导。该领域最近的工作侧重于开发新的显像剂、改进图像采集和分析技术,以扩展诊断能力并提供更准确、可重复的评价方法[44]。
1.突触前交感神经显像。123I-间碘苄胍(metaiodobenzylguanidine, MIBG)靶向结合去甲肾上腺素转运体,是第1种在心脏被广泛研究的神经显像剂,已被美国食品与药品监督管理局批准用于心脏显像。心脏123I-MIBG摄取可通过平面显像和SPECT/CT显像2种方式进行,但传统上还是靠平面显像中的心脏纵隔比进行量化评估。心肌123I-MIBG摄取降低和多种心脏病相关,具有临床预测价值。在对射血分数减低的心衰患者进行的AdreView心肌显像用于心衰风险评估(AdreView Myocardial Imaging for Risk Evaluation in Heart Failure, ADMIRE-HF)试验中,123I-MIBG心脏纵隔比大于1.6可预测心衰进展[风险比(hazard ratio, HR)=0.49,P=0.002]、严重心律失常事件(HR=0.37,P=0.020)、心源性死亡(HR=0.14,P=0.006)等不良结局的减少[35]。尽管123I-MIBG因仅能进行整体、半定量评估而受到质疑[45],但随着如心电呼吸门控、CZT晶体探测器等SPECT技术的进步,空间分辨率和灵敏度提高,又重新引起了研究者的广泛兴趣。最近由于技术进步而产生新应用,包括左心房神经节丛定位,可有助于开发更有效的导管消融治疗心房颤动的方法[39],以及详细评估缺血性心脏病患者神经支配-灌注不匹配情况,为了解患者发生潜在致死性室性心律失常的风险提供有价值的信息[38]。
尽管123I-MIBG SPECT显像的实用性已被证实,但PET神经显像因其显像剂种类更多、灵敏度和时间空间分辨率更高以及更成熟的定量方法而广受欢迎[46,47]。PET突触前交感神经显像包括几种主要靶向去甲肾上腺素转运体的显像剂。最早的去甲肾上腺素转运体PET显像剂是11C标记的药物,包括11C-羟基麻黄碱(hydroxyephedrine, HED)、11C-肾上腺素和11C-苯肾上腺素[48];在许多心脏疾病中(包括心衰、缺血性心脏病和心律失常),已证实这些显像剂的突触前摄取都会发生变化[37,48,49,50]。
11C-HED是去甲肾上腺素的非代谢类似物,是研究最广泛的11C标记的去甲肾上腺素转运体显像剂。研究证实,在急性心肌梗死[42]、缺血性[34,37,49,51]和非缺血性心肌病[51,52]、肥厚型心肌病[36]以及射血分数保留的心衰[53]中会发生与心肌去神经化相应的11C-HED心肌滞留减少。在对缺血性心肌病患者进行的PET预测心律失常事件(prediction of arrhythmic events with PET, PAREPET)研究中,11C-HED PET显像结果表明,发生心脏骤停的患者比没有发生心脏骤停的患者有更大范围的去神经化心肌[(33±10)%和(26±11)%;P=0.001][34]。有趣的是,心脏骤停患者并没有更多的梗死心肌[(22±7)%和(19±9)%;P=0.18]或更低的左心室射血分数[(24±8)%和(28±9)%;P=0.053]。此外,对射血分数保留的心衰患者进行的11C-HED PET研究表明,11C-HED整体的滞留指数低是晚期舒张功能障碍(2级和3级)存在的独立影响因素[比值比(odds ratio, OR)=0.66,P=0.044][53]。尽管11C标记的显像剂有临床价值,但其半衰期相对较短(20 min),需配备现场回旋加速器,在临床普及应用受限。
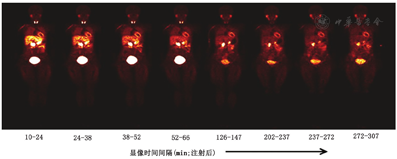
由于11C标记的显像剂固有的局限性,以去甲肾上腺素转运体为靶点的18F标记的显像剂引起了研究者们的极大兴趣。18F-氟溴苯胍(flubrobenguane, FBBG;也称为18F-LMI1195)是1种结构与123I-MIBG相似的苄基胍[54,55]。18F-FBBG的首次人体研究显示了良好的显像特征,包括血液本底清除快、肝肺清除率适中、心肌摄取稳定,4 h心/肝比值大于2(图5)[55]。后续临床研究的初步结果表明,18F-FBBG计算所得的心脏交感神经支配与11C-HED结果相似,且其动力学性能更优[54]。鉴于18F-FBBG能够在局部水平定量心脏神经,于是开展了PAREPET Ⅱ试验,用以确定缺血性心肌病患者发生心源性猝死的风险(NCT03493516)。除18F-FBBG外,还有其他几种正在研发当中的18F标记的去甲肾上腺素转运体显像剂,其中18F-间氟苄胍(meta-fluorobenzylguanidine, MFBG)是另一种有潜力应用于心脏显像的苄基胍,在最初的临床评估中表现出心肌摄取快且稳定、血池清除快的特点(NCT02348749)[56,57]。4-18F-氟-间-羟基苯乙基胍及其结构异构体3-18F-氟-对-羟基-苯乙基胍是专门设计应用于缓慢神经元摄取和不可逆的突触前滞留的苯乙基胍,有利于提高检测准确性并能实现定量[58]。这些显像剂的人体首次试验结果均显示出图像质量高、可重复性好、能够对局部心脏交感神经密度水平进行定量的特点(NCT02669563)[58]。

2.突触后交感神经显像。4-[(3-叔丁胺基)-2′-羟基丙氧基]-(2-11C)-苯并咪唑酮[4-(3-tert-butylamino-2-hydroxypropoxy)-2H-benzimidazol-2-11C-one,11C-CGP-12177][37,49]和4-[(3-异丙胺基)-2′-S-羟基丙氧基]-(2-11C)-苯并咪唑酮[(S)-4-(3-(2′-11C-isopropylamino)-2-hydroxypropoxy)-2H-benzimidazol-2-one,11C-CGP-12388][59,60]是已经用于突触后肾上腺素能显像的非选择性β-受体拮抗剂。11C-CGP-12177已与突触前交感神经显像剂(如123I-MIBG[61]和11C-HED[36,37,49])相对应,用以阐明突触前和突触后交感神经功能之间的复杂关系(图6)。研究表明,在各种类型的心肌病患者中,突触前和突触后交感神经功能均发生了显著的变化,心衰时交感神经张力长期慢性上调,突触前儿茶酚胺摄取减少或洗脱增加,并导致突触后β-肾上腺素能受体下调[61]。虽然对α-肾上腺素能信号通路的研究相对较少,但其在心血管生理学中也同样起着重要作用[62],并且是治疗和分子显像中值得研究的靶点。11C-标记的N-[6-(4-氨基-6,7-二甲氧基喹唑啉-2-基)-N-甲基己烷胺基]-N-甲基-2-呋喃甲酰胺盐酸盐[N-(6-((4-amino-6,7-dimethoxyquinazolin-2-yl)-methylamino)hexyl)-N-methylfuran-2-carboxamide;hydrochloride, GB67]是一种哌唑嗪类似物和α1-肾上腺素能拮抗剂,临床前和初步的人体研究显示其能够被心肌摄取,但临床作用尚未确定[63,64]。

3.副交感神经显像。副交感神经支配在心血管生理学中起着重要作用,但心脏副交感神经显像技术仍然远不如交感神经显像技术发达。11C-多奈哌齐是一种可逆的、非竞争性的乙酰胆碱酯酶拮抗剂,已作为心脏副交感神经支配的潜在标志物进行了在体研究[65],但由于多奈哌齐与心脏中丰富的σ1受体结合亲和力显著而使其应用受阻[66]。11C-甲基奎宁环基二苯磺酸酯是1种特异的毒蕈碱型乙酰胆碱受体的疏水性拮抗剂,研究显示其在扩张型心肌病患者的摄取明显高于健康对照组[(34.5±8.9)和(25.0±7.7)nmol/L;P<0.005][40]。此外,2-脱氧-2-18F-氟代葡萄糖-A85380是α4β2烟碱型受体选择性激动剂,为中枢神经系统显像而开发,已在人体上证明了心脏[67]和血管[68]烟碱受体显像的可行性。最近,有研究把囊泡乙酰胆碱转运体作为心血管胆碱能活性放射性配体显像的潜在靶点。18F-氟乙氧基苯并咪唑是囊泡乙酰胆碱转运体的非竞争性抑制剂,与11C-多奈哌齐不同,其对σ1受体的亲和力较低[69]。18F-氟乙氧基苯并咪唑已在中枢神经系统中进行了深入研究,近期研究显示了其用于心脏定量显像的良好性能[69]。
总体而言,尽管有一些有趣的临床前和临床研究发现,但神经显像剂迄今尚未在心血管疾病中得到广泛应用。技术、临床和经济多种因素可能会使神经显像技术进展缓慢,不能完全阐明其临床作用以及对现有显像技术的潜在增益价值。鉴于PET相对于SPECT具有优势,心脏神经显像领域可能会继续转向定量PET技术,而且18F标记的显像剂尤其具有优势。这将需要18F标记的显像剂和相关定量分析技术的进一步发展。
心血管显像正在发展,以应对全系统的分子表征个体化治疗的趋势。开发PET和SPECT显像的新型放射性显像剂是解决相关问题的关键。总体而言,尽管SPECT成本较低、普及性高,近来由于技术改进后的众多益处而仍得到高度使用,但PET有利于显像、可定量的特性,在心血管疾病中更多地使用PET已成为趋势。本综述的第1部分讨论了用于改善心脏神经活性、心肌和外周灌注显像特性的放射性显像剂的开发;第2部分将详细概述用于心血管炎性反应、纤维化、血栓形成、钙化和心脏淀粉样变显像的新型放射性显像剂。本文参考文献具体见http://jnm.snmjournals.org。


























