
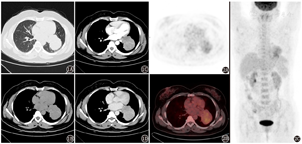
患者女,47岁,因"体格检查发现肺占位1个月余"就诊。CT(图1)示:左肺门旁类圆形肿块,内见"树枝"状钙化,增强后轻度略不均匀强化。实验室检查(括号内为正常参考值):糖类抗原(carbohydrate antigen, CA)125 109.2(0~35.0) kU/L,余指标未见明显异常。头体部18F-FDG PET/CT(德国Siemens Biograph Sensation 16型)显像(图2)示:左肺下叶近肺门旁见一肿块影,内伴线样钙化,大小约55 mm×74 mm,跨左肺斜裂生长,部分累及左肺上叶,FDG摄取中度增高,SUVmax为4.4;左肺门淋巴结肿大,FDG摄取未见增高。支气管镜示:左上舌支开口狭窄;左下基底支开口黏膜浸润隆起,开口狭窄。为明确诊断,行超声支气管镜检查,在左下基底支开口见一肿物,于肿物处行超声内镜引导下的经支气管针吸活组织检查术。病理示:光学显微镜下见黏膜组织内团巢样细胞生长、极破碎小组织内亦见少量神经内分泌细胞团巢;免疫组织化学检查:P40(-),细胞角蛋白(cytokeratin, CK)7(-),甲状腺转录因子-1 (thyroid transcription factor-1, TTF-1;-),新天冬氨酸蛋白酶A(Napsin A;-),CK5/6(-), Ventana(-),CD56(+),突触素(synaptophysin, Syn;-),嗜铬粒蛋白A (chromogranin A, CgA;-),细胞增殖核抗原Ki-67(<1%),诊断:(左下基底开口穿刺标本)弥漫型神经内分泌细胞增生或低级别神经内分泌肿瘤(类癌可能)。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,47岁,因"体格检查发现肺占位1个月余"就诊。CT(图1)示:左肺门旁类圆形肿块,内见"树枝"状钙化,增强后轻度略不均匀强化。实验室检查(括号内为正常参考值):糖类抗原(carbohydrate antigen, CA)125 109.2(0~35.0) kU/L,余指标未见明显异常。头体部18F-FDG PET/CT(德国Siemens Biograph Sensation 16型)显像(图2)示:左肺下叶近肺门旁见一肿块影,内伴线样钙化,大小约55 mm×74 mm,跨左肺斜裂生长,部分累及左肺上叶,FDG摄取中度增高,SUVmax为4.4;左肺门淋巴结肿大,FDG摄取未见增高。支气管镜示:左上舌支开口狭窄;左下基底支开口黏膜浸润隆起,开口狭窄。为明确诊断,行超声支气管镜检查,在左下基底支开口见一肿物,于肿物处行超声内镜引导下的经支气管针吸活组织检查术。病理示:光学显微镜下见黏膜组织内团巢样细胞生长、极破碎小组织内亦见少量神经内分泌细胞团巢;免疫组织化学检查:P40(-),细胞角蛋白(cytokeratin, CK)7(-),甲状腺转录因子-1 (thyroid transcription factor-1, TTF-1;-),新天冬氨酸蛋白酶A(Napsin A;-),CK5/6(-), Ventana(-),CD56(+),突触素(synaptophysin, Syn;-),嗜铬粒蛋白A (chromogranin A, CgA;-),细胞增殖核抗原Ki-67(<1%),诊断:(左下基底开口穿刺标本)弥漫型神经内分泌细胞增生或低级别神经内分泌肿瘤(类癌可能)。

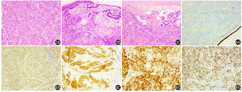
综合各项检查后行手术治疗,术中探查显示肿块位于左下肺,大小约60 mm×80 mm,质硬,部分侵犯左上肺舌段肺组织;纵隔淋巴结多发肿大。术后常规病理示:光学显微镜下见肿瘤细胞呈梭形,束状、漩涡样排列,侵犯支气管壁(图3);免疫组织化学检查:广谱角蛋白[CK(pan);-](图4A),Ki-67(5%~10%;+),CD34(血管+),S-100(-),上皮膜抗原(epithelial membrane antigen, EMA;+;图4B),D2-40(+;图4C),CgA(-),Syn(-),生长抑素受体2(somatostatin receptor 2, SSTR2;+;图4D),P53(散在弱+),胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP;-),孕激素受体(progestogen receptor, PR;+;图4E),信号转导及转录激活蛋白6(signal transducer and activator of transcription 6, STAT6;-),结蛋白(Desmin;-),CD117(-),SOX10(-),SS18(BA)荧光原位杂交(fluorescence in situ hybridization, FISH;-),CD10(-),诊断为脑膜瘤,无淋巴结转移。PET/CT及MR显像提示中枢系统未发现脑膜瘤,遂诊断为肺原发性脑膜瘤(primary pulmonary meningioma, PPM)。术后半年随访未见复发。

PPM属于肺内异位脑膜瘤,临床罕见[1],其发病机制尚不清楚,组织学来源可能是沿颅神经鞘分布的蛛网膜细胞发生颅外种植或蛛网膜细胞的异位胚胎巢发生增殖[2]。2015年WHO胸部肿瘤分类(第4版)中将PPM归类为异位脑膜瘤[3],自1982年Kemnitz等[4]首次报道后,现国内外文献报道近60例,其中国内报道不足20例[5]。
目前认为PPM女性发病偏多,40~60岁为好发年龄,多数无临床症状,少数因瘤体较大出现咳嗽,或累犯邻近血管引起咯血。文献报道PPM多为肺外周实性孤立性结节,部分为磨玻璃密度结节或钙化结节[6],少数为双肺多发结节[7];与中枢神经系统脑膜瘤明显强化不同,PPM表现为不同形式的强化[8]。国内外仅报道了10例有18F-FDG PET/CT影像资料的PPM病例,包括14枚病灶(2枚病灶2例,3枚病灶1例,1例双肺多发结节但仅1枚明确为PPM)[9]。病灶大小为9.6~60 mm,摄取值从无增高至SUVmax12.9。PPM一般为良性肿瘤,仅Cimini等[10]报道了1枚病灶为恶性,大小为12 mm,SUVmax为2.46,尚不能表明FDG摄取与PPM大小及良恶性的关系。PPM多表现为实性结节或肿块,密度均匀,边界光滑,FDG分布均匀;病灶可表现为中央区摄取较高,与其他较大肺内肿块出现中央坏死外周实性成分FDG摄取较高不同,这可能与其恶性程度较低、增殖缓慢且速度不一、血供分布不均有关。本例患者为47岁女性,体格检查发现肺占位,表现为近肺门的类圆形肿块,跨叶生长,内见"树枝"状钙化,大小约60 mm×80 mm,呈轻度略不均匀强化,FDG摄取中度增高,SUVmax为4.4。
PPM的18F-FDG PET/CT表现尚缺乏特征性,需与其他肺内肿瘤鉴别:(1)肺癌,常表现为有空泡征、分叶征、脐凹征、毛刺征、支气管截断征、血管集束征等恶性征象的病灶,较大者可见液化坏死或偏心厚壁空洞,FDG摄取增高明显,中央坏死区摄取较低,纵隔及肺门淋巴结肿大伴高FDG摄取,PET/CT还可显示远处转移灶;(2)炎性肌纤维母细胞瘤,多表现为胸膜下圆形或不规则肿瘤,密度均匀,可有桃尖征、平直征、边缘多发空泡征等特征性表现,FDG摄取较高[11];(3)转移瘤,常双肺多发,需与双肺多发性脑膜瘤鉴别,PPM代谢较低,另外PET/CT可显示原发灶,且肺内转移灶与原发灶代谢程度相关;(4)肺母细胞瘤,肺外周单发较大肿块,出血坏死常见,FDG摄取不均匀增高。本例最终诊断依靠病理学检查,光学显微镜下见束状、漩涡样排列的梭形细胞,免疫组织化学检查中EMA阳性,诊断为脑膜瘤,头体部18F-FDG PET/CT除外中枢神经系统脑膜瘤存在,临床诊断为PPM[12]。
综上,18F-FDG PET/CT在诊断缺乏恶性征象,无坏死、无空洞的肺内单发肿块时,需考虑较罕见的PPM的可能。
所有作者声明无利益冲突


























