
患者男,31岁,因糖类抗原(carbohydrate antigen, CA) 19-9进行性升高7个月余入院。入院后查CA19-9达117.3(正常参考值:0~37) kU/L,电子胃镜示:萎缩性胃炎C1(非活动性)。电子肠镜检查示:阑尾开口隆起性病变,表面充血水肿,考虑炎性改变;全腹增强CT(图1A,图1B)示阑尾壁弥漫性强化(平均CT值95 HU)。现患者偶感腹胀,大小便正常,半年内体质量减轻约3 kg。腹部体格检查未及明显阳性体征。患者既往2015年4月曾因右下腹剧烈疼痛就诊于当地医院,诊断为阑尾炎,对症治疗后症状缓解。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,31岁,因糖类抗原(carbohydrate antigen, CA) 19-9进行性升高7个月余入院。入院后查CA19-9达117.3(正常参考值:0~37) kU/L,电子胃镜示:萎缩性胃炎C1(非活动性)。电子肠镜检查示:阑尾开口隆起性病变,表面充血水肿,考虑炎性改变;全腹增强CT(图1A,图1B)示阑尾壁弥漫性强化(平均CT值95 HU)。现患者偶感腹胀,大小便正常,半年内体质量减轻约3 kg。腹部体格检查未及明显阳性体征。患者既往2015年4月曾因右下腹剧烈疼痛就诊于当地医院,诊断为阑尾炎,对症治疗后症状缓解。
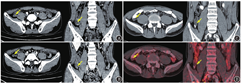

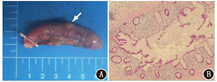
为排除肿瘤行18F-FDG(放化纯>95%)PET/CT(德国Siemens Biograph TruePoint 64型)显像,结果(图1C、图1D)示:阑尾FDG摄取未见异常增高,SUVmax为1.08,同机CT示阑尾呈囊柱状增大(大小为6.2 cm×1.3 cm×1.1 cm),阑尾壁弥漫性不均增厚(最厚达0.4 cm),阑尾腔内充满低密度黏液(平均CT值10 HU);口服体积分数为2%的泛影葡胺1 000 ml后2 h延迟显像:阑尾SUVmax升高至1.21,阑尾腔内始终未见对比剂填充。考虑:(低代谢)阑尾黏液性肿瘤(appendiceal mucinous neoplasm, AMN)。患者遂转入普外科,于全身麻醉下行腹腔镜阑尾切除术。术后病理示:大体(图2A):阑尾长6 cm,最大径1.0~1.2 cm,阑尾中部表面见一囊性半球形隆起,最大径0.7 cm,切面阑尾腔轻度扩张,腔内充满黏液;光学显微镜下(图2B):阑尾局灶固有肌壁黏液变性,黏膜固有层萎缩,腺体迂曲呈"锯齿"状,细胞核轻度增大,腔内可见黏液。诊断为阑尾低级别黏液性肿瘤(low-grade appendiceal mucinous neoplasm, LAMN)。

LAMN 2016年被腹膜表面肿瘤学国际协助组定义为独立疾病[1],是1种罕见的类似腺瘤的低级别、生物学行为不清、未定或交界型肿瘤,生长缓慢。因肿瘤中含大量黏液,不嗜FDG,易漏诊。
部分LAMN因肿瘤细胞穿透阑尾壁并将黏液排入腹腔形成腹膜假黏液瘤(pseudomyxoma peritonei, PMP)[2],但PMP患者预后较差,5年生存率为53%~75%,10年生存率为10%~32%[3,4]。有学者对LAMN产生PMP的风险进行分型:Ⅰ型为伴有黏液上皮增生的非膨胀型阑尾,或伴有发育不良黏液上皮的膨胀型阑尾;Ⅱ型为黏液突出进入阑尾壁,穿透阑尾壁或沿阑尾外表面出现阑尾外黏液,与Ⅰ型LAMN患者相比,Ⅱ型LAMN患者出现PMP的风险更高[5]。本例患者阑尾壁中部表面有一囊性半球形隆起,病变已浸及固有肌层,属于LAMN Ⅱ型。
LAMN患者大多无典型临床症状,部分可表现为右侧髂窝疼痛(疼痛程度和性质类似阑尾炎)、右侧髂窝部肿块、胃肠道出血或肠梗阻等[6],其他症状包括食欲减退、恶心、呕吐、体质量减轻和排便习惯改变等,因此许多局限于阑尾的LAMN经常被忽视并误诊为阑尾炎(本例患者就是由于临床认识不足而误诊为阑尾炎)。肿瘤标志物癌胚抗原(carcinoembryonic antigen, CEA)和CA19-9的水平对于LAMN诊断具有提示意义。国外学者研究表明,67%的AMN患者有不同程度的CEA和CA19-9升高[7];大多数晚期AMN患者的肿瘤标志物升高程度与疗效相关,且高水平也预示着更高的复发或死亡风险[8]。因此,当慢性阑尾炎患者CEA和CA19-9升高时,需要考虑AMN的可能。
LAMN在CT及MR上通常表现为"葫芦"状或管状囊性肿块,囊壁不均匀增厚,内囊壁粗糙,部分囊壁可见黏液及钙化。动脉期囊壁往往轻度环状强化,门静脉期呈进行性强化,部分病变可见微小的壁结节强化[2]。MRI对于判断LAMN腔内黏液栓(黏液在T2加权像上常呈高信号,T1加权像信号强度取决于黏蛋白含量,但通常是低信号)位置(位于阑尾腔内或已突破肌层、浆膜外)及是否伴有PMP具有特异性[4,9]。
虽然LAMN的18F-FDG PET/CT代谢程度不高,但作为全身性检查,18F-FDG PET/CT可提供更精准的TNM分期。LAMN最常见的转移路径是瘤细胞浸透阑尾壁形成PMP,很少通过淋巴或血行扩散[9]。18F-FDG PET/CT对于PMP的诊断价值在于其可预测PMP的无进展生存(progression-free survival, PFS)期。Dubreuil等[10]研究发现,将SUVmax的参考值阈值设定为2.02,即可预测PFS,术前18F-FDG PET/CT的SUVmax是PMP患者PFS的独立预测因素。Hotta等[11]将SUVmax的参考值阈值设定为2.7,使用18F-FDG PET/CT的腹膜癌指数预测PMP患者的PFS比单纯使用SUVmax效果更好。而李敬等[12]发现,18F-FDG PET/CT不仅可以对AMN进行分级,还可较精准地显示肿瘤转移路径及PMP的18F-FDG代谢水平。
综上,LAMN作为不嗜FDG的低代谢肿瘤,诊断主要依赖于临床症状及同机CT的影像学表现,当患者有慢性阑尾炎病史,CEA或CA19-9进行性升高,CT表现为局灶性囊性肿块,囊壁增厚且环周强化时,即使阑尾FDG代谢未见明显升高,依据LAMN典型的影像学特征,要考虑LAMN可能,本例患者即是基于此种诊断思维而做出的正确诊断。
所有作者声明无利益冲突


























