
患者男,35岁,腹胀、腹泻1个月余,双下肢水肿3周。2022年9月12日,患者因进食炒面后出现腹胀、腹泻,每天5~6次黄色水样便,100~200 ml/次,有油脂漂浮,伴恶心、呕吐,呕吐物为胃内容物,伴乏力、食欲不振。予抗生素治疗1周后症状部分缓解,每天2~3次黄色成形便,仍有腹胀和食欲不振。2022年9月30日,患者发现双下肢轻度可凹陷性水肿。外院查血常规:WBC 11.7(括号内为正常参考值范围,下同;4.0~10.0)×109/L,中性粒细胞百分比83.6%(50%~70%),淋巴细胞百分比10%(20%~40%);尿常规、便常规、24 h尿蛋白正常;血白蛋白16(35~50) g/L;免疫球蛋白(immunoglobulin, Ig)A正常,IgG 2.5(7.0~16.6) g/L;自身抗体正常;HBV-DNA:3 130(<20) U/ml。腹股沟淋巴结超声:双侧腹股沟见多发淋巴结。胸腹部CT:双侧胸腔积液,左侧为著;腹腔积液。腹腔积液常规及病理均未见明显异常。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,35岁,腹胀、腹泻1个月余,双下肢水肿3周。2022年9月12日,患者因进食炒面后出现腹胀、腹泻,每天5~6次黄色水样便,100~200 ml/次,有油脂漂浮,伴恶心、呕吐,呕吐物为胃内容物,伴乏力、食欲不振。予抗生素治疗1周后症状部分缓解,每天2~3次黄色成形便,仍有腹胀和食欲不振。2022年9月30日,患者发现双下肢轻度可凹陷性水肿。外院查血常规:WBC 11.7(括号内为正常参考值范围,下同;4.0~10.0)×109/L,中性粒细胞百分比83.6%(50%~70%),淋巴细胞百分比10%(20%~40%);尿常规、便常规、24 h尿蛋白正常;血白蛋白16(35~50) g/L;免疫球蛋白(immunoglobulin, Ig)A正常,IgG 2.5(7.0~16.6) g/L;自身抗体正常;HBV-DNA:3 130(<20) U/ml。腹股沟淋巴结超声:双侧腹股沟见多发淋巴结。胸腹部CT:双侧胸腔积液,左侧为著;腹腔积液。腹腔积液常规及病理均未见明显异常。
患者主诉为消化道症状、下肢水肿,实验室检查最突出的问题是严重的低蛋白血症,影像学检查发现胸腹腔积液。患者的低蛋白血症可以解释下肢水肿和浆膜腔积液的情况,而引起低蛋白血症的原因包括白蛋白来源不足(如肝脏合成障碍、营养不良)、消耗过多(如存在肿瘤等消耗性疾病)以及丢失过多(包括从肾脏丢失和消化道丢失)。患者的实验室和影像学检查除外了肝脏功能、肾脏丢失的情况,也暂未发现肿瘤,因此临床考虑蛋白丢失性肠病(protein-losing enteropathy, PLE)可能性大。PLE可由多种疾病导致,其典型特征是蛋白质从胃肠道过量丢失。正常人约有10%的白蛋白和γ球蛋白在胃肠道进行正常更替,当血浆蛋白质进入胃肠道后会迅速降解为氨基酸,并被重新吸收进入门脉循环,肝脏可增加蛋白质合成速率来代偿蛋白质的少量丢失,而如果胃肠道丢失的蛋白质超过肝脏合成能力时,就会发生PLE[1,2]。胃肠道丢失的蛋白质是非选择性的,与相对分子质量无关,受影响最大的是分解代谢速率较低的血清蛋白,如白蛋白、IgA、IgG、IgM、铜蓝蛋白和纤维蛋白原[3]。除了蛋白质外,其他血浆成分也可从胃肠道丢失,包括铁、脂质和微量元素等。
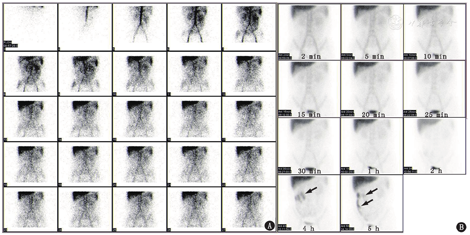
明确诊断PLE的必要条件是证实蛋白质从胃肠道丢失。蛋白质从胃肠道丢失的病理机制主要有3种:(1)胃肠道黏膜损伤,可以导致富含蛋白质的体液渗出;(2)炎性反应、浸润性和遗传性疾病使胃肠道的黏膜通透性增加,可导致蛋白质漏入肠腔内;(3)淋巴管阻塞、淋巴系统先天性异常或中心静脉压升高的疾病可导致淋巴管压力升高,从而使淋巴液从肠道丢失。为进一步明确PLE的诊断及鉴别蛋白质丢失的机制,患者行99Tcm-人血清白蛋白(human serum albumin, HSA)肠道蛋白丢失显像(图1)和99Tcm-硫化锑(antimony sulfide, ASC)淋巴显像(图2)。99Tcm-HSA肠道蛋白丢失显像中,血流期可见腹部显像剂摄取增高,以中上腹部为著,提示可能是腹部肠管血流灌注增加所致;之后的各期延迟显像见4 h(相当于第4组小肠部位)有异常放射性增高区,随时间延长放射性增高区逐渐移行,至5 h见升结肠显影。这个检查证实了肠道蛋白丢失,并且丢失的部位很可能位于第4组小肠。99Tcm-ASC下肢淋巴显像可见双下肢淋巴管显影清晰,回流通畅,腘窝、腹股沟、髂及腰干淋巴结显影清晰,各期显像腹部始终未见异常放射性增高区,因此排除了淋巴系统异常、淋巴液丢失所致的PLE。



之后患者查血巨细胞病毒(cytomegalovirus, CMV)-DNA 730(<100) copies/ml,T细胞、B细胞亚群示CD8异常激活及T4/T8比例倒置,提示CMV感染导致肠炎可能。患者进一步行双气囊小肠镜检查提示:第3~4组小肠黏膜散在不规则浅溃疡,黏膜充血、肿胀(图3)。活组织检查病理提示:小肠黏膜急性及慢性炎性反应,肉芽组织形成,局部隐窝结构紊乱、上皮增生明显。最终患者明确诊断为CMV性肠炎、PLE,给予低脂肪饮食、补充白蛋白、利尿、抗CMV治疗后,患者腹胀、腹腔积液、双下肢水肿明显好转。
自1986年起,99Tcm-HSA显像就被用于PLE的诊断,并且是一种特异性的诊断方法[4]。若存在PLE,99Tcm-HSA显像剂注射后会从血管漏入肠腔,从而使相应病变肠道出现异常放射性浓聚,是证明蛋白质从肠道丢失的直接证据。有研究显示,99Tcm-HSA显像诊断PLE的灵敏度为91.3%,特异性为66.7%,准确性为87.3%,阳性部位以小肠、结肠较常见;常见的漏诊原因多因肝脏、肾脏及大血管的遮挡、图像重叠导致,而误诊的原因多由于胃肠道出血、污染及胆囊持续显影等导致[4]。
如前所述,PLE的病理机制之一是蛋白质经淋巴液从肠道丢失。核素淋巴显像是了解淋巴系统走向、淋巴结形态和摄取胶体颗粒功能的核素显像技术。99Tcm-ASC下肢淋巴结显像可反映下肢、腹部、胸部淋巴系统有无异常,对于PLE患者可以观察腹部有无淋巴液渗漏,也可以为PLE的诊断以及病因提供相应依据(图4)。本例患者淋巴显像阴性,提示该患者的PLE并非经淋巴液丢失,而是其他原因导致。
核医学领域中也有研究用其他显像剂为PLE诊断提供依据,如131I-聚乙烯吡咯烷酮(polyvinylpyrrolidone, PVP)、51Cr-白蛋白、125I-白蛋白、111In-转铁蛋白、99Tcm-右旋糖酐和99Tcm-Ig等[5,6,7,8],但由于检测操作不便利、核素来源困难、药物不良反应等原因,这些方法未在临床中普及。99Tcm-HSA显像作为一种古老、经典的核医学显像技术,可以为PLE提供最直接的诊断依据,仍然在临床上发挥其独特的作用。
所有作者声明无利益冲突


























