
177Lu-前列腺特异膜抗原(PSMA)-617的临床Ⅲ期VISION研究对前列腺癌的诊疗及临床管理具有广泛影响。转移性前列腺癌诊疗领域发展迅速,具有多种成熟的治疗方法,包括化疗、激素治疗、免疫治疗、放射性药物及靶向治疗。现行诊疗方案来源于一系列重要的关键性临床Ⅲ期试验,这些试验通常采用总生存期为研究终点。为了更好地理解在去势抵抗性前列腺癌患者中进行的VISION研究,有必要彻底了解该研究设计的决策基础及内容。因此该文将介绍VISION临床Ⅲ期试验的关键要素以及这些要素对监管决策和临床实践的影响。研究的纳入和排除标准以及治疗、评估和终点事件等也将重点介绍。令人印象深刻的是,VISION试验对只有少数治疗方案可选择的晚期前列腺癌患者仍能明显提高生存期。除了取得的重大进展外,该研究也存在重大的局限性。177Lu-PSMA-617将对前列腺癌治疗产生深远的影响。基于VISION数据,2022年3月23日美国食品与药品监督管理局(FDA)批准177Lu-PSMA-617用于前列腺癌的治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2022年3月23日美国食品与药品监督管理局(Food and Drug Administration, FDA)批准了177Lu-前列腺特异膜抗原(prostate specific membrane antigen, PSMA)-617新药,为更好理解这种前列腺癌新疗法的背景以及剖析临床Ⅲ期VISION试验的设计关键提供了绝佳机会[1]。
转移性前列腺癌有多种延长生存期的治疗方法。一般来说,转移性前列腺癌的治疗分为转移性去势敏感性前列腺癌和转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer, mCRPC)(图1)。对转移性去势敏感性前列腺癌使用雄激素去势治疗(androgen deprivation therapy, ADT)作为常规应用,即促黄体生成激素释放激素类似物(如亮丙瑞林、戈舍瑞林、曲普瑞林、地加瑞克和瑞卢戈利)或睾丸切除的形式。最近,ADT联合多西他赛化疗被证实能延长转移性去势敏感性前列腺癌的生存期[2-3],ADT联合1种新的雄激素受体途径抑制剂(androgen receptor pathway inhibitor, ARPI),如阿比特龙或阿帕他胺,具有类似效果[4-7]。阿比特龙、阿帕他胺和恩扎卢胺属于能阻断雄激素受体(阿帕他胺/恩扎卢胺)或阻断雄激素合成(阿比特龙)的ARPI药物。现在,转移性去势敏感性前列腺癌的治疗不会单用ADT。最近的2项临床Ⅲ期研究表明,ADT +多西他赛+阿比特龙[8]或ADT +多西他赛+达罗他胺(另一种雄激素受体拮抗剂)[9]优于ADT +多西他赛的治疗效果。
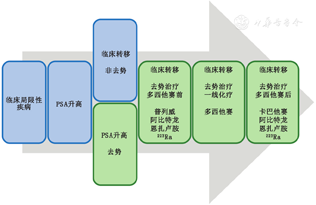

表1总结了所有包含mCRPC患者生存结果的试验。2004年,多西他赛是第一种在临床Ⅲ期试验中被证实能延长mCRPC患者生存期的药物[10-11]。无论作为mCRPC患者的一线治疗还是用于多西他赛化疗后[12-15],雄激素抑制剂阿比特龙和恩扎卢胺都可以延长生存期。FDA批准卡巴他赛用于多西他赛化疗后的mCRPC患者[16],但在ARPI或多西他赛治疗后使用也有效[17]。多西他赛治疗前后进行223RaCl2治疗可以延长生存期[18]。普列威(Sipuleucel-T)是一种免疫疗法,可以延长无症状或轻症mCRPC的生存期(主要在化疗前)[19]。同源重组修复缺陷(如BRCA1和BRCA2)的mCRPC在ARPI或ARPI/多西他赛治疗后生存期更长[20]。
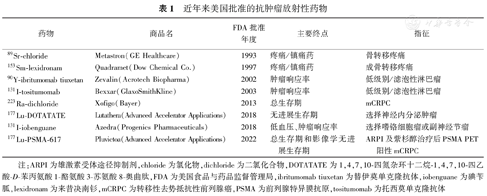
近年来美国批准的抗肿瘤放射性药物
近年来美国批准的抗肿瘤放射性药物
| 药物 | 商品名 | FDA批准年度 | 主要终点 | 指征 |
|---|---|---|---|---|
| 89Sr-chloride | Metastron(GE Healthcare) | 1993 | 疼痛/镇痛药 | 骨转移疼痛 |
| 153Sm-lexidronam | Quadramet(Dow Chemical Co.) | 1997 | 疼痛/镇痛药 | 成骨转移疼痛 |
| 90Y-ibritumomab tiuxetan | Zevalin(Acrotech Biopharma) | 2002 | 肿瘤响应率 | 低级别/滤泡性淋巴瘤 |
| 131I-tositumomab | Bexxar(GlaxoSmithKline) | 2003 | 肿瘤响应率 | 低级别/滤泡性淋巴瘤 |
| 223Ra-dichloride | Xofigo(Bayer) | 2013 | 总生存期 | mCRPC |
| 177Lu-DOTATATE | Lutathera(Advanced Accelerator Applications) | 2018 | 无进展生存期 | 选择神经内分泌肿瘤 |
| 131I-iobenguane | Azedra(Progenics Pharmaceuticals) | 2018 | 低血压、肿瘤响应率 | 选择嗜铬细胞瘤或副神经节瘤 |
| 177Lu-PSMA-617 | Pluvictoa(Advanced Accelerator Applications) | 2022 | 总生存期和影像学无进展生存期 | ARPI及紫杉醇治疗后PSMA PET阳性mCRPC |
注:ARPI为雄激素受体途径抑制剂,chloride为氯化物,dichloride为二氯化合物,DOTATATE为1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-D-苯丙氨酸1-酪氨酸3-苏氨酸8-奥曲肽,FDA为美国食品与药品监督管理局,ibritumomab tiuxetan为替伊莫单克隆抗体,iobenguane为碘苄胍,lexidronam为来昔决南钐,mCRPC为转移性去势抵抗性前列腺癌,PSMA为前列腺特异膜抗原,tositumomab为托西莫单克隆抗体
VISION试验在mCRPC接受ARPI和紫杉醇治疗后进行,最近批准177Lu-PSMA-617的治疗要求遵循这一标准。
1.诊断治疗学。过去10年中,诊断治疗学和靶向放射性药物都取得了巨大发展,尽管在肿瘤学领域曾鲜为人知,但现在已成为治疗的一个关键组成部分[21]。由于早期商业化尝试的失败,使得传统药企接受这一领域的速度较慢[22]。当该领域的收益难以实现时,就很难吸引进一步投资。商业化失败的原因已被讨论,主要是因为回报和竞争的原因。
虽然放射性药物被接受、融入广义的癌症治疗范围仍存在争议,223RaCl2在延长mCRPC总生存期(overall survival,OS)方面的显著成功有力促进了投资和进一步的研究[18]。基于早期研究,FDA批准的89SrCl2和153Sm-来昔决南钐(lexidronam)仅有姑息性获益[23-25]。223RaCl2及177Lu-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-D-苯丙氨酸1-酪氨酸3-苏氨酸8-奥曲肽(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid-D-Phe1-Tyr3-Thr8-octreotide, DOTATATE)治疗神经内分泌肿瘤的成功[26]是商业介入的关键(表2)。获得监管部门批准的关键是核心试验设计和执行。本文强调了VISION试验[1]的设计重点,并对存在争议的地方提供了部分细节解释(图2),与任何试验设计一样需要做出许多选择,这些选择总体上决定了纳入、治疗、随访和评估病情的方式。

mCRPC临床生存获益的临床Ⅲ期试验
mCRPC临床生存获益的临床Ⅲ期试验
| 试验 | mCRPC前线治疗 | 参考文献 |
|---|---|---|
| TAX 327 | 多西他赛/醋酸泼尼松与米托蒽醌/醋酸泼尼松 | [10] |
| SWOG 9916 | 多西他赛+雌莫司汀与米托蒽醌/醋酸泼尼松 | [11] |
| IMPACT | 普列威与非激活免疫细胞对照 | [19] |
| COU-AA-302 | 阿比特龙/醋酸泼尼松与安慰剂/醋酸泼尼松 | [13] |
| ALSYMPCA | SOC±223Ra | [18] |
| PREVAIL | 恩扎卢胺与安慰剂;多西他塞治疗后 | [15] |
| TROPIC | 卡巴他赛/醋酸泼尼松与半托蒽醌/醋酸泼尼松 | [16] |
| COU-AA-301 | 阿比特龙/醋酸泼尼松与安慰剂/醋酸泼尼松 | [12] |
| AFFIRM | 恩扎卢胺与安慰剂 | [14] |
| ALSYMPCA | SOC±223Ra;HRR变异亚组ARPI或ARPI+多西他赛治疗后 | [18] |
| PROfound | 奥拉帕利与阿比特龙或恩扎卢胺;ARPI及多西他赛治疗后 | [20] |
| CARD | 卡巴他赛与阿比特龙或恩扎卢胺 | [17] |
| VISION | SOC±177Lu-PSMA-617 |
注:HRR为同源重组修复,SOC为标准治疗
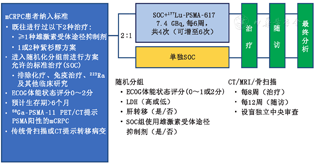

2.VISION研究设计中的终点事件。首先,临床Ⅲ期VISION试验是经监管部门批准而设计的研究。因此,采用的终点事件是既往晚期前列腺癌研究中应用并被FDA及其他监管机构所接受的。该试验最初设计仅以OS为主要终点。OS被认为是评估进展期肿瘤的"金标准",在mCRPC领域具有长期、成功的随访记录,此前已被用于批准多西他赛、卡巴他赛、普列威、223RaCl2、阿比特龙和恩扎卢胺的研究[27]。在VISION试验设计和启动后,影像学无进展生存期(radiographic progression-free survival, rPFS)或全因死亡成为第二个替代的主要终点事件。这种基于影像学的终点事件与前列腺癌工作组3(Prostate Cancer Working Group 3, PCWG3)标准一致[28]。次要终点事件是FDA批准奥拉帕利关键试验中的主要终点[29]。OS和rPFS终点均由随机化时间(而非治疗时间)计算。rPFS评估必须严格符合明确的时间线和方法学(传统成像,而非PET扫描)。根据PCWG3标准,rPFS终点与mCRPC中的OS密切相关。PET显像还没被证明是一种应答生物标志物,且PSMA PET显像和OS之间的关系尚未验证。
VISION试验的次要终点包含FDA推荐的几个传统分析指标。这些终点设计旨在获取实验药物相对于对照组活性的支持性数据。关键的次要终点包括发生症状性骨骼事件或死亡的时间,基于实体瘤疗效评价标准(response evaluation criteria in solid tumors, RECIST)1.1的放射学客观反应以及疾病控制率评估。症状性骨骼事件包括首次使用外照射治疗以缓解骨症状、新出现有症状的椎体或非椎体病理性骨折、脊髓压迫或肿瘤相关需要骨科手术干预骨事件(ALSYMPCA试验应用)[18]。此外,其他终点包括前列腺特异抗原(prostate specific antigen, PSA)反应率≥50%、肿瘤治疗功能评估健康的相关生活质量、简明疼痛量表-简表、欧洲五维-五水平健康量表。不良事件采用美国国家癌症研究所不良事件通用术语标准5.0版进行评估,重要的是这些都是常见的终点。症状性骨骼事件在骨显性癌症,如前列腺癌中特别重要,症状性骨骼事件评估在223Ra获批中起了关键作用。各种附加标准已经标化并纳入了多个临床Ⅲ期试验。使用临床相关、易于解释且熟悉的终点是监管决策的关键特征。与健康相关的生活质量评估对某些国家比对其他国家更为关键,但所有监管机构都希望确保与健康相关的生活质量参数不会受到治疗的不利影响。值得注意的是,尽管PSA是多个试验中最常报道的终点,但PSA尚不足以被监管部门认同。PSMA PET也不能作为OS的替代品,只能进行探索性应用。
3.VISION患者纳入标准。所有纳入VISION研究的患者必须由常规影像(即骨扫描、CT或MRI)确定为mCRPC。试验入组时的病情进展需要通过PSA或基于影像学的标准进行记录。血清PSA最小值为2.0 μg/L。所有患者具有去势睾酮水平,并且在基于紫杉醇的化疗(通常是多西他赛)+新型激素(即阿比特龙或恩扎卢胺)治疗后出现疾病进展时方可考虑纳入。其他各种既往治疗,如奥拉帕利是允许但非必需的。患者允许进行≤2种基于紫杉醇为基础的化疗。对于之前激素应用的次数没有限制。事实是,纳入的患者既往接受过多种治疗,很少有患者仅进行了多西他赛和1种新型激素治疗。
VISION试验的纳入标准还需要在治疗性177Lu-PSMA注射前1~4周内进行PSMA PET显像(68Ga-PSMA-11联合非诊断性CT平扫)。PSMA PET/CT显像需在所有其他筛选资格标准符合后再进行。重要的是,对PSMA PET/CT图像集中读取的选择标准分阳性和阴性。所有患者要有至少1个PSMA PET阳性转移性病变,PET阳性病变的大小没有标准。PSMA阳性与肝脏摄取有关,换句话说,转移性病变摄取药物程度必须高于肝脏。基线评估需要胸部、腹部和骨盆的诊断级增强CT扫描(或增强MRI)以及全身骨显像。PET/CT选择标准的一个关键特征还涉及PSMA摄取低于肝摄取的转移性病变(即PSMA PET阴性)。具有以下病变的患者将被排除试验:PSMA PET阴性且最大径>1 cm的内脏病灶(肝或肺)或溶骨性病变,或PET阴性且至少2.5 cm大小的淋巴结。尽管没有进行18F-FDG PET检查,但是许多PSMA阴性病灶推测应该是18F-FDG PET阳性。
关于VISION中缺少18F-FDG PET的问题有一些讨论。使用18F-FDG PET可能会提高应答患者的数量[30-31]。由于在许多国家很难进行2种不同PET影像研究,对2种PET影像学研究的要求在VISION设计阶段也存在争议,因此为了研究的可执行性放弃了18F-FDG PET显像。鉴于VISION试验明确的阳性OS结果,许多医师都认可这一决定。也就是说,最佳影像学毫无疑问可能会被证实具有更好的结果。然而,最佳影像学仍有待以OS为终点事件的临床试验进行验证。因此,在出现相反数据之前,监管机构很可能会采用与VISION试验类似的PSMA PET纳入标准,用于接受PSMA靶向放射性药物治疗的患者。
除VISION纳入标准外,排除标准中还有几点值得注意,包括超级骨显像、体能差、骨髓抑制严重。随机化前6个月内不能进行以下任何一种治疗:89Sr、153Sm、186Re、188Re、223Ra或半身照射。既往PSMA靶向放射配体治疗也将被排除。超级骨显像的患者无法评估骨扫描进展,因此也被排除在外。
评估时间包括在方案定义的治疗开始前1~4周行PSMA PET扫描(仅使用68Ga-PSMA-11)、治疗后4周内进行诊断性CT或MRI(胸、腹和盆部)和全身骨显像。研究人员在随机分组前指定标准治疗(standard-of-care, SOC),考虑到新激素使用是一个分层变量,首次治疗后24周内每8周(±4 d)进行骨扫描和CT,之后每12周进行检查直至治疗终止。关键是,即使核素存在剂量延迟效应,肿瘤评估依需按要求进行。
4.VISION分层、随机化和治疗。当治疗患者一些已知会影响预后的关键特征不平衡时,可能会导致简单随机化失败,分层克服了这个潜在问题。VISION试验包括4个分层因素:血清乳酸脱氢酶(>260 U/≤260 U)、肝转移(是/否)、东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)体能状态评分(0~1或2分)和新型激素使用(通常指恩扎卢胺或阿比特龙),SOC治疗组同上。已在多个Ⅲ期mCRPC试验中得知乳酸脱氢酶、肝转移病变和ECOG体能状态评分对预后具有重要意义,因此被纳入考量。延长生存的激素治疗(通常指阿比特龙和恩扎卢胺)作为分层因素,以确保平衡这个潜在的重要变量。
符合条件的患者以2∶1的方式随机分组,核素治疗+ SOC治疗优于单独SOC治疗。177Lu-PSMA-617治疗的剂量和时间难以简单决定,先前大多数据源于不同的剂量和时间。VISION剂量最初的主要依据来源于澳大利亚Ⅱ期前瞻性试验结果[30]。在这个单中心单臂试验中,每6周给予中位剂量7.5 GBq的177Lu-PSMA-617,最多治疗4次,结果示疗效显著且毒性可控。VISION试验计划给药方案为每次剂量7.4 GBq(200 mCi)(固定剂量比基于体质量的剂量可行性高),计划进行4次治疗。但是,临床医师根据自己的判断可治疗多达6次。治疗6次的评估应包含第4次治疗后的治疗响应评估(放射学和PSA)及临床获益。此外,增强CT、MRI或骨扫描中显示仍有残余病变,且在之前177Lu-PSMA-617治疗中具有良好耐受性。由于既往研究缺乏有效性或安全性数据,进行6次治疗仍有争议。
VISION对照组的设计争论颇多。应该指定SOC吗?SOC是否应该联合177Lu-PSMA-617,还是SOC对比177Lu-PSMA-617?对照组是否进行化疗?223RaCl2是否应用?既往激素治疗未能控制疾病之后进行其他激素治疗是否合乎伦理?对于临床医师和患者,什么样的对照治疗可以接受?
一个关键的决定是在纳入标准中患者需要接受1种紫杉醇治疗,但只允许≤2种紫杉醇治疗。二线治疗方案紫杉醇化疗联合卡巴他赛已知能延长生存,但没有任何证据表明2种化疗方案后仍能延长生存。因此,每个想接受二线化疗的患者都可以接受这些治疗,并仍可被纳入该试验,但TheraP试验则不行[31]。目前尚无有效的三线化疗方案,因此对照组是否实施三线化疗尚无定论。从实际角度出发,大多数mCRPC患者在因该病去世前从未接受过2种化疗方案。事实上,许多患者去世前从未接受过化疗[32]。前列腺癌患者通常对化疗是不敏感的,部分原因是由于年纪较大。因此,要求对照组受试者在真实世界研究中接受某种治疗是不合适的。
一些研究表明,PSMA表达可以通过使用激素(如恩扎卢胺)上调。因此,新型激素与PSMA靶向治疗可能具有协同作用,新型激素被允许作为SOC的一部分。尽管这种协同作用尚未在临床试验中得到证实,但是新型激素和177Lu-PSMA-617尚未被发现不良的相互作用。总之,SOC联合或者不联合177Lu-PSMA-617被认为是最优选择,这在成功获得药监局批准的ALSYMPCA Ⅲ期试验中通过SOC联合或不联合223RaCl2得到了验证。在VISION实验的最终设计中,类固醇、双膦酸盐和其他骨保护剂以及外照射被允许作为SOC的一部分。化疗作为SOC中的一种被排除在外,不仅因为患者在接受方案治疗前可以接受1或2种基于紫杉醇的化疗,还因为177Lu-PSMA-617与化疗联合治疗可能不安全。基于类似的安全考虑,223RaCl2或聚腺苷二磷酸核糖聚合酶抑制剂(如奥拉帕利)的使用也被排除。
研究设计中对照组与核素治疗组没有交叉,但是试验获得阳性结论后,作为补偿,对照组患者满足条件则可接受177Lu-PSMA-617治疗,然而几乎没有患者符合补偿性治疗的要求。
5.VISION统计分析方案。统计分析方案的最初设想是对750例患者进行OS评估。对照组的中位生存期预计为10个月,试验组预计中位OS为13.7个月[489次事件后,风险比(hazard ratio, HR)=0.730 6]。试验最初有2次OS中期分析,rPFS是次要终点。统计方案效力为90%,单侧Ⅰ类错误率为0.025。OS分析采用分层Cox比例风险回归模型,上述4个变量采用单一协变量进行随机治疗和分层。
因为对照组退出率在一些中心较高,对统计分析进行了一些修订后(2019年3月生效)被FDA同意。当时,为了解决这些中心临床试验存在的问题,关闭了某些临床试验中心,以便进一步累积资金在其余中心实施额外的现场培训。对照组在方案修订前停药率为56%(47/84),修订后停药率为16.3%,表明现场筛选和教育工作的重要性。所有中心主要研究者都以核医学科为主,并且具有较好的多学科护理体系。试验现场教育改进的关键任务之一是保证患者都能进行多学科护理。考虑到那些具有多种潜在并发症的严重前列腺癌患者,多学科护理对VISION患者是最佳选择。
2019年3月后的统计分析方案评估以rPFS和OS作为共同主要终点,并允许对不同人群进行OS和rPFS评估,因为随访不及时的患者估计不会按时进行放射学评估。只有2019年3月9日后纳入的患者进行了rPFS评估(n=557)。预估样本量增加到814个。修订后预估OS没有变化(中位数:10和13.7个月)。对照组和试验组的中位rPFS预估分别为4个月和6个月。试验总体显著性水平为0.025(单侧),分布于2个主要终点之间。364次事件后该方案rPFS的统计效力为84%,HR=0.67(单侧显著性水平为0.004);OS的统计效力为90%,HR=0.73(单侧显著性水平为0.025)。OS分析是在508个死亡事件后进行的。如果rPFS和OS均为阳性,则可对关键次要终点进行连续测试(症状性骨骼事件发生的时间、基于RECIST 1.1的应答率及疾病控制率)。
6.VISION患者特征。研究纳入初筛患者1 179例,其中1 003例(85.1%)具有符合研究定义的68Ga-PSMA-11 PET/CT检查。在1 003例患者中,954例(95.1%)至少有1个PSMA阳性转移灶,87例(8.7%)至少有1个PSMA阴性转移灶,被VISION试验排除。1 003例患者中有126例(12.6%)不符合PSMA影像纳入标准,即没有PSMA阳性病变或至少有1例排除PSMA阴性病变。因此,869例接受PSMA PET/CT扫描的患者(86.6%)符合研究条件,8例患者的PSMA结果缺失无法进行分类。令人惊讶的是,实际有接近87%的扫描患者符合入选条件,表明该研究的纳入标准较为宽泛。在澳大利亚开展的Ⅱ期随机治疗研究中,只有68.7%的扫描患者符合入选标准[31]。TheraP组采用双PET策略,在选择标准中同时采用了PSMA PET/CT和18F-FDG PET/CT。
最终831例患者在VISION试验中进行了随机分组。实验疗法应用之前普遍进行了其他治疗。831例患者中,342例(41.2%)接受了2种基于紫杉醇的化疗(作为纳入标准之一,所有患者均接受了至少1种),406例(48.7%)患者接受了2种或更多新型激素药物(主要是阿比特龙和恩扎卢胺)治疗,治疗方案组间达到平衡。SOC组的中位PSA为74.6 μg/L,SOC+核素治疗组为77.5 μg/L。在SOC组和实验组中,诊断中位时间分别为7.0和7.3年。SOC组患者和实验组分别有91.4%和91.5%的患者存在骨转移,分别有13.6%和11.4%的患者存在肝转移。
7.VISION结果。试验中位随访时间为20.9个月。VISION的研究终点在之前的文章中进行了充分讨论[1]。OS明显为阳性结果,HR=0.62(95% CI:0.52~0.74,P<0.001)。SOC组中位生存期为11.3个月,SOC+177Lu-PSMA-617组为15.3个月。在831例患者中,530例(63.8%)在VISION试验进行OS分析时死亡,表明该试验足够成熟。对于rPFS,SOC组中位数为3.4个月,SOC+177Lu-PSMA-617组为8.7个月(HR=0.40;99.2% CI:0.29~0.57;P<0.001)。rPFS预测OS的灵敏度分析(n=581)显示HR=0.63(95% CI:0.51~0.79)。有研究者指出,即使没有PSMA PET/CT影像学筛查,VISION试验也可能得到阳性结果,因为HRs和CIs均较高。对各亚组的分析都提示rPFS和OS的显著性趋势。肝转移患者HR的95% CIs包含1.0(HR=0.87;95% CI:0.53~1.43),但由于肝转移患者纳入人数较小,该亚组分析结论证据明显不足。
迄今为止,所有次要终点分析结果均为阳性。核素治疗延长了症状性骨骼事件的发生或生存期(11.5和6.8个月;HR=0.50,95% CI:0.40~0.62,P<0.001)。单中心评估RECIST完全缓解率(基线时248例具有可测量病变)在试验组为9.2%,SOC组为0.0%。核素+SOC组和单独SOC组的部分缓解率分别为41.8%和9.2%,完全+部分缓解率分别为51%和9.2%。与其他mCRPC研究相比,完全缓解+部分缓解率高得惊人。CARD研究同样在多西他赛和1种新型激素治疗后进展的患者中进行,卡巴他赛的RECIST完全+部分缓解率为37.0%[17]。COU-301试验(mCRPC多西他赛治疗后)中阿比特龙治疗的RESIST完全+部分缓解率为14%。PSA降低至少50%为应答,实验组和单独SOC组的应答率分别为46.0%和7.1%。作为对比,CARD试验中卡巴他赛组中35.7%患者有PSA应答,阿比特龙组中29%患者有PSA应答。很难找到与VISION相当的研究,因为这些患者之前普遍接受过治疗。无论如何,这些经过众多预治疗的mCRPC患者的研究数据与其他多西他赛治疗后的试验相比都是获益的。
健康相关的生活质量(癌症治疗-前列腺功能评估总分)和疼痛评估(简明疼痛量表疼痛强度-简表)都提示使用SOC+ 177Lu-PSMA-617较单独应用SOC更有利。癌症治疗功能评估(前列腺)总分的恶化时间为5.7和2.2个月(HR=0.54,95% CI:0.45~0.66);疼痛恶化的时间分别为5.9和2.2个月(HR=0.52,95% CI:0.43~0.63)。这些以患者为中心的报告证实了其与VISION检查结果的临床相关性,177Lu-PSMA-617+SOC治疗组患者的OS和健康相关的生活质量都得到了明显改善。
对VISION评估治疗中出现的不良事件进行比较(不良事件通用术语标准版本5.0)。随访时间试验组为7.56个月,SOC组为2.07个月。不平等的随访时间会影响不良事件的发生频率。一些研究人员认为不良反应发生率在观察期间(每月)得到了校正。核素组中报告的最常见不良反应是疲劳(43.1%)、口干(38.8%)、恶心(35.3%)、贫血(31.8%)和背痛(23.4%)。除了口干,所有症状都可能与疾病本身有关。毫无疑问,试验组的发病率更高。对照组主要不良反应是疲劳(22.9%)、口干(0.5%)、恶心(16.6%)、贫血(13.2%)和背痛(14.6%)。不良事件的发生导致5.7%患者177Lu治疗剂量减少,11.9%患者停用177Lu。鉴于既往治疗经验,不良反应的发生均系预期内。
8.研究局限性。所有终点事件评估结果均显示177Lu-PSMA-617+SOC优于SOC。毫无疑问,这些几乎没有更多选择的晚期患者受益于实验性治疗。当然,还有很多是未知的。选择患者应用的PSMA PET最佳标准是什么?低SUV病变患者是否比高SUV病变患者应答率低?虽然PSMA PET标准有争议,笔者仍赞成保留PSMA PET/CT检查以排除治疗不太可能有响应的患者。所有患者计划进行4次治疗,最高可达6次;不允许再次进行PSMA治疗。如果在前2或3次治疗中疾病进展怎么办?应该增加剂量吗?PSA是反应或进展的可靠标志物吗?对于哪些疼痛明显减轻但PSA没有下降的患者呢?要不要再增加药物?什么时候应该停止治疗?核素的最佳剂量是多少?最佳治疗频率是什么?是否应该使用PSMA PET/CT作为反应标准?如果2个疗程后,PSMA PET提示没有疾病该如何?是否仍需进一步治疗?疾病的更早期阶段呢?与177Lu-PSMA-617联合治疗时,SOC(如果有)的作用是什么?使用阿比特龙或恩扎卢胺上调PSMA表达是否有意义且与临床相关?
尽管临床Ⅲ期试验结果为阳性,但仍有许多问题未得到完全解答。对VISION试验进一步分析可能会给出答案,将会进行更加详细的分析。许多问题需要通过新的临床研究解惑,然而试验费用耗资巨大且难以执行,将很难得到确切答案。
9.未来的临床Ⅲ期研究。目前正在使用177Lu-PSMA-617开展进一步临床Ⅲ期试验。这些试验包括PSMAfore(NCT04689828)和PSMAaddition(NCT04720157)。PSMAfore试验将纳入450例初治化疗的mCRPC患者,以rPFS为终点且允许交叉。177Lu-PSMA-617将与先前已采用至少1种新激素(阿比特龙、恩扎卢胺、阿帕他胺或达罗鲁胺)治疗后的第2种新激素进行比较。PSMAaddition试验也将rPFS作为主要终点,并将招募转移性激素敏感性前列腺癌患者。177Lu-PSMA-617将与ADT和新型激素联合使用(多西他赛除外)。PSMAaddition试验将招募约1 126例患者,以rPFS作为主要终点且允许交叉。
其他PSMA靶向治疗的临床Ⅲ期试验将很快进入随机化阶段。177Lu-PSMA I&T(也称为177Lu-PNT2002)将在SPLASH试验(NCT04647526)中以类似PSMAfore的设计进行评估。同样,177Lu-PSMA I&T将在ECLIPSE试验中进行研究。
简单来说,177Lu-PSMA-617作为一种有效药物,能提高肿瘤应答及晚期前列腺癌患者的健康相关生活质量。还有更多的临床Ⅲ期试验正在规划中。很期待药监局能以此为契机批准相关药物,而采用公认终点事件并精心进行试验设计和执行将是关键所在。本文参考文献具体见http://jnm.snmjournals.org。


























