
患者男,73岁,2021年6月开始自觉肤色加深,无其他不适,未诊治。2021年8月因外伤于外院查腹部平扫CT发现双侧肾上腺不规则肿物,左侧为著。后就诊于本院,血促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)>1 250(正常参考值范围,下同:0~46) ng/L,皮质醇35.9(110.5~616.3) nmol/L。腹部增强CT及18F-FDG PET/CT显像(图1)提示右侧肾上腺弥漫增粗,增强后呈轻度均匀强化,代谢明显增高,SUVmax 7.0;左侧肾上腺见类圆形团块,大小约3.3 cm×3.7 cm,呈轻度不均匀强化,代谢呈不均匀增高,SUVmax 5.6,中心见代谢减低的囊变坏死区;此外,左肺门见一代谢轻度增高的小结节,大小约1.2 cm×1.6 cm,SUVmax 3.8,考虑可能为炎性淋巴结。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,73岁,2021年6月开始自觉肤色加深,无其他不适,未诊治。2021年8月因外伤于外院查腹部平扫CT发现双侧肾上腺不规则肿物,左侧为著。后就诊于本院,血促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)>1 250(正常参考值范围,下同:0~46) ng/L,皮质醇35.9(110.5~616.3) nmol/L。腹部增强CT及18F-FDG PET/CT显像(图1)提示右侧肾上腺弥漫增粗,增强后呈轻度均匀强化,代谢明显增高,SUVmax 7.0;左侧肾上腺见类圆形团块,大小约3.3 cm×3.7 cm,呈轻度不均匀强化,代谢呈不均匀增高,SUVmax 5.6,中心见代谢减低的囊变坏死区;此外,左肺门见一代谢轻度增高的小结节,大小约1.2 cm×1.6 cm,SUVmax 3.8,考虑可能为炎性淋巴结。
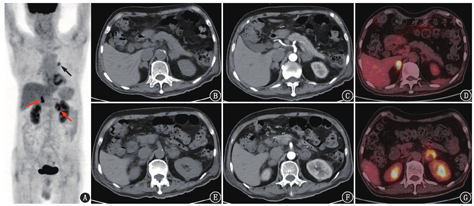

本例是以双侧肾上腺病变为主的病例。当发现双侧肾上腺多发占位时,主要需考虑继发性肿瘤(转移瘤、淋巴瘤)、感染、肾上腺原发病变(皮质来源的结节样增生/腺瘤、髓质来源的嗜铬细胞瘤)等。肾上腺结节样增生/腺瘤会引起相应的内分泌症状,如出现库欣综合征、醛固酮增多症;嗜铬细胞瘤也会有发作性高血压、儿茶酚胺升高等表现。本例的临床特征是血ACTH显著增高,而血皮质醇明显降低,提示原发性肾上腺皮质功能减退,因此可以先除外肾上腺原发病变。
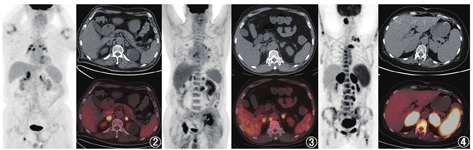
原发性肾上腺皮质功能减退可由自身免疫性疾病、感染性疾病(结核杆菌感染、真菌感染等)、转移瘤或淋巴瘤代替正常肾上腺组织、肾上腺出血/梗死或药物等原因引起[1,2],在我国最常见的原因为结核感染[3]。与结核感染相关的肾上腺皮质功能减退最常发生于老年男性。结核感染所致的肾上腺破坏通常呈渐进性,在病变早期,双侧肾上腺弥漫性增大,进展期形成低密度或软组织结节、肿块,密度均匀并代谢增高(图2),其病理组织学对应结核的上皮样细胞及多核巨细胞形成肉芽肿性炎,如果病灶内发生干酪样坏死,PET/CT显像则表现为肾上腺代谢增高区内伴局部代谢减低区,对应平扫/增强CT表现为低密度无强化区[4]。本例患者的影像学表现完全符合结核的特点及相应病理阶段,即炎性肉芽肿浸润的同时伴有中心干酪样坏死。肾上腺转移瘤可为单侧,也可为双侧,影像上通常表现为低密度或软组织密度结节、团块或肿块[5],代谢程度与原发灶程度相当(图3),转移瘤较大时病变中心会出现坏死。本例患者的PET/CT未发现全身其他部位原发肿瘤病灶,所以可除外肾上腺转移瘤。累及肾上腺的淋巴瘤多为侵袭性淋巴瘤,一般表现为肾上腺代谢明显增高的肿物(图4),病变一般比本例更大、代谢更高、囊变坏死更少[3,5],并且肾上腺外可见淋巴瘤病灶,所以本例暂不考虑淋巴瘤。另外,从肾上腺皮质功能减退的发生机制来看,由于肾上腺皮质具有很强的代偿能力,在出现肾上腺功能减退之前大多数的肾上腺皮质已被破坏。转移瘤和淋巴瘤都是肿瘤组织取代正常的肾上腺组织,只有当肿瘤较大、病变较晚期时才会出现肾上腺皮质功能减退;而结核等感染性病变对正常肾上腺组织的破坏力更强,更容易发生肾上腺皮质功能减退。所以从影像和临床综合来看,本例最有可能的诊断是肾上腺结核。

患者2021年9月出现发热、乏力、恶心呕吐、二便失禁,体质量下降约10 kg,血压降低、血钠降低,考虑肾上腺危象,予氢化可的松替代治疗后症状好转(长期方案为早20 mg,晚10 mg)。后续行CT引导下经皮肾上腺占位穿刺活组织检查(左侧),病理见上皮样肉芽肿伴坏死形成,临床考虑为结核感染。患者遂于2021年11月开始行四联抗结核治疗(异烟肼、利福平、乙胺丁醇、吡嗪酰胺);治疗1个月后因出现恶心症状,调整方案:将吡嗪酰胺改为左氧氟沙星,余不变。2022年1月自述恶心加重,暂停利福平和左氧氟沙星,继续口服异烟肼及乙胺丁醇治疗;1个月后症状较前缓解,遂加用左氧氟沙星,维持三联抗结核治疗。2022年6月患者复查腹部增强CT(图5A),结果示双侧肾上腺团块或肿物,增强后呈不均匀强化,其中右侧病变较前明显增大,局部与肝右叶、右肾、右膈脚及下腔静脉分界不清,较大截面约6.2 cm×4.0 cm;左侧病变较前明显变小。
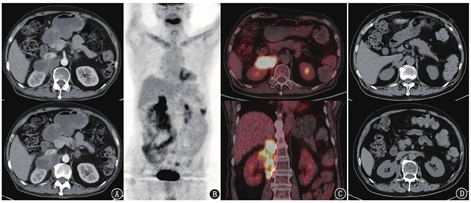

由于右侧肾上腺病变较前明显进展,临床怀疑为恶性病变可能,遂于2022年9月复查18F-FDG PET/CT(图5B、5C),PET/CT示右侧肾上腺见代谢增高的不规则肿物,较治疗前明显增大,并累及右膈脚、右腰大肌,SUVmax 8.8,其中累及腰大肌病灶中央见局部代谢减低区;左侧肾上腺病变较之前明显好转。此时应该如何考虑?之前穿刺活组织检查的是左侧肾上腺病变,抗结核治疗后左侧病变好转,符合肾上腺结核表现。但右侧肾上腺病变明显进展,是否提示右侧是恶性肿瘤?仔细观察右侧肾上腺病灶的特点,发现病变增大主要是呈纵向向下蔓延,有向下流注的趋势,而且病变中坏死区比之前更显著,这些征象很像结核冷脓肿的表现。所以从影像特征来看,考虑右侧肾上腺结核感染较前进展,需要继续规律抗结核或加强治疗,暂不考虑恶性肿瘤。最终临床继续三联抗结核治疗(异烟肼、乙胺丁醇、左氧氟沙星),半年后复查腹部CT见右侧肾上腺病变明显好转(图5D)。
为什么同样是结核感染,双侧肾上腺病灶对治疗的应答不同?实际上临床中肾上腺皮质功能减退和结核感染的联合治疗存在一定挑战性,因为利福平是细胞色素P450(cytochrome P450, CYP450)系统的强诱导剂,并参与肾上腺皮质激素的代谢过程。利福平通过在基因表达水平诱导CYP450 3A4酶(简称CYP3A4)缩短类固醇激素的半衰期,从而加速类固醇激素的代谢过程。这种相互作用会导致氢化可的松药物浓度不够,甚至发生肾上腺危象[6,7]。笔者推测患者在治疗过程中出现的恶心症状可能与此有关,所以患者在一段时间内停用了利福平等药物,而使治疗不规律。另外双侧肾上腺病变的炎性反应微环境和感染进程可能也有差异,有可能导致不同的治疗应答。
作为核医学科医师,好好把握影像特征并准确结合临床资料对做出诊断十分重要。当出现临床表现和影像相悖的情况时,要仔细分析影像特征、临床资料,方能为临床提供最有价值的报告结论。
所有作者声明无利益冲突


























