
评价四价重组登革热减毒活疫苗(CYD-TDV)的免疫原性、疫苗效力和安全性。
检索中国生物医学文献数据库、中国期刊全文数据库、万方全文数据库、National Center for Biotechnology Information(NCBI)和Cochrane协作网图书馆等数据库,将已公开发表有关CYD-TDV免疫原性、疫苗效力及安全性的随机对照试验纳入分析,合并计算试验组和对照组间中和抗体几何平均滴度(GMT)的标准均数差(SMD),合并计算两组登革热发病和不良反应发生的相对危险度(RR),并计算VE。
共纳入9篇文献。儿童青少年群体中,组间中和抗体GMT的SMD为0.62(95%CI: 0.57~0.68);成人群体中,组间中和抗体GMT的SMD为0.63(95%CI: 0.55~0.71)。符合方案集分析结果合并后,疫苗效力为60%(95%CI:54%~66%);意向性分析结果合并后,疫苗效力为61%(95%CI:56%~65%)。试验组中局部反应、全身反应以及严重异常反应发生率未显著高于对照组。
CYD-TDV有良好的免疫原性、疫苗效力和安全性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
WHO估计2013年全球登革热严重病例达320万例,其中死亡9 000例,主要发生在中低收入国家[1,2]。根据抗原性的不同,登革热病毒(DENV)可分为4个血清型,人类感染任一血清型均能产生型特异性抗体,并对同一血清型DENV的再次感染具有免疫保护作用,但却不能有效中和其他型别DENV,而在其他型别DENV感染时有可能产生抗体依赖的感染增强作用使其致病性增强[3,4]。因此,有效的登革热疫苗应该是对4种血清型DENV均能起到良好保护作用的四价疫苗。2015年全球第一种四价重组登革热减毒活疫苗(CYD-TDV)已经上市[5],国外已经开展的有关CYD-TDV的随机对照实验(RCT)对该疫苗的免疫保护效果和安全性进行了研究。为系统评估CYD-TDV的免疫原性、疫苗效力(VE)和安全性,本文系统检索国内外文献并进行Meta分析,旨在提高既往研究的统计学效力,为我国引入或制定CYD-TDV的免疫策略提供循证依据。
以"主题词=四价重组登革热减毒活疫苗or主题词=登革热减毒活疫苗or主题词=免疫原性or主题词=疫苗效力or主题词=疫苗安全性and主题词=随机对照试验and发表时间=2000年至今"为检索策略,检索中国生物医学文献数据库、中国期刊全文数据库、万方全文数据库。
以"tetravalent live attenuated dengue vaccine [All Fields] or CYD-TDV [All Fields] or immunogenicity [All Fields] or vaccine efficacy [All Fields] or vaccine safety [All Fields] and randomized controlled trials [All Fields] and RCT [All Fields]and English [lang] and 2000[Date-Publication]:3000[Date-Publication]"为检索策略,检索美国国家医学图书馆数据库(NCBI),Cochrane协作网图书馆等外文电子数据库。
浏览特别相关的期刊,如《中国疫苗和免疫》和Vaccine等,查阅所获资料的参考文献。
国内外已公开发表有关CYD-TDV免疫原性、VE及安全性的文献中的试验组和对照组受试者。
RCT研究:试验组接种CYD-TDV,对照组接种安慰剂或其他疫苗;接种程序为3剂次,每剂次间隔至少6个月。
①免疫原性:采用蚀斑减少中和试验结果。比较全程免疫28 d后,试验组和对照组之间4种疫苗株的中和后蚀斑减少50%的血清最高稀释度为中和抗体几何平均滴度(GMT)差异。②VE:使用试验组和对照组中针对4个型别的登革热发病率计算VE。VE=(对照组发病率-试验组发病率)/对照组发病率。③安全性:比较试验组和对照组之间接种疫苗后不良反应的发生率。不良反应分为局部反应、全身反应以及异常反应。局部反应包括注射部位红肿、疼痛;全身反应包括乏力、头痛、肌痛、发热;严重异常反应指需要医疗干预、危及生命、死亡或遗留残疾的情况。
①观察性流行病学保护效果研究设计;②研究疫苗不是CYD-TDV;③研究对象为其他特殊人群(如免疫缺陷);④接种程序不是3剂次,或各剂次间隔<6个月;⑤测量指标不是免疫原性或VE或安全性;⑥文献未提供基础数据或数据不充分,无法重新计算测量指标或进行数据合并;⑦综述、讲座、评论类文献;⑧针对同一个人群由不同作者发表的文章或一稿多投重复报道。
由2名研究者独立进行纳入文献质量评估和交叉核对。根据纳入与排除标准阅读全文决定取舍。如遇分歧通过讨论或咨询第3人解决。
文献质量评价采用Cochrane协作网提供的文献偏倚评价工具[6]。采集文献中有关以下6个方面的信息:①随机分配方案的产生;②隐蔽分组;③双盲法;④结果评价盲法;⑤不完整结果数据;⑥选择性结果报告,从选择偏倚、实施偏倚、测量偏倚、失访偏倚和报告偏倚5方面评价纳入文献的偏倚风险。每个项目赋值1分,评分在≥5分属于高质量,3~4分属于中等,<3分属于低质量。
2名研究者独立提取资料,并将所提资料录入专门设计的数据提取表。资料提取内容包括:作者、发表时间、刊名、研究设计、观察对象年龄、随访时间、样本量、测量指标基础数据等。
用Excel 2013建立数据库,使用Stata 11.0进行Meta分析。纳入文献间的异质性采用I2检验,选取固定效应模型(I2<50%,P>0.05)或随机效应模型(I2>50%,P<0.05)。按照儿童、青少年和成人进行分层分析,采用各项研究合并后标准化均数差(SMD)及95%I2比较试验组和对照组间抗体GMT差异。采用各项研究合并后RR及95%CI比较试验组和对照组间登革热发病率和不良反应发生率差异。纳入文献中登革热发病率RR按照符合方案集分析结果和意向性分析结果分别计算合并效应值。采用Egger’s检验评估发表偏倚。
本研究共检索到922篇有关CYD-TDV免疫原性、VE和安全性的文献,经阅读标题、摘要,有852篇文献不符合纳入标准,4篇文献属于重复发表。全文阅读剩余66篇,共排除57篇文献,其中25篇非RCT研究设计,16篇所研究的登革热病毒疫苗不是CYD-TDV,12篇文献未提供必要基础数据或数据不完整,3篇为综述,1篇文献提供的CYD-TDV免疫程序不符合纳入标准,最终纳入Meta分析文献9篇[7,8,9,10,11,12,13,14,15]。
9篇文献中除2篇研究对象涉及18岁以上成人,其余7篇文献研究对象均为18岁以下儿童和青少年。所有纳入文献的随访时间均超过1年,其中有2篇随访时间达到25个月。有7篇文献报告了接种CYD-TDV后免疫原性结果,2篇文献报告了接种CYD-TDV后VE结果,所有文献均报告了接种CYD-TDV后疫苗安全性结果。纳入的9篇文献质量评分为6分,均属高质量文献,详见表1。
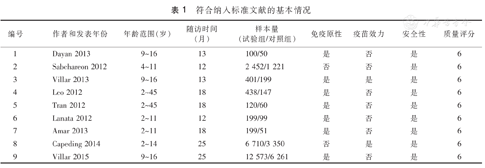
符合纳入标准文献的基本情况
符合纳入标准文献的基本情况
| 编号 | 作者和发表年份 | 年龄范围 (岁) | 随访时间 (月) | 样本量 (试验组/对照组) | 免疫原性 | 疫苗效力 | 安全性 | 质量评分 |
|---|---|---|---|---|---|---|---|---|
| 1 | Dayan 2013 | 9~16 | 13 | 100/50 | 是 | 否 | 是 | 6 |
| 2 | Sabchareon 2012 | 4~11 | 12 | 2 452/1 221 | 否 | 否 | 是 | 6 |
| 3 | Villar 2013 | 9~16 | 13 | 401/199 | 是 | 是 | 是 | 6 |
| 4 | Leo 2012 | 2~45 | 18 | 438/147 | 是 | 否 | 是 | 6 |
| 5 | Tran 2012 | 2~45 | 18 | 120/60 | 是 | 否 | 是 | 6 |
| 6 | Lanata 2012 | 2~11 | 12 | 199/99 | 是 | 否 | 是 | 6 |
| 7 | Amar 2013 | 2~11 | 18 | 199/51 | 是 | 否 | 是 | 6 |
| 8 | Capeding 2014 | 2~14 | 25 | 6 710/3 350 | 否 | 是 | 是 | 6 |
| 9 | Villar 2015 | 9~16 | 25 | 12 573/6 261 | 是 | 否 | 是 | 6 |
共有5篇文献报道了全程接种CYD-TDV的儿童和青少年28 d后免疫原性结果,经异质性检验,I2=64.2%,P<0.01,故采用随机效应模型。试验组和对照组间中和抗体GMT的SMD为0.62(95%CI:0.57~0.68),其中针对DENV1的SMD为0.38(95% CI:0.27~0.49),针对DENV2的SMD为0.61(95%CI:0.50~0.73),针对DENV3的SMD为0.67(95% CI:0.56~0.78),针对DENV4的SMD为0.84(95% CI:0.73~0.95),见图1。
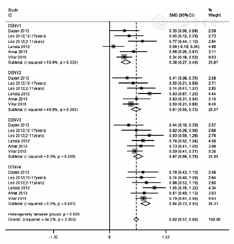

注:DENV:登革热病毒;CYD-TDV:四价重组登革热减毒活疫苗
共有2篇文献报道了全程接种CYD-TDV的成人28 d后的免疫原性结果,经异质性检验,I2=18.4%,P>0.05,故采用固定效应模型。试验组和对照组间中和抗体GMT的SMD为0.63(95%CI:0.55~0.71)。针对DENV1的中和抗体GMT的SMD为0.47(95% CI:0.30~0.63),针对DENV2的SMD为0.57(95% CI:0.40~0.73),针对DENV3的SMD为0.72(95% CI:0.56~0.89),针对DENV4的SMD为0.77(95%CI:0.60~0.93)。见图2。
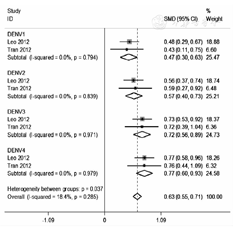

注:DENV:登革热病毒;CYD-TDV:四价重组登革热减毒活疫苗
共有2篇文献报道了全程接种CYD-TDV后VE符合方案集分析结果,经异质性检验,I2=72.2%,P<0.05,故采用随机效应模型。试验组和对照组间登革热发病率的RR为0.40(95%CI:0.34~0.46),VE为60%(95%CI:54%~66%)。针对DENV1的登革热发病率的RR为0.50(95% CI:0.39~0.64),VE为50%(95% CI:36%~61%);针对DENV2的RR为0.60(95% CI:0.45~0.81),VE为40%(95% CI:19%~55%);针对DENV3的RR为0.25(95% CI:0.18~0.35),VE为75%(95%CI:65%~82%);针对DENV4的RR为0.23(95% CI:0.16~0.35),VE为77%(95%CI:65%~84%)。见图3。
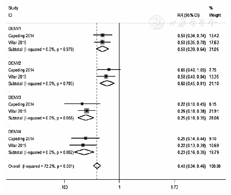

注:DENV:登革热病毒;CYD-TDV:四价重组登革热减毒活疫苗
共有2篇文献报道了全程接种CYD-TDV后VE的意向性分析结果,经异质性检验,I2=81.3%,P<0.01,故采用随机效应模型。试验组和对照组间登革热发病率的RR为0.39(95%CI:0.35~0.44),VE为61%(95% CI:56%~65%)。针对DENV1的RR为0.45(95%CI:0.38~0.55),VE为55%(95%CI:45%~62%);针对DENV2的RR为0.57(95% CI:0.46~0.71),VE为43%(95%CI:29%~54%);针对DENV3的RR为0.28(95%CI:0.22~0.37),VE为72%(95% CI:63%~78%);针对DENV4的RR为0.23(95%CI:0.17~0.31),VE为77%(95%CI:69%~83%)。见图4。
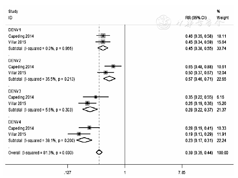

注:DENV:登革热病毒;CYD-TDV:四价重组登革热减毒活疫苗
共有6篇文献报道了试验组和对照组间局部反应发生率的差异,其中红肿的发生率组间差异有统计学意义(P<0.01)。严重异常反应的发生率组间差异有统计学意义(P<0.05),详见表2。
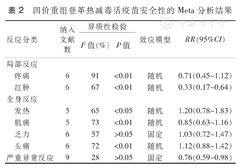
四价重组登革热减毒活疫苗安全性的Meta分析结果
四价重组登革热减毒活疫苗安全性的Meta分析结果
| 反应分类 | 纳入 文献 数 | 异质性检验 | 效应模型 | RR(95%CI) | ||
|---|---|---|---|---|---|---|
| I2值 (%) | P值 | |||||
| 局部反应 | ||||||
| 疼痛 | 6 | 91 | <0.01 | 随机 | 0.71(0.45~1.12) | |
| 红肿 | 6 | 67 | <0.01 | 随机 | 0.33(0.17~0.64) | |
| 全身反应 | ||||||
| 发热 | 5 | 65 | <0.05 | 随机 | 1.20(0.78~1.83) | |
| 肌痛 | 5 | 73 | <0.01 | 随机 | 0.85(0.63~1.16) | |
| 乏力 | 6 | 57 | >0.05 | 固定 | 1.03(0.72~1.47) | |
| 头痛 | 6 | 72 | <0.01 | 随机 | 1.12(0.88~1.42) | |
| 严重异常反应 | 9 | 28 | >0.05 | 固定 | 0.76(0.59~0.98) | |
采用Egger’s检测法对纳入儿童和青少年组免疫原性、成人组免疫原性、符合方案集分析VE、意向性分析VE以及疫苗安全性分析的文献进行发表偏倚评价,未见显著发表偏倚。
本研究发现试验组产生的针对4型DENV中和抗体GMT水平均高于对照组,说明疫苗有良好的免疫原性。但同时我们发现无论在儿童、青少年或是成人中,针对DENV3和DENV4的中和抗体GMT水平均高于DENV1和DENV2。这导致在VE评价中针对这两个血清型病毒的保护效力分别只有55%和43%。Hedinegoro等[16]在对CYD-TDV受种者进行安全性观察中发现,既往接种CYD-TDV的登革热患者绝大部分是感染DENV1或DENV2。既往报道和本次研究均说明CYD-TDV并未能够对4型DENV提供均衡的保护。由于感染DENV2后发生登革出血热或登革休克综合征的概率是感染其他型别的2倍[17],所以针对DENV2的免疫原性和VE偏低这一缺陷所致的问题更加突出。如在开展CYD-TDV大规模接种后因有部分受种者可能是低水平应答,因此一旦有DENV2病例输入后并在抗体依赖的感染性增强作用下,可能会导致这部分人群重症登革热病例的上升,这也是WHO建议对所有CYD-TDV受种者进行长期安全性观察的原因[18]。
本研究的另一个发现是针对DENV1和DENV2两个型别开展免疫原性和VE分析产生了相互矛盾的结果:在免疫原性分析结果中DENV2产生的中和抗体GMT水平高于DENV1,但在VE分析中DENV2的VE却低于DENV1。这个现象可能与以下2个原因有关:(1)目前已证明外环境中DENV2可以在人体正常体温环境下(37 ℃)发生病毒E蛋白的结构改变[19],因此制备CYD-TDV中使用的DENV2可能和流行毒株之间存在差异。所以通过接种CYD-TDV获得的针对DENV2的抗体可能无法中和流行毒株,影响了CYD-TDV针对DENV2的VE。(2)另一个原因是Villar等[15]认为CYD-TDV产生的中和抗体水平不能直接反映其VE,其结论依据是目前学术界对蚀斑减少中和试验测试CYD-TDV免疫原性的结果稳定性存有异议,如Thomas等[20]和Rainwater-Lovett等[21]分别报道了该试验在不同条件下测试获得结果差别较大。所以,Thomas等[20]认为针对DENV2的中和抗体可能无实际保护效果,又或者判定DENV2抗体阳转的临界值与其他型别不相同,如Buddhari等[22]认为与其他型别的DENV相比,更高的中和抗体滴度才能获得针对DENV2的有效保护力。
本研究未发现CYD-TDV接种组中局部反应和全身反应发生概率显著高于对照组,而且试验组发生严重异常反应的概率低于对照组。Gailhardou等[23]在一项针对CYD-TDV安全性的综述中发现2~60岁受种者最常见的不良反应包括注射部位疼痛、消化道紊乱等。WHO报告2~5岁的CYD-TDV受种者在接种第1剂后的3年随访期内,发生登革热的概率增高[24]。此外,由于9岁以下儿童接种CYD-TDV免疫效果较差的原因,WHO不建议在2~5岁儿童中进行接种,并同时建议6~8岁儿童谨慎使用。
本研究中,关于CDY-TDV免疫原性、VE和安全性的文献仅有9篇。这一方面可能与严格的纳入排除标准有关,导致大量非RCT设计文献被排除;另一方面可能也于该疫苗应用时间较短有关。今后有必要在积累更多类似研究后,继续进行CDY-TDV免疫原性、VE和安全性的系统评价。此外,开展有关接种CDY-TDV卫生经济学评价也是有价值的研究方向[25]。上述研究结果将为CDY-TDV引入中国市场应用提供客观的决策依据。综上所述,CYD-TDV有良好的免疫原性、VE和安全性,但CYD-TDV并未能够对4型DENV提供均衡的保护,因此有必要加强研究尽快开发一种能提供针对4型DENV均衡保护且安全的疫苗。



























