
探讨慢加急性肝衰竭(ACLF)患者并发上消化道出血的危险因素。
选择2010—2018年新疆医科大学第一附属医院住院诊断为ACLF患者154例;根据上消化道出血与否分为出血组54例和未血组100例。收集患者的一般临床资料、实验室及影像学检查等资料,多因素Logistic回归分析方法分析ACLF并发上消化道出血的危险因素。
单因素分析显示:并发症(肝性脑病、肝肾综合征),胃底静脉曲张(重度)、中性粒细胞百分比、D-二聚体、纤维蛋白(原)降解产物、总蛋白、降钙素原、门静脉宽度、IL-6等指标差异均有统计学意义(χ2=8.035、6.404、48.06,Z=-3.391、-5.017、-5.118、-3.698、-2.367、-2.961、-6.310,P<0.05)。多因素Logistic回归分析显示,纤维蛋白(原)降解产物(OR=0.947,95%CI:0.923~0.973)、胃底静脉曲张(重度)(OR=30.502,95%CI:10.006~92.978)为ACLF并发上消化道出血的独立危险因素。
临床应重视纤维蛋白(原)降解产物增多,以及重度胃底静脉曲张的ACLF患者,及时进行干预以尽量避免患者并发上消化道出血。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢加急性肝衰竭(ACLF)是指在慢性肝病基础上由多种因素引起的严重肝脏损害,从而导致肝脏合成、解毒、代谢和生物转化功能严重障碍,短期内出现急性肝功能失代偿和肝功能衰竭[1]。其发病特点与慢性肝病或失代偿肝硬化不同,常伴有多种器官功能衰竭[2]。上消化道出血是ACLF常见和严重的并发症之一,因起病急、发展快,出血量大,易导致周围血液循环功能衰竭等特点,病死率很高。目前国内外ACLF合并上消化道出血相关文献鲜少,为了解其发生发展,我们分析了这类患者的相关危险因素,为临床早期干预提供参考。
选择2010年1月至2018年12月新疆医科大学第一附属医院住院明确诊断为ACLF患者154例。所有病例均符合肝衰竭诊治指南(2018版)[1]诊断标准:(1)ACLF在慢性肝病基础上,由各种诱因引起以急性黄疸加深、凝血功能障碍为肝衰竭表现的综合征,可合并包括肝性脑病、腹水、电解质紊乱、感染、肝肾综合征、肝肺综合征等并发症,以及肝外器官功能衰竭;患者黄疸迅速加深,血清TBil≥10×ULN或每日上升≥17.1 μmol/L;有出血表现,凝血酶原活动度(PTA)≤40%[或国际标准化比值(INR)≥1.5]。
上述患者根据消化道是否出血分为出血组(54例)和未出血组(100例)。出血诊断标准:(1)有呕血、黑便以及失血性周围性循环衰竭的临床表现(或经过电子胃镜明确诊断为上消化道出血);(2)实验室指标中红细胞计数、血红蛋白、红细胞压积进行性下降;(3)临床资料完整(包括现病史、既往史、个人史、体格检查、实验室检查、影像学检查、治疗方案);(4)符合ACLF诊断并同时符合(1)(2)(3)者。排除标准:(1)疑似呼吸道疾患导致咯血及口腔、鼻出血患者;(2)出血来自中、下消化道;(3)药物或食物引起的黑便;(4)合并心、脑、肾等其他脏器严重疾病;(5)消化系统肿瘤及其他疾病导致的上消化道出血。
患者胃底食管静脉曲张程度分级依据食管胃静脉曲张内镜下诊断和治疗规范试行方案(2003年)[3]。食管静脉曲张程度分级:轻度指静脉曲张呈直线型或略有迂曲无红色征;中度指静脉曲张呈直线型或略有迂曲有红色征、静脉曲张呈蛇形迂曲隆起无红色征;重度指静脉曲张呈蛇形迂曲隆起有红色征,静脉曲张呈串珠状、结节状或瘤状有或无红色征。胃底静脉曲张程度分级:轻度指胃贲门部的静脉曲张;中度指胃贲门胃底部的静脉曲张;重度指胃底部孤立(或瘤样)的静脉曲张。
使用自行设计的《终末期肝病病人个案调查表》进行调查研究,回顾性分析154例患者的人口学特征(如年龄、性别等)、临床特征(如肝病病因、并发症等)、实验室指标(如中性粒细胞百分比等)、影像学检查(如胃镜、腹部超声等)共19个指标,并比较这些指标在出血组和未出血组间的水平差异。
应用SPSS 17.0统计软件处理,计数资料采用率或构成比表示,组间比较采用χ2检验,等级资料采用秩和检验。不符合正态分布的计量资料以M(Q25,Q75)表示,采用秩和检验。采用多因素Logistic回归分析方法分析ACLF并发上消化道出血的危险因素。P<0.05为差异有统计学意义。
出血组54例,其中男性39例,女性15例,年龄(50.11±15.86)岁,范围21~77岁;未出血组100例,男性74例,女性26例,年龄(47.67±10.23)岁,范围28~76岁。单因素分析结果显示,并发症(肝性脑病、肝肾综合征),胃底静脉曲张程度、中性粒细胞百分比、D-二聚体、纤维蛋白(原)降解产物、总蛋白、降钙素原、门静脉宽度、IL-6等指标差异有统计学意义(χ2=8.035、6.404、48.06,Z=-3.391、-5.017、-5.118、-3.698、-2.367、-2.961、-6.310,P<0.05)。见表1和表2。
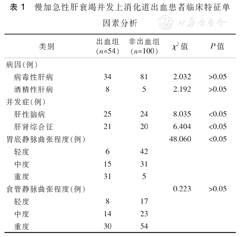
慢加急性肝衰竭并发上消化道出血患者临床特征单因素分析
慢加急性肝衰竭并发上消化道出血患者临床特征单因素分析
| 类别 | 出血组(n=54) | 非出血组(n=100) | χ2值 | P值 | |
|---|---|---|---|---|---|
| 病因(例) | |||||
| 病毒性肝病 | 34 | 81 | 2.032 | >0.05 | |
| 酒精性肝病 | 8 | 5 | 2.192 | >0.05 | |
| 并发症(例) | |||||
| 肝性脑病 | 25 | 24 | 8.035 | <0.05 | |
| 肝肾综合征 | 21 | 20 | 6.404 | <0.05 | |
| 胃底静脉曲张程度(例) | 48.060 | <0.05 | |||
| 轻度 | 6 | 42 | |||
| 中度 | 15 | 31 | |||
| 重度 | 31 | 5 | |||
| 食管静脉曲张程度(例) | 0.223 | >0.05 | |||
| 轻度 | 8 | 17 | |||
| 中度 | 14 | 23 | |||
| 重度 | 30 | 54 | |||
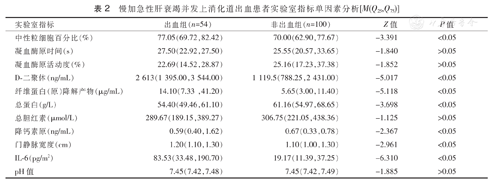
慢加急性肝衰竭并发上消化道出血患者实验室指标单因素分析[M(Q25,Q75)]
慢加急性肝衰竭并发上消化道出血患者实验室指标单因素分析[M(Q25,Q75)]
| 实验室指标 | 出血组(n=54) | 非出血组(n=100) | Z值 | P值 |
|---|---|---|---|---|
| 中性粒细胞百分比(%) | 77.05(69.72,82.42) | 70.00(62.90,77.67) | -3.391 | <0.05 |
| 凝血酶原时间(s) | 27.50(22.92,27.50) | 25.55(20.57,33.65) | -1.840 | >0.05 |
| 凝血酶原活动度(%) | 22.69(14.52,28.87) | 25.16(17.23,37.38) | -1.852 | >0.05 |
| D-二聚体(ng/mL) | 2 613(1 395.00,3 544.00) | 1 119.5(788.25,2 431.00) | -5.017 | <0.05 |
| 纤维蛋白(原)降解产物(μg/mL) | 14.10(7.33,41.20) | 5.65(3.00,11.40) | -5.118 | <0.05 |
| 总蛋白(g/L) | 54.40(49.46,61.10) | 61.16(54.97,68.65) | -3.698 | <0.05 |
| 总胆红素(μmol/L) | 289.67(189.15,389.27) | 306.75(221.05,438.36) | -1.125 | >0.05 |
| 降钙素原(ng/mL) | 0.59(0.40,1.62) | 0.67(0.33,0.78) | -2.367 | <0.05 |
| 门静脉宽度(cm) | 1.20(1.10,1.30) | 1.10(1.00,1.30) | -2.961 | <0.05 |
| IL-6(pg/m2) | 83.53(33.48,190.70) | 19.17(11.39,37.25) | -6.310 | <0.05 |
| pH值 | 7.45(7.42,7.48) | 7.45(7.42,7.49) | -1.885 | >0.05 |
以ACLF是否并发上消化道出血为应变量,以单因素分析中有统计学意义的指标为因变量,对胃底静脉曲张程度(轻度、中度、重度)分层进行Logistic回归分析,发现纤维蛋白(原)降解产物是ACLF并发上消化道出血的保护因素,而重度胃底静脉曲张为其独立危险因素。详见表3。
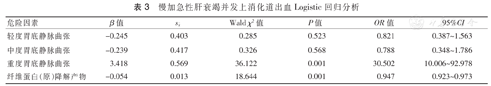
慢加急性肝衰竭并发上消化道出血Logistic回归分析
慢加急性肝衰竭并发上消化道出血Logistic回归分析
| 危险因素 | β值 | 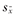 | Wald χ2值 | P值 | OR值 | 95%CI |
|---|---|---|---|---|---|---|
| 轻度胃底静脉曲张 | -0.245 | 0.403 | 0.285 | 0.523 | 0.821 | 0.387~1.563 |
| 中度胃底静脉曲张 | -0.239 | 0.417 | 0.326 | 0.568 | 0.788 | 0.348~1.786 |
| 重度胃底静脉曲张 | 3.418 | 0.569 | 36.122 | 0.001 | 30.502 | 10.006~92.978 |
| 纤维蛋白(原)降解产物 | -0.054 | 0.013 | 18.644 | 0.001 | 0.947 | 0.923~0.973 |
ACLF是慢性肝病基础上的急性恶化,导致全身多器官功能的衰竭,短期病死率高,上消化道出血为其主要的并发症之一。在本研究单因素分析中,中性粒细胞百分比、降钙素原、IL-6为ACLF并发上消化道出血的危险因素,考虑与肝脏出现特殊的炎症反应,发生免疫功能紊乱及炎症因子风暴,易出现细菌、真菌等病原微生物的感染有关[4,5]。D-二聚体也是单因素危险因素,在ACLF患者由于肝细胞大量坏死,肝脏微循环障碍,导致凝血因子合成减少,消耗增加[6]。肝功能中总蛋白等指标是反应肝脏功能合成最常用的指标,总蛋白越低提示ACLF程度越重,发生上消化道出血的风险就越大。有研究发现上消化道出血与肝性脑病相互影响,可能上消化道出血与中枢神经功能失调有关[7]。而肝肾综合征是发生在严重肝病基础上的肾功能衰竭[8],体内毒素堆积,容易导致上消化道黏膜及血管产生炎症反应,曲张的静脉破裂出血。我们的分析结果也表明肝性脑病及肝肾综合征与上消化道出血密切相关。
Logistic回归分析发现纤维蛋白(原)降解产物是ACLF并发上消化道出血的保护因素。在ACLF患者中,由于广泛的肝细胞坏死,凝血因子合成不足且被大量消耗,从而导致患者凝血功能紊乱衰竭,纤维蛋白原激活,纤维蛋白原降解为纤维蛋白,而此时抗纤溶系统激活,纤溶酶溶解纤维蛋白,从而导致纤维蛋白(原)降解产物增多。Zhao等[9]报道ACLF患者通常表现为止血功能受损,包括凝血酶指标的变化,积极补充凝血因子,维持凝血及纤溶系统的平衡,能够一定程度上避免上消化道出血的发生。
在本研究中胃底静脉曲张程度进行分层统计发现,重度胃底静脉曲张是独立危险因素。近年来随胃镜技术发展[10],发现不少患者消化道出血为胃黏膜病变,好发于近端胃体及胃底,且多为隐匿性出血,病情危重者可危及生命。周仁正等[11]报道提示,上消化道出血直接取决于曲张静脉的厚度及张力,随着曲张程度的增加,血管的厚度的降低,曲张静脉受力不均增加,更容易发生出血。因此在ACLF患者入院后,在条件允许情况下尽可能行胃镜检查,发现上消化道出血危险因素,尤其是对胃底静脉曲张重度的患者进行早期临床干预,对改善患者预后有积极意义。
综上所述,纤维蛋白(原)降解产物升高、胃底静脉曲张重度是预测ACLF上消化道出血发生的独立危险因素,临床中应对ACLF患者进行相应的干预,早期积极探寻ACLF并发上消化道出血特点、识别高危因素,尽量避免出现上消化道出血的发生,改善患者预后。
所有作者均声明不存在利益冲突































