
评价成人接种13价肺炎球菌多糖结合蛋白疫苗(PPCV13)与23价肺炎球菌多糖疫苗(PPSV23)的免疫原性与安全性差异。
检索美国国家医学图书馆数据库(NCBI)和Cochrane协作网图书馆等数据库,将比较PPCV13和PPSV23的免疫原性和安全性的随机对照研究(RCT)纳入分析。合并计算抗菌调理吞噬活性的几何平均滴度(GMT)的比值(GMTR)和各类不良反应发生的相对危险度(RR)。
共纳入5篇RCT文献,PPCV13组在接种1个月后针对10个血清型(1、4、5、6A、6B、9V、18C、19A、19F、23F)的GMT水平显著高于PPSV23组(P均<0.05);接种PPCV13和PPSV23,14 d后总体局部反应发生率并无显著差异(RR=1.08, 95%CI:0.95~1.24),总体全身反应发生率并无显著差异(RR=0.97,95%CI:0.91~1.04)。
成人接种PPCV13与PPSV23的安全性无显著差异,但接种PPCV13可以产生更好的免疫应答效果。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺炎链球菌是世界范围内引起严重疾病的主要病原体之一,全球每年约有160万人死于肺炎链球菌感染。患有慢性基础疾病、免疫功能较弱的人群(如儿童和老年人)是肺炎链球菌感染的高危人群[1]。全球已经上市应用的肺炎链球菌疫苗有13价肺炎链球菌多糖结合蛋白疫苗(PPCV13)和23价肺炎链球菌多糖疫苗(PPSV23)[2]。目前,国内已引入上述两种疫苗,但国内发布的疫苗说明书规定PPCV13只能在6周龄至15月龄的儿童中使用,而PPSV23则可在2岁以上人群中使用。由于国内尚无PPCV13在成人中使用的经验,故缺乏制定PPCV13成人接种指导意见时所必须的免疫效果和安全性方面的基础数据,本研究通过检索国外文献并进行Meta分析,系统评价PPCV13在成人中的免疫效果与安全性,为今后制定国内成人PPCV13免疫策略提供循证依据。
本研究方法基于首选项报告系统综述和Meta分析方案(Preferred Reporting Items for Systematic Review and Meta-analysis Protocols)[3]。
以"13-valent pneumococcal conjugate vaccines [All Fields] or PCV13 [All Fields] or pneumococcal conjugate vaccines [All Fields] or immunogenicity [All Fields] orStreptococcus pneumoniae [All Fields] or safety [All Fields] or adverse events [All Fields] or side effects [All Fields] and adults [All Fields] and English [lang] and 2000 [Date - Publication] :3000[Date - Publication]"为检索策略,检索美国国家医学图书馆数据库(NCBI PubMed)和考克兰协作网图书馆(Cochrane Library)等外文电子数据。
浏览特别相关的期刊,如英文期刊Vaccine和Human Vaccines & Immunotherapeutics等。查阅所获资料的参考文献。
①研究设计为随机对照试验(RCT);②研究对象为≥18岁成人;③干预组接种1剂次PPCV13,对照组接种1剂次PPSV23;④测量指标为免疫原性和不良反应发生率,其中免疫原性指标指疫苗接种1个月后,分血清型别抗菌调理吞噬活性(OPA)的几何平均滴度(GMT);不良反应包括疫苗接种14 d后,局部反应(红肿、疼痛、肢体活动受限等)和全身反应[发热(>38 ℃)、乏力、头痛、寒颤、皮疹、呕吐、纳差、肌痛、关节痛等]。
①对照组接种安慰剂或非PPSV23;②研究对象为特殊人群(如免疫缺陷);③干预组和对照组疫苗接种剂次≥2;④同时接种其他疫苗;⑤测量指标是流行病学保护效果;⑥未提供基础数据或提供数据不充分;⑦综述、讲座、评论类文献或重复发表文献。
由2名研究者独立进行纳入文献质量评估和交叉核对。根据纳入与排除标准阅读全文决定取舍,如遇分歧通过讨论或咨询第三人解决。
采用考克兰协作网2016年发布的有关随机对照试验偏倚评价工具和非随机对照试验偏倚评价工具进行文献质量评价[4]。文献的偏倚风险和质量评价由2名研究者独立进行,如遇分歧通过讨论或咨询第三人解决。
评价指标包括:①随机分配方案的产生;②隐蔽分组;③双盲法;④结果评价盲法;⑤结果数据完整性;⑥结果报告完整性。纳入文献按照不同研究设计参照质量评价体系,各评价体系中每项指标赋值均为1分,故每篇文献质量评分范围是0~6分,其中5~6分属于高质量文献,3~4分属于中等质量文献,0~2分属于低质量文献。
2名研究者独立地提取资料,并将所提资料录入专门设计的数据提取表。
用Excel2013建立数据库,采用Stata 11.0进行Meta分析。纳入文献间的异质性采用I2检验进行分析,选取固定效应模型(I2<50%,P>0.05)或随机效应模型(I2>50%,P<0.05)。免疫原性指标采用各研究提供的OPA GMT数据,按照PCV13所含的13个血清型别合并计算干预组与对照组之间的GMT比值(GMTR)及95%CI;安全性指标采用各研究提供的局部反应和全身反应发生率数据合并计算干预组与对照组之间各类不良反应发生的相对危险度(RR)及95%CI。在计算上述指标后,本研究按照研究对象既往有无肺炎球菌感染肺炎病史和年龄(<65岁或≥65岁)进行分层分析。采用Egger法评估发表偏倚。
本研究共检索到158篇有关PPCV13和PPSV23免疫原性和安全性的文献。最终纳入Meta分析文献5篇[5,6,7,8,9],见表1。纳入的5篇文献均为高质量(6分)的RCT研究,研究周期4~24年,研究对象为50岁以上成人,女性占48.7%~57.1%,慢性病患病率18.6%~42.7%(表1)。
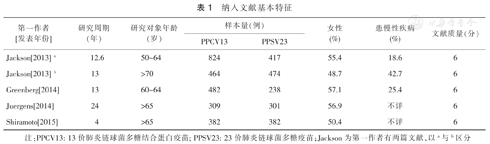
纳入文献基本特征
纳入文献基本特征
| 第一作者[发表年份] | 研究周期(年) | 研究对象年龄(岁) | 样本量(例) | 女性(%) | 患慢性疾病(%) | 文献质量(分) | |
|---|---|---|---|---|---|---|---|
| PPCV13 | PPSV23 | ||||||
| Jackson[2013] a | 12.6 | 50~64 | 824 | 417 | 55.4 | 18.6 | 6 |
| Jackson[2013] b | 13 | >70 | 464 | 474 | 48.7 | 42.7 | 6 |
| Greenberg[2014] | 13 | 60~64 | 482 | 238 | 57.1 | 25.4 | 6 |
| Juergens[2014] | 24 | >65 | 309 | 301 | 56.9 | 不详 | 6 |
| Shiramoto[2015] | 4 | >65 | 382 | 382 | 50.4 | 不详 | 6 |
注:PPCV13: 13价肺炎链球菌多糖结合蛋白疫苗; PPSV23: 23价肺炎链球菌多糖疫苗;Jackson为第一作者有两篇文献,以a与b区分
纳入文献以不同血清型分组计算异质性,发现针对9V、14、18C和19A四个血清型免疫原性差异数据无异质性(I2=0),其他9个血清型免疫原性差异数据存在显著异质性(I2>50%)(表2)。
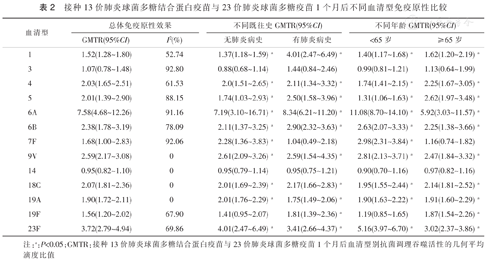
接种13价肺炎球菌多糖结合蛋白疫苗与23价肺炎球菌多糖疫苗1个月后不同血清型免疫原性比较
接种13价肺炎球菌多糖结合蛋白疫苗与23价肺炎球菌多糖疫苗1个月后不同血清型免疫原性比较
| 血清型 | 总体免疫原性效果 | 不同既往史GMTR(95%CI) | 不同年龄GMTR(95%CI) | |||
|---|---|---|---|---|---|---|
| GMTR(95%CI) | I2(%) | 无肺炎病史 | 有肺炎病史 | <65岁 | ≥65岁 | |
| 1 | 1.52(1.28~1.80) | 52.74 | 1.37(1.18~1.59) a | 4.01(2.47~6.49) a | 1.40(1.17~1.68) a | 1.62(1.20~2.19) a |
| 3 | 1.07(0.78~1.48) | 92.80 | 0.88(0.68~1.14) | 1.44(0.84~2.46) | 0.99(0.81~1.21) | 1.13(0.64~1.99) |
| 4 | 2.03(1.65~2.51) | 61.53 | 2.0(1.51~2.65) a | 2.11(1.34~3.32) a | 1.74(1.41~2.15) a | 2.25(1.67~3.05) a |
| 5 | 2.01(1.39~2.90) | 88.15 | 1.74(1.03~2.93) a | 2.50(1.58~3.96) a | 1.31(1.06~1.63) a | 2.62(1.97~3.48) a |
| 6A | 7.58(4.68~12.26) | 91.16 | 7.19(3.10~16.71) a | 8.34(6.21~11.20) a | 11.08(8.70~14.10) a | 5.92(3.03~11.57) a |
| 6B | 2.38(1.78~3.19) | 78.09 | 2.11(1.37~3.25) a | 2.90(2.32~3.63) a | 2.63(2.07~3.33) a | 2.25(1.38~3.66) a |
| 7F | 1.68(1.00~2.83) | 92.06 | 2.28(1.36~3.83) a | 1.04(0.49~2.18) | 2.98(2.31~3.84) a | 1.16(0.74~1.82) |
| 9V | 2.59(2.17~3.08) | 0 | 2.61(2.09~3.26) a | 2.59(1.54~4.35) a | 2.81(2.13~3.71) a | 2.47(1.84~3.32) a |
| 14 | 0.95(0.82~1.10) | 0 | 0.95(0.79~1.14) | 0.95(0.75~1.21) | 0.90(0.70~1.16) | 0.97(0.82~1.16) |
| 18C | 2.07(1.81~2.36) | 0 | 2.01(1.69~2.39) a | 2.17(1.66~2.83) a | 1.95(1.55~2.44) a | 2.14(1.81~2.52) a |
| 19A | 1.90(1.72~2.11) | 0 | 2.01(1.76~2.29) a | 1.75(1.49~2.06) a | 1.90(1.63~2.22) a | 1.91(1.60~2.29) a |
| 19F | 1.56(1.20~2.02) | 67.90 | 1.41(0.95~2.07) | 1.81(1.39~2.36) a | 1.19(0.85~1.65) | 1.87(1.54~2.26) a |
| 23F | 3.72(2.79~4.94) | 69.86 | 4.01(2.47~6.49) a | 3.41(2.66~4.37) a | 5.16(3.97~6.70) a | 3.02(2.37~3.86) a |
注:a:P<0.05;GMTR:接种13价肺炎球菌多糖结合蛋白疫苗与23价肺炎球菌多糖疫苗1个月后血清型别抗菌调理吞噬活性的几何平均滴度比值
按照PCV13覆盖血清型别分组合并计算PPCV13与PPSV23诱导的OPA抗体GMTR,发现PPCV13组在接种1个月后针对10个血清型(1、4、5、6A、6B、9V、18C、19A、19F和23F)的GMT水平显著高于PPSV23组(P均<0.05)。
根据既往有无肺炎球菌感染肺炎的病史分组,并分血清型合并计算PPCV13与PPSV23诱导的OPA抗体GMTR:(1)在既往无肺炎球菌感染肺炎组中,PPCV13组在接种1个月后针对10个血清型(1、4、5、6A、6B、7F、9V、18C、19A、和23F)的GMT水平高于PPSV23组(P均<0.05);(2)在既往有肺炎球菌感染肺炎组中,PPCV13组在接种1个月后针对10个血清型(1、4、5、6A、6B、9V、18C、19A、19F和23F)的GMT水平高于PPSV23组(P均<0.05)。
根据不同年龄分组,并分血清型合并计算PPCV13与PPSV23诱导的OPA抗体GMTR:(1)在<65岁组中,PPCV13组在接种1个月后针对10个血清型(1、4、5、6A、6B、7F、9V、18C、19A和23F)的GMT水平高于PPSV23组(P均<0.05);(2)在≥65岁组中,PPCV13组在接种1个月后针对10个血清型(1、4、5、6A、6B、9V、18C、19A、19F和23F)的GMT水平高于PPSV23组。
纳入文献以局部反应和全身反应分组计算异质性,发现在局部反应组内数据存在明显异质性(I2=85.5%),全身反应组内数据无异质性(I2=49.2%)(表3)。接种PPCV13和PPSV23的14 d,后总体局部反应发生率并无显著差异(RR=1.08,95%CI:0.95~1.24),总体全身反应发生率并无显著差异(RR=0.97,95%CI:0.91~1.04),按照不同局部反应或全身反应分组计算接种两种疫苗组间不良反应发生率无显著差异(P均>0.05)。
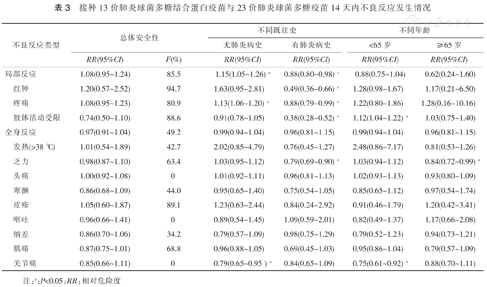
接种13价肺炎球菌多糖结合蛋白疫苗与23价肺炎球菌多糖疫苗14天内不良反应发生情况
接种13价肺炎球菌多糖结合蛋白疫苗与23价肺炎球菌多糖疫苗14天内不良反应发生情况
| 不良反应类型 | 总体安全性 | 不同既往史 | 不同年龄 | ||||
|---|---|---|---|---|---|---|---|
| 无肺炎病史 | 有肺炎病史 | <65岁 | ≥65岁 | ||||
| RR(95%CI) | I2(%) | RR(95%CI) | RR(95%CI) | RR(95%CI) | RR(95%CI) | ||
| 局部反应 | 1.08(0.95~1.24) | 85.5 | 1.15(1.05~1.26) a | 0.88(0.80~0.98) a | 0.88(0.75~1.04) | 0.62(0.24~1.60) | |
| 红肿 | 1.20(0.57~2.52) | 94.7 | 1.63(0.95~2.81) | 0.49(0.36~0.66) a | 1.28(0.98~1.67) | 1.17(0.21~6.50) | |
| 疼痛 | 1.08(0.95~1.23) | 80.9 | 1.13(1.06~1.20) a | 0.88(0.79~0.99) a | 1.22(0.80~1.86) | 1.28(0.16~10.16) | |
| 肢体活动受限 | 0.74(0.50~1.10) | 88.6 | 0.91(0.78~1.05) | 0.38(0.28~0.52) a | 1.12(1.04~1.22) a | 1.03(0.75~1.40) | |
| 全身反应 | 0.97(0.91~1.04) | 49.2 | 0.99(0.94~1.04) | 0.96(0.81~1.15) | 0.99(0.94~1.04) | 0.96(0.81~1.15) | |
| 发热(>38 ℃) | 1.01(0.54~1.89) | 42.7 | 2.02(0.85~4.79) | 0.76(0.45~1.27) | 2.48(0.86~7.17) | 0.81(0.53~1.26) | |
| 乏力 | 0.98(0.87~1.10) | 63.4 | 1.03(0.95~1.12) | 0.79(0.69~0.90) a | 1.03(0.94~1.12) | 0.84(0.72~0.99) a | |
| 头痛 | 1.00(0.92~1.08) | 0 | 1.01(0.92~1.11) | 0.96(0.81~1.13) | 1.02(0.93~1.13) | 0.93(0.80~1.09) | |
| 寒颤 | 0.86(0.68~1.09) | 44.0 | 0.95(0.65~1.40) | 0.75(0.54~1.05) | 0.85(0.65~1.12) | 0.97(0.54~1.74) | |
| 皮疹 | 1.05(0.60~1.87) | 89.1 | 1.23(0.63~2.44) | 0.84(0.24~2.92) | 0.91(0.46~1.79) | 1.20(0.42~3.41) | |
| 呕吐 | 0.96(0.66~1.41) | 0 | 0.89(0.54~1.45) | 1.09(0.59~2.01) | 0.82(0.49~1.37) | 1.17(0.66~2.08) | |
| 纳差 | 0.86(0.70~1.06) | 34.2 | 0.79(0.57~1.09) | 0.98(0.75~1.29) | 0.79(0.52~1.23) | 0.94(0.73~1.21) | |
| 肌痛 | 0.87(0.75~1.01) | 68.8 | 0.96(0.88~1.05) | 0.69(0.45~1.03) | 0.95(0.86~1.04) | 0.79(0.57~1.09) | |
| 关节痛 | 0.85(0.66~1.11) | 0 | 0.79(0.65~0.95 ) a | 0.84(0.65~1.09) | 0.75(0.61~0.92) a | 0.88(0.70~1.11) | |
注:a:P<0.05;RR:相对危险度
按照研究对象既往有无肺炎球菌感染肺炎病史分组,并分不良反应类型计算:(1)在既往无肺炎球菌感染肺炎病史组中,总体局部反应和疼痛等不良反应在PPCV13组中发生率高于PPSV23组(P均<0.05);(2)在既往有肺炎球菌感染肺炎病史组中,总体局部反应、红肿、疼痛、肢体活动受限、乏力等不良反应PPCV13组中发生率低于PPSV23组(P均<0.05)。
按照研究对象年龄分组,并分不良反应类型计算:(1)在<65岁组中,肢体活动受限、关节痛等不良反应在PPCV13组中和PPSV23组有差异(P均<0.05);(2)在≥65岁组中,乏力在PPCV13组中发生率低于PPSV23组(P均<0.05)。
对纳入文献(数据)进行Egger法分析,未见发表偏倚(P>0.05)。
本研究对比了免疫功能正常的成人接种PPCV13和PPSV23免疫原性和安全性方面的差异。相比于PPSV23,接种PPCV13后诱导的针对PPCV13覆盖的10个血清型别的OPA抗体较高。按照既往是否有肺炎链球菌感染以及受种者年龄进行亚组分析,均提示PPCV13的免疫原性在大部分血清型别中均显著高于PPSV23。这一结果与既往研究相似,如美国和欧洲的部分研究证明老年人接种PPCV13诱导的相应血清型免疫应答等效或优于PPSV23[10,11]。另外,部分有关肺炎链球菌疫苗的流行病学保护效果研究证明,PPCV13在预防社区获得性肺炎、侵袭性或非侵袭性感染以及降低肺炎链球菌携带率等方面也优于PPSV23[12,13,14]。我们认为PPCV13和PPSV23免疫原性的差异主要是因为生产工艺的差别引起的免疫机制不同造成的。PPSV23主要抗原成分是荚膜多糖,该抗原属于非T细胞依赖性抗原,只能诱导生成亲和力较低的IgM抗体;PPCV13是用荚膜多糖与蛋白质共价结合,从而将荚膜多糖抗原由非T细胞依赖性抗原转变为T细胞依赖抗原,利用生发中心反应产生高亲和力的IgG抗体,且能产生记忆应答。
随着年龄增长,老年人因免疫系统功能下降,所以感染肺炎链球菌的风险不断增加,而且对PPSV23的免疫应答也会降低[15],而PPCV13未见此类现象。此外,也有研究认为多次接种(加强免疫)PPSV23对于提高其免疫效果作用有限,因此在老年人中使用PPCV13可获得更好的免疫应答效果[16]。
在安全性方面,PPCV13和PPSV23等已经上市的疫苗无论单独接种、与其他疫苗同时接种、复种的安全性都比较好,常见局部反应为疼痛、接种部位红肿等,常见全身反应为发热,症状轻微且具有自限性[17,18]。疫苗上市大规模使用后能观察到热性惊厥、川崎病等疾病报告,但尚未确定其因果关联[19]。本研究结果提示,成人接种PPCV13与PPSV23后常见的不良反应种类和发生率相似,成人接种PCV13后罕见不良反应或不良反应发生率均未显著高于接种PPSV23。
本研究纳入的文献为来自不同的RCT,存在因原始研究目的和结局指标不尽相同而造成的Meta分析结果偏倚;并且仅对成人接种PCV13和PPSV23的免疫原性进行评价,未评估两种疫苗在真实世界中疫苗接种的效果,故结果存在局限性。
综上,全球包括中国在内推荐老人年以及患有基础疾病的成人接种PPSV23,但因PPSV23在免疫原性方面仅能产生低亲和力和IgM以及缺乏免疫回忆反应,因此在降低成人肺炎链球菌感染的疾病负担方面的作用有限[10]。成人接种PPCV13可以产生更好的免疫应答,可以作为降低成人肺炎链球菌感染的疾病负担的一项重要补充。
所有作者均声明不存在利益冲突































