
肺肉瘤样癌是一类分化差的非小细胞肺癌,恶性程度高,预后差。安罗替尼是我国自主研发的多靶点抗肿瘤血管生成药物,被批准用于晚期非小细胞肺癌的三线治疗。我科收治1例晚期肺肉瘤样癌患者,应用安罗替尼治疗取得良好近期疗效。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
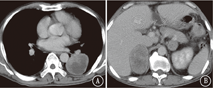
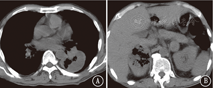
患者男,57岁,于2018年5月2日因"双侧颈部无痛性肿大淋巴结4个月"收入我院。既往吸烟史:吸烟30年,每天60支。入院查体:功能状态评分3分,双侧颈部触及多个肿大淋巴结,部分融合成团,最大直径约5 cm,质地硬,有压痛。左下肺呼吸音低,右侧腹部压痛,深触诊可触及肿物,大小6 cm×5 cm。左侧臀部可触及直径5 cm肿物。血常规:白细胞9.8×109/L,血红蛋白72 g/L,血小板677×109/L。肿瘤标志物:神经元特异性烯醇化酶21.91 ng/ml。肝肾功能及大、小便常规正常。骨髓穿刺活检:细胞形态未见异常,未见癌细胞;粒细胞、红细胞、巨核细胞增生活跃。颈部CT:鼻咽部未见异常,双侧颈部多发大小不等结节,考虑转移淋巴结。胸部CT:左肺下叶圆形软组织占位,边缘较光滑,未见分叶及毛刺,肿瘤大小63 mm×53 mm,内见坏死,增强扫描不均匀强化。纵隔肿大淋巴结,考虑转移。腹部CT:腹腔、双肾上腺肿物。右侧肾上腺明显,大小75 mm×53 mm,左侧肾下极与腰大肌分界不清,见图1。左侧臀部肿物,大小40 mm×51 mm,环周强化。颅脑磁共振成像、全身骨扫描未见异常。于2018年5月14日行左侧臀部切除活检:恶性肿瘤并坏死,免疫组织化学染色示:CKpan(+)、Vimentin(+)、CD3(-)、CD20(-)、CK7(-)、CK20(-)、Villin(-)、CK5/6(-)、P63(-)、NapsinA(-)、甲状腺转录因子-1(-)、Melan-A(-)、Melanoma(-)、CD30(-)、S100(-)、CD31(-)、Fli-1(-),不支持淋巴瘤、恶性黑色素瘤、血管源性肿瘤,不排除肉瘤样癌。2018年5月23日北京大学肿瘤医院会诊意见:支持肉瘤样癌。临床诊断:左肺肉瘤样癌伴颈部、纵隔、腹腔、盆腔淋巴结、双肾上腺、左臀部转移。输血治疗纠正贫血后于2018年6月5日开始口服安罗替尼抗肿瘤治疗(12 mg/d,第1~14天,21 d为1个周期)。2个周期后于2018年7月13日门诊复查颈部、胸、腹部CT:颈部、纵隔淋巴结较前略增大。左肺下叶肿块较前无明显变化,内见空洞。腹腔肿物较前略缩小,内见空洞。右侧肾上腺肿物较前略增大,内见空洞。左侧肾上腺肿物较前略增大,见图2。按照实体瘤疗效评价标准(RECIST)1.1版评价疗效为病情稳定。现继续安罗替尼靶向治疗中。


肺肉瘤样癌是一组分化差、恶性程度极高的具有肉瘤样分化或肉瘤样成分的非小细胞肺癌(non-small cell lung cancer,NSCLC)亚型,发生率极低,约占所有NSCLC的0.4%[1]。2015版世界卫生组织肺肿瘤分类将肺肉瘤样癌分为5个亚型:多形性癌、梭形细胞癌、巨细胞癌、癌肉瘤、肺母细胞瘤[2]。目前研究表明,肺肉瘤样癌起源于相同原始上皮,经过上皮间质转化形成不同亚型的恶性肿瘤[3]。因此肺肉瘤样癌既可表现出间叶肿瘤的组织学特征,又可以表现出上皮源性肿瘤特征。
肺肉瘤样癌多发于老年男性,男女比例为4∶1,平均发病年龄64岁,大部分患者有长期吸烟史[4,5]。多见于肺上叶,右上肺多见,70%的患者表现为周围型肺癌[6],肿瘤平均直径5 cm以上,多呈圆形或类圆形结节,表面较光滑,增强CT表现环周不均匀强化。PET-CT示肿瘤高代谢信号,平均标准摄取值(SUV)为14.3±3.1[6]。早期肺肉瘤样癌仍以手术切除为主,然而大部分肺肉瘤样癌患者确诊时已为晚期,无根治性手术切除指征。晚期肺肉瘤样癌患者的平均生存期仅3个月左右。含铂类的一线化疗方案仍是主要治疗手段,但是化疗有效率很低,70%的患者一线化疗后疾病进展,中位无进展生存期仅为2个月。即使化疗有效患者,其生存期也仅为6个月左右[7]。以吉非替尼为代表的分子靶向药物已经应用于表皮生长因子受体(EGFR)突变阳性的NSCLC患者。肺肉瘤样癌患者EGFR突变率低,不同文献报道EGFR突变率为2%~23.8%[8,9]。且肺肉瘤样癌患者常合并TP53、K-ras、磷脂酰肌醇3-激酶(PI3K)、人第10号染色体缺失的磷酸酶及张力蛋白同源基因(PTEN)等多基因突变,其中K-ras突变率高达39%,因此即使EGFR基因突变,应用EGFR-酪氨酸激酶抑制剂(TKI)类药物获益可能性也很小[9]。以程序性死亡蛋白-1(PD-1)/程序性死亡蛋白配体-1(PD-L1)为信号通路的免疫检查点抑制剂已经被批准用于治疗PD-L1阳性的晚期NSCLC的一线、二线治疗。肺肉瘤样癌患者PD-L1阳性率在50%~90%,明显高于NSCLC[10,11],并且肿瘤内部有明显T淋巴细胞浸润,提示PD-1、PD-L1抑制剂可能是治疗肺肉瘤样癌的有效药物。本例患者以颈部淋巴结肿大为首发症状,颈、胸、腹部CT显示颈部、腹腔多发淋巴结转移,双肾上腺、左臀部转移。左臀部肿物切除活检支持肉瘤样癌,患者诊断为左肺肉瘤样癌多发转移。综合肺肉瘤样癌分期晚、患者体能状态差、对化疗不敏感的特点,认为其化疗获益小,预后较差。建议患者参与上级医院临床试验,但患者不符合入选标准,上级医院建议尝试索拉非尼、舒尼替尼等靶向药物。
安罗替尼是我国自主研发的新一代抗肿瘤血管生成药物,已经被批准用于晚期NSCLC三线治疗。临床前研究显示,安罗替尼可以通过抑制血管内皮生长因子-A/血管内皮生长因子受体(VEGF-A/VEGFR)、成纤维细胞生长因子/成纤维细胞生长因子受体1(FGF/FGFR1)等多条信号途径抑制肿瘤血管生成,拮抗肿瘤生长和转移,并且比索拉非尼、舒尼替尼具有更强的抑制血管生成作用[12]。患者自2018年6月5日开始口服安罗替尼,2个周期后可见左肺及右肾上腺肿物内坏死、明显空洞形成,腹腔病灶略缩小并有小空洞形成,其余大部分病灶无明显增大,内部坏死较前不同程度增加。根据RECIST 1.1版评价为病情稳定。但根据Choi等[13]的标准,左肺及右肾上腺病灶评价部分缓解,颈部淋巴结、纵隔、腹腔淋巴结评价为病情稳定,总体评价为部分缓解。患者近期的临床获益能否转化为生存期获益,需要进一步观察。
所有作者均声明不存在利益冲突



























