
观察不同时期婴幼儿型血管瘤(infantile hemangioma,IH)中细胞外基质结构蛋白和基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)的表达和分布,探讨基质结构蛋白和MMP-9在IH中潜在的作用和意义。
收集手术切除的血管瘤标本,经HE染色和Glut-1免疫组织化学染色后确诊为IH;应用免疫组织化学染色MaxVision法检测各标本中Ⅳ型胶原(Col-Ⅳ)、层黏连蛋白(LN)、纤维连接蛋白(FN)和MMP-9的表达情况,通过Image-Pro Plus 6.0图像分析软件测量各组织中阳性染色区域的平均光密度(IOD)。按患儿年龄将标本分为年龄<3个月龄组,≥3~6个月组,≥6~9个月组,≥9~12个月组和≥12个月龄组5组。比较不同年龄组IH中基质结构蛋白和MMP-9表达的差异。
按标准纳入的IH共34例,其中月龄<3个月8例,≥3~6个月7例,≥6~9个月6例,≥9~12个月8例,≥12个月5例。观察免疫组织化学染色结果显示Col-Ⅳ、LN、FN和MMP-9在各年龄组中表达强度不同,比较IOD值显示IH组织中Col-Ⅳ在≥12个月龄组(84.90±12.48)的表达较其他各年龄组高,且与<3个月龄组(55.10±16.06)、≥3~6个月组(56.96±22.66)、≥6~9个月组(51.60±20.38)比较差异有统计学意义(P<0.05)。LN在≥9~12个月组(80.04±29.36)IH中表达最高,分别与<3个月龄组(38.02±9.88)、≥3~6个月组(68.62±16.19)、≥6~9个月组(60.67±10.72)、月龄≥12个月组(45.96±5.02)比较差异均有统计学意义(P<0.05)。FN在≥6~9个月组(62.86±15.41)IH中表达最高,分别与<3个月龄组(32.36±19.79)、≥3~6个月组(43.04±19.78)、≥9~12个月组(36.25±11.19)、月龄≥12个月组(27.57±13.90)比较差异有统计学意义(P<0.05)。MMP-9在<3个月龄组(73.23±18.19)IH组织中表达最高,并随年龄增长≥3~6个月组(59.31±12.85)、≥6~9个月组(35.80±7.50)、≥9~12个月组(26.89±10.21)、月龄≥12个月组(24.04±10.00)逐渐下降,其中<3个月龄组、≥3~6个月组IH与其他各组比较差异有统计学意义(P<0.05)。
不同时期IH组织中Col-Ⅳ、LN、FN和MMP-9的表达有差异,这种差异可能是影响IH增生和消退的重要因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
婴幼儿型血管瘤(infantile hemangioma,IH)是小儿最常见的良性肿瘤,在婴幼儿中的发病率高达10%[1]。其发病机制目前尚不完全清楚,研究提示细胞外基质(exreacellular matrix,ECM)在肿瘤发生发展及血管生成中发挥了重要作用[2]。基质结构蛋白是ECM的重要组成部分,其合成与分解平衡对维持局部组织结构和功能稳定有重要作用。基质结构蛋白包括Ⅳ型胶原(collagen type Ⅳ,Col-Ⅳ)、层粘连蛋白(laminin,LN)和纤维连接蛋白(fibronectin,FN)等。Col-Ⅳ是一种内皮基底膜上主要的基质蛋白,LN与血管内皮细胞相互作用可影响血管内皮细胞分化状态,FN是连接血管内皮细胞和其他成分的重要糖蛋白。基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)在血管生成中发挥了重要的作用,可通过降解细胞外基质蛋白为血管生成提供环境[3]。本研究通过免疫组织化学方法和Image-Pro Plus 6.0图像分析软件对不同年龄段IH组织中Col-Ⅳ、LN、FN和MMP-9进行检测,旨在探讨这些蛋白在IH病理演变过程中的可能变化,为进一步研究细胞外基质结构蛋白在IH发病中的作用提供参考。
收集2012年1月至2016年6月赣南医学院第一附属医院和河北省儿童医院血管瘤石蜡标本。查阅病史,排除经任何非手术治疗过的IH标本。HE染色、免疫组织化学MaxVision法检测葡萄糖转运蛋白1(glucose transporter, Glut-1),结合Mulliken[4]诊断标准,由两位副高职称以上的病理医生确诊。本研究共收集IH标本34例,其中男11例,女23例,年龄<3个月8例,≥3~6个月7例,≥6~9个月6例,≥9~12个月8例,≥12个月5例。
对入选的每个组织蜡块进行连续切片6张,厚4 μm,分别编号为1~6,然后进行如下实验。
取每个组织蜡块的1号切片,对其进行常规的HE染色,在光学显微镜下观察。
选取每个组织蜡块的2~6号切片。60 ℃恒温烤箱烤片4 h,二甲苯脱蜡,梯度乙醇至水,3%H2O2灭活阻断内源性过氧化物酶,柠檬酸盐缓冲液煮沸高压热修复法修复抗原,滴加一抗(2号片为Glut-1、3号片为Col-Ⅳ、4号片为LN、5号片为FN、6号片为MMP-9),4 ℃孵育过夜。滴加二抗,孵育30 min。DAB显色,苏木素复染核,盐酸酒精分化,无水乙醇脱水,二甲苯透明,中性树胶封片。以PBS液代替一抗作为阴性对照,已知的阳性组织作为阳性对照,Glut-1以细胞内着色为阳性,Col-Ⅳ、LN、FN和MMP-9以细胞质和(或)细胞外基质中出现棕黄色为阳性反应,不着色为阴性。
Col-Ⅳ、LN、FN和MMP-9免疫组织化学染色在不同瘤体中染色程度不同,本研究用光密度值进行半定量检测。切片于400倍光学显微镜下选取5个阳性最强的视野拍照,应用Image-Pro Plus 6.0图像分析软件测定所有照片阳性区域的平均光密度(IOD)。每张切片5个视野的平均值作为该例的IOD测量值。
采用SPSS 22.0统计软件进行统计学分析,计量资料采用 ±s表示,各组的均数比较采用单因素方差分析,两两比较采用LSD检验。P<0.05为差异有统计学意义。
±s表示,各组的均数比较采用单因素方差分析,两两比较采用LSD检验。P<0.05为差异有统计学意义。
观察HE染色切片,不同时期IH组织形态不同,增生期IH是由大量增生肥大的内皮细胞构成的毛细血管团块,血管腔隙不明显,甚至闭塞呈实性(图1A)。消退期内皮细胞数量减少,瘤体管腔化明显,血管管壁由扁平的内皮细胞围绕而成(图1B),肿瘤逐渐退化,瘤体由纤维脂肪组织取代,散在残留的脉管结构,类似正常血管,管壁基底膜增厚。
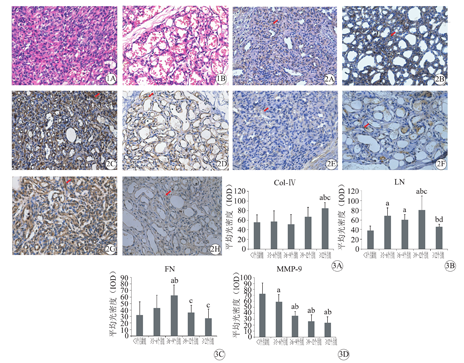

Col-Ⅳ表达于IH的内皮细胞和细胞外基质中,增生早期见局灶区域呈浅黄色(图2A),管腔明显形成后,阳性表达于血管管壁周围(图2B)。LN在IH组织中表达强弱不一,增生中晚期主要表达在细胞外基质(图2C),消退期血管瘤组织中LN在血管管壁周围阳性表达(图2D)。不同时期的IH组织中FN的表达和分布不同,增生期患儿标本中见FN主要表达于内皮细胞胞质(图2E),而在管腔化明显的标本中黄色区域主要定位在细胞间质(图2F)。MMP-9在增生期IH组织(图2G)中表达强度明显强于消退期IH组织(图2H)。
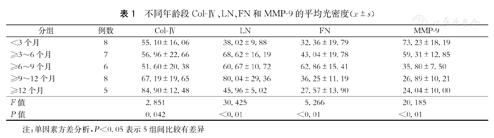
比较不同年龄段IH瘤体组织中Col-Ⅳ、LN、FN和MMP-9的半定量检测数据,结果见表1。≥12个月组的IH组织中Col-Ⅳ表达较其他各年龄组高,且与<3个月组、≥3~6个月组、≥6~9个月组比较差异有统计学意义(P<0.05),但与9~12个月组比较差异无统计学意义(P<0.05,图3A)。LN在≥9~12个月组IH中表达最高,与其他各组比较差异均有统计学意义(P<0.05),此外,≥3~6个月组与<3个月组、≥12个月组比较差异有统计学意义(P<0.05),≥6~9个月组与<3个月组比较差异有统计学意义(P<0.05,图3B)。FN在≥6~9个月组IH中表达较高,与其他各年龄组比较差异有统计学意义(P<0.05,图3C)。MMP-9在<3个月组IH组织中表达最高,并随年龄增长逐渐下降,其中<3个月龄组、≥3~6个月组IH与其他各组比较差异有统计学意义(P<0.05,图3D)。
不同年龄段Col-Ⅳ、LN、FN和MMP-9的平均光密度( ±s)
±s)
不同年龄段Col-Ⅳ、LN、FN和MMP-9的平均光密度( ±s)
±s)
| 分组 | 例数 | Col-Ⅳ | LN | FN | MMP-9 |
|---|---|---|---|---|---|
| <3个月 | 8 | 55.10±16.06 | 38.02±9.88 | 32.36±19.79 | 73.23±18.19 |
| ≥3~6个月 | 7 | 56.96±22.66 | 68.62±16.19 | 43.04±19.78 | 59.31±12.85 |
| ≥6~9个月 | 6 | 51.60±20.38 | 60.67±10.72 | 62.86±15.41 | 35.80±7.50 |
| ≥9~12个月 | 8 | 67.19±19.65 | 80.04±29.36 | 36.25±11.19 | 26.89±10.21 |
| ≥12个月 | 5 | 84.90±12.48 | 45.96±5.02 | 27.57±13.90 | 24.04±10.00 |
| F值 | 2.851 | 30.425 | 5.266 | 20.185 | |
| P值 | 0.042 | <0.01 | <0.01 | <0.01 |
注:单因素方差分析,P<0.05表示5组间比较有差异
IH是婴幼儿时期最常见的良性血管源性肿瘤,60%~80%患儿可自然消退,但其形成和消退的机制目前仍不清楚。IH主要病理演变过程表现为早期大量内皮细胞异常增殖,随后大量成熟的小血管结构形成,血管内皮细胞周围可见基底膜,消退完成期大量内皮细胞消失,纤维脂肪组织取代原有的血管结构。既往研究显示细胞外基质结构蛋白与IH增生和消退存在相关性[5]。
Col-Ⅳ是基底膜上最丰富的细胞外基质结构蛋白,主要构成并维持血管结构和功能的完整性[6]。Col-Ⅳ在血管生成中也扮演了重要的作用,在血管生成初期主要存在于血管床的细胞外基质,为内皮细胞增殖、粘附和迁移提供了依靠。研究发现,Col-Ⅳ可以提供细胞粘附的位点,这些位点被细胞表面的整合素特异性识别后,激活细胞内信号,参与细胞功能的调节[7]。我们的研究发现在≥12个月龄组的瘤体中Col-Ⅳ的表达最高,即在血管瘤消退期、血管腔隙明显形成时,为满足血管功能的需要,Col-Ⅳ的合成量显著增加。
LN是一类糖蛋白,由3条多肽链α、β和γ通过二硫键结合,是构成血管基底膜的主要成分。研究表明LN是内皮细胞周围的主要基质成分之一,可介导内皮细胞粘附在基膜上,影响内皮细胞的增殖、分化和迁移[8]。本研究发现LN在≥9~12个月组IH组织中表达较高,且与其他年龄组的差异有统计学意义,这表明LN在不同时期IH中的表达并不稳定,但在增生早、中期IH组织中LN的表达基本持平。在9~12个月组肿瘤中LN表达增高,可能是因为该时期为IH自然病程的消退早期,瘤体管腔化较明显,为维持管腔结构,LN合成明显增多。随着瘤体由增生逐渐转为消退,血管瘤内皮细胞由以增殖为主趋向凋亡[9]。所以,消退期合成LN的内皮细胞减少,导致进入消退期之后瘤体组织中LN表达减少。
FN是一种非胶原糖蛋白,由多个亚单位构成。分为血浆FN和细胞FN,细胞FN分布于细胞外基质和细胞表面,可由内皮细胞和成纤维细胞等产生,参与构成基底膜和细胞间质[10]。FN具有广泛的生物学功能,参与细胞的分化、胚胎的发生、组织的再生等过程,影响细胞的生物学活性,如细胞的粘附、形态、细胞骨架的形成和迁移。在IH组织中,FN将内皮细胞与周细胞、细胞外基质连接在一起,刺激血管内皮细胞形成毛细血管样结构,与内皮细胞生长、粘附和迁移有直接相关性[11]。此外,FN还通过增强细胞对生长因子作用的敏感性,在血管形成过程中起重要作用。本研究发现在≥6~9个月组IH组织中FN的表达量较高,此年龄段处于IH自然病程的增生晚期转入消退的时期,表明FN可能具有刺激血管瘤消退信号启动的作用。研究认为不成熟的血管由富含FN的基质组成,因此FN也被认为是血管未成熟的标志。FN为覆盖其上的内皮细胞提供激活新生血管管腔化的调节信息,有利于血管结构的形成[12]。我们的研究显示随着血管瘤逐渐消退,肿瘤管腔化明显,正常的血管结构呈现,FN的表达亦逐渐减少。
基质金属蛋白酶是一类依赖Ca2+、Zn2+的细胞外蛋白裂解酶,其中MMP-9在IH的病理演变进程中具有重要作用。MMP-9通过降解细胞外基质,不仅为内皮细胞迁移提供通道,同时也为血管瘤内皮细胞增殖创造了环境。MMP-9可促进细胞内生长因子和趋化因子的释放,释放的生长因子又可促进内皮细胞增殖并释放MMP-9,因此其在血管生成的过程中发挥着极其重要的作用[13]。研究发现增生期IH组织中MMP-9的表达显著增高,在消退期表达明显减少,说明其在IH中发挥了明显的作用[14]。本实验结果显示,随着IH病程的进展,MMP-9的表达逐渐减少。说明IH早期大量内皮细胞增生时,MMP-9大量合成并分泌到细胞外降解间质中的胶原蛋白、层粘连蛋白等,为内皮细胞的迁移清除屏障。近年研究表明,IH是起源于血管瘤干细胞的肿瘤,血管瘤干细胞增殖、迁移并可分化为血管内皮细胞和周细胞,血管形成是IH发生机制的重要组成部分[15]。早期MMP-9的大量激活也为血管瘤干细胞的迁移和增殖提供了环境。MMP-9表达逐渐减少,可能与合成MMP-9的细胞减少,同时促进MMP-9合成的细胞因子如血管内皮生长因子减少有关[16]。另一方面,MMP-9表达减少使得阻碍血管瘤内皮细胞迁移的蛋白降解也减少,抑制了内皮细胞的增殖,从而促进血管瘤的消退。
综上所述,Col-Ⅳ、LN、FN是构成IH细胞外基质的重要成分,在IH自然病程进展的不同时期表达有变化,不同的细胞外基质结构蛋白在不同时期的IH表达不同,表明Col-Ⅳ、LN、FN在IH中可能分别发挥了不同的作用,深入分析这些蛋白对IH肿瘤细胞的作用有助于阐明IH增生和消退的机制。MMP-9作为降解细胞外基质结构蛋白的主要蛋白酶,在不同时期IH组织中表达不同,对IH增生和消退有重要的影响。MMP-9可降解Col-Ⅳ、LN等细胞外基质结构蛋白,所以增生期IH中Col-Ⅳ表达量维持在一个较低的水平,可能与增生期大量的Col-Ⅳ被MMP-9降解有关。研究认为Col-Ⅳ在降解之后产生的片段可抑制内皮细胞的增殖、诱导内皮细胞的凋亡,因此血管瘤的消退可能跟Col-Ⅳ的降解产物有关。尽管增生早中期IH中内皮细胞密度高,合成LN的能力强,但因为此期MMP-9表达高,对LN的降解增加,所以组织中LN蛋白表达并无变化。此外,严格按照纳入标准,本文的IH标本有限,期待扩大合作,增加样本量以深入探讨基质结构蛋白在IH发生发展中的作用。
无



























