
越来越多的小儿复杂先天性心脏病需要应用牛颈静脉带瓣外管道来重建右心室流出道,本研究希望通过回顾性随访研究来评估牛颈静脉带瓣外管道的中远期功能。
回顾性分析2002年1月至2013年12月期间接受牛颈静脉带瓣外管道重建右心室流出道手术患儿53例。其中男33例,女20例;手术年龄1~142个月,中位数36个月;体重3.2~35.0 kg,平均(14.4±8.5) kg;术前SpO2为74%~99%,平均(85.1±6.5)%。术前诊断为肺动脉闭锁伴室间隔缺损33例,法洛四联症1例,主动脉瓣病变(狭窄或者反流)8例,完全性大动脉转位伴肺动脉狭窄7例,动脉单干4例。
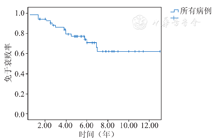
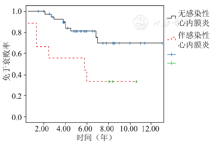
早期死亡2例,无晚期死亡。51例患儿得到了全面随访,其中15例出现牛颈静脉带瓣外管道的衰败,衰败率为29.4%,包括:外管道重度狭窄10例,狭窄伴反流3例,单纯反流2例。术后1、3、5、7年牛颈静脉带瓣外管道免于衰败率分别为98.0%(50/51)、85.8%(44/51)、76.8%(40/51)和62.1%(36/51),其中9例发生了感染性心内膜炎。未发生感染性心内膜炎患儿中,术后2、5、7年带瓣外管道免于衰败率分别为97.5%(41/42)、81.2%(35/42)和69.6%(33/42);发生感染性心内膜炎患儿中,术后2、5、7年带瓣外管道免于衰败率分别为66.7%(6/9)、55.6%(5/9)和33.3%(3/9)。多因素分析显示感染性心内膜炎是外管道衰败的独立危险因素(OR 6.735,95%CI 1.348~33.647)。
带瓣外管道的需求量越来越大,与国内来源的缺乏形成了严重的矛盾,中远期随访发现牛颈静脉带瓣外管道存在相对较高的衰败率,感染性心内膜炎是外管道衰败唯一的独立危险因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
1964年,Rastelli等[1]首次应用无瓣膜的外管道重建右室流出道成功治疗肺动脉闭锁,开创了治疗此类复杂先天性心脏病的先河。但随之产生的肺动脉反流影响患儿预后。1966年Ross和Somerville[2]介绍了同种主动脉带瓣外管道的植入可以减少肺动脉反流,降低术后死亡率,有效保护了右心功能。之后,带瓣外管道越来越多地被应用于复杂先天性心脏病的手术治疗。
但是,近年来带瓣外管道衰败率的报道引起了学者的关注,在儿童中问题更为突出。然而,由于带瓣外管道在中国应用较晚,且应用较少,仍缺乏相关经验和长期客观的随访资料。复旦大学附属儿科医院心血管中心自2002年起应用牛颈静脉带瓣外管道(bovine jugular vein conduit,BJVC)重建右心室流出道来治疗小儿复杂性先天性心脏病,并通过长期随访来评估带瓣外管道的中远期功能,现报道如下。
2002年1月至2013年12月间行BJVC重建右心室流出道手术患儿53例。其中,男33例,女20例;手术年龄1~142个月,中位数36个月;体重3.2~35.0 kg,平均(14.4±8.5) kg;术前SpO2在74%~99%,平均(85.1±6.5)%;术前诊断为肺动脉闭锁伴室间隔缺损33例,法洛四联症1例,主动脉瓣病变(狭窄或者反流)8例,完全性大动脉转位伴肺动脉狭窄7例,动脉单干4例。31例(58.5%)曾有手术史,包括:体肺分流手术(改良B-T分流术)29例,右心室肺动脉外管道连接术(Sano术)2例。2次手术间隔时间为11~104个月,平均(38.94±24.07)个月。本研究通过复旦大学附属儿科医院伦理委员会批准(No.2007*14)。所有患儿家属签署临床实验知情同意书。
全组均采用胸骨正中切口,常规上下腔静脉及主动脉插管建立体外循环。心脏停跳下进行心内畸形的纠治,包括:Rastelli+VSD修补(39例),Rastelli+VSD留孔(3例),Nikaidoh手术(3例),Ross手术(7例)和Ross+Konno术(1例)。其中同时行三尖瓣成形19例,肺动脉分支成形扩大32例。
BJVC重建右心室流出道方法:接近瓣膜将带瓣外管道远端剪成斜形切面,与肺动脉共汇处作端端吻合,从而使瓣膜靠近肺动脉,减少因血流充盈而扭曲瓣膜产生反流的可能;开放主动脉,心脏开始复跳;开始吻合带瓣外管道近端与右心室切口,吻合口后壁直接端端缝合,前壁应用自体心包扩大,避免近端吻合口的狭窄。
本组在无活动性出血情况下,术后4~6 h给予5~15 μ·kg-1·h-1肝素静脉维持,此后可改口服阿司匹林3~5 mg·kg-1·次-1,每天1次,直至术后2年。
术后于门诊应用心脏超声进行随访,评估外管道瓣膜功能。评估项目包括:①有无术后感染性心内膜炎,即心脏彩色超声发现赘生物或者2次血液培养发现细菌生长[3];②有无术后BJVC反流,心脏超声估测外管道瓣膜反流的程度;③有无术后BJVC狭窄,即应用心脏超声检测通过外管道瓣膜处的血流流速,估测跨瓣压差,跨瓣压差超过60 mmHg(包括60 mmHg)[4];④有无BJVC衰败,即外管道瓣膜存在中度以上反流和/或外管道瓣膜狭窄,需进一步干预[5]。
按照研究计划收集全组病例资料,应用SPSS 16.0软件one-sample K-S test检验连续性数据资料的正态分布,若数据为正态性分布,则用(均数±偏差)表示,采用独立样本t检验和χ2检验进行统计学分析;反之则用中位数表示,采用Mann-Whitney U检验进行统计学分析,P<0.05为差异有统计学意义。BJVC瓣膜的衰败率和衰败曲线,采用Kaplan–Meier生存曲线进行分析。BJVC瓣膜衰败的危险因素分析,首先采用多因素回归分析,如果P<0.1则将因素纳入单因素回归分析;如果P<0.05,则可认为该因素为BJVC衰败的独立危险因素。
全组患儿主动脉阻断时间35~145 min,平均(70.5±28.6) min;体外循环时间75~232 min,平均(131.4±38.4) min;机械通气时间0.4~19.0 d,平均(3.1±3.0) d;滞留ICU时间1.5~19.0 d,平均(5.5±3.4) d。延迟关胸4例;出血7例,其中2例床旁急诊开胸止血,余5例经保守治疗好转;低心排出量3例,其中1例需要腹膜透析;完全性房室传导阻滞需安装永久性心脏起搏器1例。早期死亡2例,其中1例于术后早期出现了大量BJVC反流,导致严重的右心衰,考虑与术前肺血管阻力较高有关;另1例死于严重的败血症导致的多器官功能衰竭。其余患儿均存活顺利出院。
51例患儿得到了全面的随访,定期于门诊接受心脏彩色超声检查,随访时间为1.5~13年,平均(6.8±2.8)年。15例患儿出现了BJVC的衰败,衰败率为29.4%,包括外管道重度狭窄10例,狭窄伴反流3例,单纯反流2例。9例于术后出现感染性心内膜炎,最早为术后10 d,最晚为术后69个月,平均25.3个月。其中7例血培养呈阳性,6例为金黄色葡萄球菌,1例为链球菌;4例经心脏超声发现BJVC内赘生物形成。
术后1、3、5、7年BJVC免于衰败率分别为98.0%(50/51)、86.3%(44/51)、78.4%(40/51)和70.6%(36/51)(图1)。未发生感染性心内膜炎42例中,术后2、5、7年带瓣外管道免于衰败率分别为97.6%(41/42)、83.3%(35/42)和78.6%(33/42);发生感染性心内膜炎9例中,术后2、5、7年带瓣外管道免于衰败率分别为66.7%(6/9)、55.6%(5/9)和33.3%(3/9)(图2)。其中2例接受了外科手术更换了外管道,4例接受了心导管球囊扩张,球囊扩张后随访心脏超声狭窄得到了明显改善,其余仍在随访中。


BJVC衰败的危险因素分析
BJVC衰败的危险因素分析
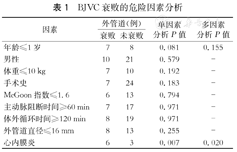
| 因素 | 外管道(例) | 单因素分析P值 | 多因素分析P值 | |
|---|---|---|---|---|
| 衰败 | 未衰败 | |||
| 年龄≤1岁 | 7 | 8 | 0.081 | 0.155 |
| 男性 | 10 | 21 | 0.579 | - |
| 体重≤10 kg | 7 | 10 | 0.192 | - |
| 手术史 | 7 | 24 | 0.183 | - |
| McGoon指数≤1.6 | 6 | 13 | 0.794 | - |
| 主动脉阻断时间≥60 min | 7 | 17 | 0.971 | - |
| 体外循环时间≥120 min | 8 | 19 | 0.971 | - |
| 外管道直径≤16 mm | 8 | 13 | 0.255 | - |
| 心内膜炎 | 6 | 3 | 0.007 | 0.020 |
单因素分析发现年龄≤1岁和感染性心内膜炎可能是BJVC衰败发生的相关因素(P值分别为0.081,0.007)。经多因素分析显示,感染性心内膜炎是BJVC衰败的独立危险因素(OR 6.735,95%CI 1.348~33.647)。
近年来,由于复杂先天性心脏病诊断率和治疗水平的提高以及新型手术技术的应用开展,带瓣外管道的需求越来越大。常见的复杂先天性心脏病,如:肺动脉闭锁(pulmonary atresia,PA)、动脉单干(persistant truncus arteriosus,PTA),其本身缺乏右心室至肺动脉的血管连接,必然需要带瓣外管道来重建[6]。Raju等[7]通过将错位的主动脉从右心室移植至左心室来治疗伴有左室流出道梗阻的大动脉转位,较传统的Rastelli手术有着更好地中远期效果,但是移植后右心室和肺动脉的连接就需要带瓣外管道来完成。Gillespie等[8]通过移植自体肺动脉瓣来替代主动脉瓣来治疗主动脉瓣疾病,避免了术后的长期抗凝,其可生长性也避免了多次手术更换的问题,对于小儿其优势明显,但是移植肺动脉瓣后造成的肺动脉的不连续性需要带瓣外管道来完成重建。法洛四联症术后中远期肺动脉反流对于右心功能的损害已经得到证实,可造成心律失常和猝死,20%需要进行肺动脉瓣置换(pulmonary valve repalcement,PVR),而带瓣外管道被认为是合适的更换材料之一[9]。
然而,带瓣外管道的衰败问题一直困扰着其临床应用。BJVC是目前西方国家心脏中心应用最为广泛的带瓣外管道,但是相比于Homograft,Hancock,Carpentier-Edwards等带瓣外管道,在降低衰败率方面并没有表现出绝对的优势[10]。Niemantsverdriet等[11]分析了1987~2003年欧洲和美国多中心数据发现带瓣外管道(主要是BJVC)5年的衰败率高达50%。此后,随着制作方法的改进,BJVC的衰败率有所下降,但是其术后5、10年的衰败率为仍高达20%,40%[12]。这对于患有先天性心脏病的儿童而言,意味着需要多次手术来更换衰败的外管道。Ong等[13]在所有多次接受带瓣外管道手术的患儿中进行随访研究发现10年发现免于2次手术的仅为50%,免于3次手术的为74%,免于4次手术的为86%。本研究发现本中心BJVC术后5、7年免于衰败率分别为81.2%,69.6%,与国外报道相似。
钙化、纤维化、炎性反应和血栓形成被认为是衰败的主要原因,往往导致瓣膜增厚狭窄或者外管道远端狭窄,甚至梗阻。因此,临床上BJVC梗阻更多见于瓣膜反流[14]。Göber等[15]报道了38例BJVC植入的病例,随访18个月,13.2%因为梗阻而再次手术。Ozkan等[16]随访2年的BJVC衰败率为21.5%,其中90%因为外管道狭窄。Schoenhoff等[17]通过衰败外管道的组织病理显示慢性炎症表现。Rüffer等[4]发现术后8 d白细胞计数高强烈提示日后外管道衰败可能,他认为炎性反应是带瓣外管道衰败的主要原因。而BJVC生物瓣膜引起的免疫反应被认为造成炎性反应的根源。Park等[18]在衰败的瓣膜中检测到大量单核细胞和巨噬细胞的浸润。Wojtalik等[19]发现BJVC植入后B细胞及T细胞介导的CD69和CD71明显上升。因此,生物带瓣外管道的衰败是不可避免的。
正是BJVC的免疫炎性反应,增加了术后感染性心内膜炎的发生率。随着越来越多相关病例的报道,术后感染性心内膜炎越来越受到重视[20,21]。相比于Homograft外管道,BJVC更易发生感染性心内膜炎,发生率达10%[5]。Mery等[22]认为BJVC是发生感染性心内膜炎的危险因素,可能与异种外管道高免疫反应有关。最常见的感染细菌是金黄色葡萄球菌,及时足量的抗生素治疗在一定程度上降低相关并发症的发生。相反,则可以引起瓣膜赘生物,导致外管道狭窄,加速外管道衰败,严重者出现急性右室流出道梗阻,甚至需要ECMO支持[23]。急诊手术更换外管道,是中晚期死亡的主要原因[24]。本研究发现感染性心内膜炎的发生率为17.6%(9/51),大部分为金黄色葡萄球菌感染,是带瓣外管道衰败的独立危险因素。而被认为与外管道衰败相关的危险因素如低年龄(≤1岁)[25],小尺寸外管道的植入(≤14 mm)[26]并没有在本研究中被证实。这可能与本组病例采用姑息手术延长了根治手术年龄,应用较大尺寸的BJVC有关。
在术后早中期存在如此高的再干预率和再更换率必然会极大地增加手术费用,增加整个家庭的经济负担,同时增加患儿的手术痛苦,在很大程度上限制了其在中国的应用。而且在国内,BJVC和Homograft的来源较少,这与巨大的临床需求产生了严重的矛盾,也制约了我国治疗复杂先天性心脏病的进程。因此,无论是社会需求,经济成本因素,还是自身专业的发展,都迫使我们尽早地寻求新的安全持久的带瓣外管道来解决这一难题。
自手工缝制带瓣管道应用于临床以来,为解决带瓣外管道的紧缺矛盾带来了希望,同时也显示出其较低衰败率的优势。2000年,Schlichter等[27]报道应用自体心包缝制双瓣外管道治疗54例患儿,随访5年,10年免再干预率为92%,76%,明显好于当时的Homograft和BJVC。2002年,Allen等[28]应用牛心包缝制成三瓣并缝于Gore-tex血管,平均随访43个月,发现牛心包瓣膜功能良好,无狭窄发生。Ando和Takahashi[29]于2009年报道了139例应用0.1 mm PTFE带瓣外管道重建右室流出道,10年随访外管道置换率仅为88.0%±6.8%,70%患儿仍维持轻度或轻度以下的肺动脉反流。
综上所述,带瓣外管道的需求量越来越大,与国内来源的缺乏形成了严重的矛盾,同时,BJVC的衰败率不容我们忽视,术后感染性心内膜炎加速了衰败的进程,手工缝制的带瓣外管道可能是解决上述难题的有效途径。
无



























