先天性心脏病的治疗大多需要在心脏停止跳动的情况下行心脏直视手术矫正畸形。心肌保护液使心脏的电机械活动停止、在低温环境下提供代谢底物、减少心肌缺血和再灌注损伤,发挥重要的心肌保护作用。由于未成熟心肌和成熟心肌具有较多差异,有针对性的选择对未成熟心肌有利的心肌保护液不仅关系到手术的成功,更重要的是关系到患儿的术后康复。近年来心肌保护液的配方及灌注方式也在不断的改进。Del Nido心肌保护液是美国最常用的一种,它已有近20年的历史,不仅对降低儿童心脏手术的死亡率和并发症发生率具有重要作用,也在成人心脏手术中使用和推广,但目前在国内尚未普及。本文将对Del Nido心肌保护液在儿童心脏手术中的应用作详细介绍。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,随着我国心脏外科手术、体外循环技术的发展和提高,心脏手术日趋低龄、低体重、更加复杂和危重。在深低温、手术时间长、操作复杂的心脏手术中加强心肌保护至关重要。未成熟心肌在细胞结构、生物功能、能量代谢及缺血缺氧耐受方面与成熟心肌存在明显不同。因此,有针对性的选择有利于未成熟心肌的保护液不仅关系到手术成功,更关系到患儿的术后康复和远期生活质量。匹兹堡大学的研究人员在Pedro del Nido的带领下于20世纪90年代早期发明了一种心肌保护液配方,随后他们又对原始配方进行改进,创造出当今在美国学术研究和临床实践中广泛应用的Del Nido心肌保护液。本文将主要从未成熟心肌的特点,Del Nido心肌保护液的历史、配方、用法及对未成熟心肌保护的优势等方面进行总结。
未成熟心肌和成熟心肌存在较大差异(表1)。

未成熟心肌和成熟心肌的差异
未成熟心肌和成熟心肌的差异
| 特点 | 成熟心肌 | 未成熟心肌 |
|---|---|---|
| 形态 | 大、椭圆、交杂 | 小、圆、简单 |
| 肌纤维 | 多、有序、中心 | 少、无序、外圆 |
| 线粒体 | 多、有序、形态统一、嵴多 | 少、无序、形态不一、嵴少 |
| 收缩成分 | 60%以上 | 30% |
| Ca2+ | 心肌收缩的钙多来源于肌浆网 | 肌浆网不发达,钙储备能力低,对细胞外的钙离子浓度更加敏感 |
| 收缩力 | 强 | 弱 |
| 顺应性 | 高 | 低 |
| 最适肌节 | 容量高 | 容量低 |
| 缩短速度 | 快 | 慢 |
| 对肾上腺素的反应 | 强 | 弱 |
| 对缺血耐受能力 | 弱 | 强 |
未成熟心脏体积小,房室壁薄,表面积与体积的比值大;心肌肌原纤维少,排列无序,纤维直径小且短;肌小节及横桥数目少,胞间连接疏松,呈点状,收缩力弱,机械消耗少,横管系统不发达,肌浆网稀疏;线粒体数量少,散在分布于核的周围及肌纤维之间,嵴发育不完全,功能储备少;细胞含水量高,非收缩性物质所占的比重大;肌原蛋白含量低,胶原含量高,其中总胶原/总蛋白及Ⅰ型胶原(与硬度有关)与Ⅲ型胶原(与弹性有关)的比值较高,故组织较僵硬,导致未成熟心肌顺应性差。新生儿心脏只有30%的心肌含有收缩纤维,成熟心肌的收缩纤维占心肌质量的60%[1]。
成年人心肌中超过90%的ATP来源于游离脂肪酸的β氧化[2]。而未成熟心肌含有丰富的内源糖原及脂肪酸、酮体和氨基酸,其ATP产生的主要底物则是葡萄糖[3]。因此未成熟心肌比成人心脏具有更多的糖原储存和更长时间无氧酵解的能力[4,5]。
未成熟心肌水和蛋白质含量更高,因此心脏顺应性较低,心脏前负荷储备较少,心室功能曲线范围更狭窄接近于Frank-starling曲线的峰值部分。对儿茶酚胺的敏感性降低,正性肌力作用减弱(给予最大剂量肾上腺素刺激),对麻醉的负性肌力反应加强[6,7]。儿童心输出量主要依赖心率和窦性心律。
未成熟心肌比成熟心肌对细胞外钙离子浓度更加敏感[8,9]。在成熟心肌,心肌收缩需要的钙多数来源于肌浆网,而在未成熟心肌,心肌细胞肌质网不发达,储存钙离子的能力降低,肌质网中ATP酶的活性也较成年人心脏低[10]。因而未成熟心肌对钙的利用能力也较成熟心肌减低,对钙阻滞剂比成熟心肌更加敏感。
未成熟心肌许多酶系统的活性低于成熟心肌,例如氧自由基清除剂:超氧化物歧化酶,过氧化物酶及谷胱甘肽还原酶的活性在未成熟心肌中活性较低,这就增加了未成熟心肌对缺血再灌注后氧自由基损伤的敏感性[11]。
婴幼儿和儿童心脏停搏液最初和成人一样,只是简单调整了容量、流量和压力[16]。圣托马斯医院的心脏停搏液就是以这种方式在上世纪80、90年代被广泛应用[17]。
匹兹堡大学研究人员注意到未成熟心肌的特点,认识到需研制一种更能满足未成熟心肌需求的心脏停搏液。在研制配方时,他们非常关注磷酸钙的精确测定和管理,心肌细胞的高能磷酸盐ATP及乳酸盐和细胞内的缓冲液等。del Nido博士也主导和参与了很多关于缓冲液和钙离子管理在心肌保护液中作用的研究[18,19,20]。最终研制出现在称作Del Nido心肌保护液的配方。虽然其中很多原理来源于啮齿类动物模型,但它的心肌保护效果和对不同年龄动物心脏的适用性都是经过大量动物模型测试得出的[21]。
Del Nido心肌保护液是晶体液与血液按4∶1比例在6 ℃的温度中配制而成。其晶体组成部分如下:1 L勃脉力底液;20%甘露醇,16.3 ml;50%硫酸镁,4 ml;8.4%碳酸氢钠,13 ml;氯化钾(2 mEg/ml),13 ml;1%利多卡因,13 ml。
各成分的作用如下:①勃脉力底液:一种由电解质组成且与细胞外液相似的液体,在添加其他药物之前,它的电解质浓度为钠离子140 mEg/L,钾离子5 mEg/L,镁离子3 mEg/L,氯离子98 mEg/L,醋酸27 mEg/L,葡萄糖酸23 mEg/L。应特别注意的是勃脉力底液并没有钙离子,Del Nido心肌保护液中钙离子的最终浓度被认为是微量的,因为其中20%的容积是病人的血液。心脏停跳液中的微量钙离子水平也被证明比正常钙离子水平更有利[22]。②甘露醇:心麻痹性停搏和随后再灌注过程中的心肌损伤一部分原因是氧自由基释放造成的,包括超氧化物阴离子,过氧化氢和羟基。这些物质可以破坏细胞内的酶,但在心脏停搏时这种作用受到抑制[23]。另外,心肌细胞水肿也被认为与缺血后心肌损害有关。而甘露醇被证明能同时消除自由基和防止心肌细胞水肿[24]。③硫酸镁:心肌功能与细胞内钙离子浓度密切相关,心肌肌质网钙离子的流出释放会增加细胞内供收缩的钙离子浓度,从而降低心脏舒张功能。当钙离子不断在心肌内积累时可发生严重的舒张中断。而镁离子是天然的钙离子通道阻滞剂,且研究证明在低温心脏停跳液中加入镁离子和低水平钙离子能促进心室复苏[25]。④碳酸氢钠:在整个心脏停搏期间维持有氧代谢是不可能的。因此,无氧糖酵解必须得到支持。无氧糖酵解及其生产的ATP可以抑制多余的氢离子积累。Del Nido停搏液混合碳酸氢钠作为缓冲溶液清除多余的氢离子和协助维持细胞内PH值。值得注意的是红细胞中含有高浓度的碳酸酐酶,一种将氢离子和碳酸氢根转化生成二氧化碳和水的酶。红细胞的这种特性可能是其在心脏停搏液最重要的作用。⑤氯化钾:高钾是心脏手术最常用的心脏停搏方法,去极化的心肌保护液能使心肌发生快速去极化停博,但它也有很多限制。在去极化心脏停搏期间,由于细胞内钠离子和钙离子的积聚使得心肌复苏减慢。而利多卡因可在心脏电活动停止时抑制这种负面作用[26]。⑥利多卡因:利多卡因是钠离子通道阻滞剂,也是一种常用的抗心律失常药,可延长心肌细胞不应期[27]。当心脏停搏液是在一个理想环境给予时,这一作用将延长,是因为利多卡因维持在适当浓度不断影响心肌。另外,利多卡因也可以避免去极化心脏停搏期间钠离子和钙离子的积聚。2009年的一项研究也证明在去极化心脏停搏心肌缺血时Del Nido心肌保护液可以减少钙离子的积累[28]。
有实验证明含血停搏液对于婴幼儿心肌的保护是有利的,在心肌功能恢复率方面,应用氧合冷血停跳液组较冷晶体停跳液高,前者可减少肌酸激酶漏出量,心肌细胞内结构损伤轻,能良好保护未成熟心肌[29]。在心脏停搏液中添加病人的氧合血可以在一段时间内支持患儿的有氧代谢,同时也具有缓冲作用促进患儿无氧糖酵解。
一次剂量为20 ml/kg,若主动脉阻断时间超过3 h,需重复灌注,但目前的文献未提及重复灌注的剂量。若主动脉阻断时间在30 min以内,按10 ml/kg灌注1次即可。灌注系统压力维持在100~200 mmHg,1~2 min内灌完。以一个3 kg患儿为例:①150 ml为管道预充,则整个心肌保护液系统的总量为20×3+150=210 ml。②按照晶体液和血4∶1比例计算需加入患儿的血量为210÷5=42 ml。③保护液袋中需残余25 ml液体,以防止气体进入灌注系统,因此保护液袋中需加入心肌保护液为20×3+25-42=43 ml
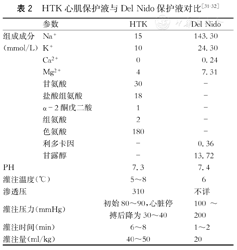
儿童心脏手术中,目前国内常用的圣托马斯心肌保护液对未成熟心肌的针对性不强,且45 min需再次灌注,易导致快速冷挛缩,对未成熟心肌功能、能量代谢与超微结构造成影响,不适合手术时间长且复杂的心脏手术。HTK液自动复跳率高,对心肌保护作用较好,对复杂心脏手术有利,但价格昂贵,且用量较大,存在较明显的血液稀释,易导致稀释性低钠血症。Del Nido保护液已在美国波士顿儿童医院及霍普金斯医院儿童中心应用近20年,临床证明对婴幼儿心肌保护效果确切,20 ml/kg单次灌注后可维持2 h,且价格便宜,应在国内广泛应用,作为HTK和St Thomas心肌保护液的优良替代品。常温下心脏在缺血仅20 min后就会出现不可逆的缺血性损害[30]。使用Del Nido心肌保护液后出现不可逆的缺血性损害的时间可延长到缺血4~5 h后。
改良St Thomas、Del Nido和HTK心肌保护液各有优缺点(表2)。Del Nido心肌保护液虽然在美国应用比较多,但国内接收程度有限,尚缺乏经验,且其作用机制有待进一步研究。
无