
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝母细胞瘤(hepatoblastoma,HB)是儿童期最常见的肝脏恶性肿瘤,90%发生于5岁以内[1]。该病起病隐匿,早期多无症状,约20%的患儿在诊断时已发生远处转移。手术切除肿瘤是HB的重要治疗手段,可否完整切除肿瘤是影响预后的关键因素,但若诊断明确后直接手术,肿瘤完全切除的比例仅为50%~60%,且单纯手术治疗的患儿容易术后复发。手术前化疗对于提高外科手术的完整切除率及降低复发率起到了重要作用,术后化疗则可进一步消除原位残留及远处转移病灶。目前以手术联合化疗为主的多学科诊治成为HB治疗的标准模式。
参照北美儿童肿瘤协作组和欧洲的国际儿童肝肿瘤协作组的治疗方案,2009年中国抗癌协会小儿肿瘤专业委员会制定了我国《儿童肝母细胞瘤多学科诊疗规范》(CCCG-HB-2009)(简称武汉方案),这是我国第一个全国性的HB治疗方案,已在全国十余家儿童肿瘤治疗中心推广应用,首次获得了中国HB儿童疗效的分析数据,与国外各主要儿童肝肿瘤协作组的研究报道相近似[2]。但2009年武汉方案并没有对HB患儿进行治疗前的危险度分层,对于诊断时存在肝脏多发病灶、血管浸润、广泛转移或复发的高危HB患儿,疗效欠佳,且武汉方案中未阐述肝移植指征。
目前国际上儿童肝肿瘤协作组主要有北美儿童肿瘤协作组(Children’s Oncology Group,COG)、国际儿童肝肿瘤协作组(Société Internationale d’Oncologie Pédiatrique Epithelial Liver Tumor Study Group,SIOPEL)、德国儿童肿瘤协作组(German Society for Pediatric Oncology and Hematology,GPOH)和日本儿童肝肿瘤协作组(Japanese Study Group for Pediatric Liver Tumor,JPLT),前两者治疗方案的合理性已被广泛吸收和接受。近年成立的儿童肝肿瘤国际合作组织CHIC(Children’s Hepatic Tumor International Collaboration)已将上述四大协作组联合起来,开展全球性多中心临床研究,并实现数据共享[3]。因此本共识拟在原武汉方案基础上,借鉴国际上新的研究进展,并结合我国实际情况,对于治疗前分期(PRETEXT)、新辅助化疗后的手术前分期(POST-TEXT)以及手术后分期系统、根据危险度分层化疗、手术时机和肝移植指征等方面进行修订与优化,以进一步规范我国儿童肝母细胞瘤的诊断和治疗,实施标准化治疗基础上的个体化治疗,从而进一步提高我国肝母细胞瘤儿童的长期无病生存率。
1.小于18岁,经切除或活检获得病理组织标本而确诊的新发患儿;
2.治疗前必须明确诊断和分期;
3.无严重脏器功能不全;
4.法定监护人签署化疗同意书,愿意接受此方案治疗及随访。
肿块切除或穿刺活检可明确诊断。
(1)B型超声;
(2)胸部CT(平扫或增强);
(3)腹部CT增强+血管成像,或腹部MRI增强(选择性);
(4)全身骨扫描(选择性);
(5)Ⅲ、Ⅳ期患儿头部MRI增强(选择性)。
(1)全血象、尿常规、大便常规;
(2)血生化检查:甲胎蛋白(AFP)、肝肾功能、肌酐清除率、血/尿β2微球蛋白、电解质系列、血清乳酸脱氢酶(LDH)、铁蛋白、心肌酶谱、凝血功能;
(3)病毒感染检测:乙肝两对半、丙肝、CMV、EBV;
(4)心电图,脑电图(选择性);
(5)心彩超+心功能;
(6)听力检查;
(7)免疫功能(IgG,IgM,IgA,外周血T、B、NK细胞亚群比例与绝对值)(选择性)。
(1)甲胎蛋白(AFP)、磷脂酰肌醇蛋白多糖3(glypican3)、β-连接蛋白(β-catenin)、谷氨酰胺合成酶(GS)、波形蛋白(vimentin)、肝细胞抗原(hepatocytic antigen)、INI-1(整合酶相互作用因子)[4];
(2)检测CK7、CK19、CD34、Ki67有助于提示肿瘤是否向胆管细胞分化、明确肝血窦之间肝细胞索的数目和肿瘤细胞的增殖指数。
①胎儿型
a.分化良好的胎儿型(单纯胎儿型伴低有丝分裂活性,<2/10高倍视野);
b.拥挤的胎儿型(核分裂活跃,≥2/10高倍视野);
c.多形性胎儿型(分化差型);
d.间变性胎儿型(核明显增大、深染、伴多形性)。
②胚胎型
③小细胞未分化型(small cell undifferentiated,SCU)
a.INI1阳性
b.INI1阴性
④粗大小梁型
⑤胆管母细胞型
①伴畸胎样特征的混合型
②间质来源(不伴畸胎样特征)的混合型
备注:①如果肿瘤组织中含有间变性的成分,建议描述并列出百分比;②如为穿刺活检,建议至少送检5条穿刺标本,每条不少于1.0 cm×0.3 cm,以代表肿瘤的不同区域,并包含代表正常组织和肿瘤组织交界处的病变组织。获得的活细胞成分可供细胞遗传学分析。
PRETEXT(pretreatment extent of disease)仅指治疗前肿瘤累及肝脏的范围,主要用于评估初诊手术完整切除的可行性;POST-TEXT(post-treatment extent of disease)则是指新辅助化疗后肝脏肿块的累及范围,主要用于评估延期手术完整切除的可行性(图1)。各期定义如下:
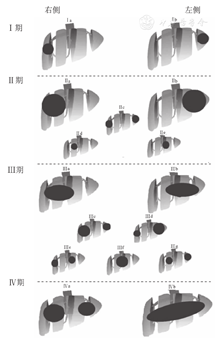

(1)PRETEXT/ POST-TEXTⅠ:肿瘤局限在一个肝区,相邻的另外3个肝区无肿瘤侵犯;
(2)PRETEXT/POST-TEXT Ⅱ:肿瘤累及一个或两个肝区,相邻的另外2个肝区无肿瘤侵犯;
(3)PRETEXT/POST-TEXT Ⅲ:2个或3个肝区受累,另1个相邻的肝区未受累;
(4)PRETEXT/POST-TEXT Ⅳ:肿瘤累及所有4个肝区。
(1)stage Ⅰa:肿瘤完全切除,组织病理学类型为单纯胎儿型;
(2)stage Ⅰb:肿瘤完全切除,除单纯胎儿型以外其他组织病理学类型;
(3)stage Ⅱ:肿瘤基本切除,有镜下残留;
(4)stage Ⅲ:肿块有肉眼残留;或基本切除伴淋巴结阳性;或肿瘤破裂或腹膜内出血;
(5)stage Ⅳ:诊断时发生远处转移,不论原发病灶是否完全切除。
目前认为PRETEXT分期、Evans分期、诊断时AFP水平、病理亚型、是否存在远处转移等因素是评估HB预后的重要因素[8,9,10]。综合SIOPEL及COG协作组的危险度分层标准[11],并结合我国实际情况,将初诊HB患儿分为极低危组、低危组、中危组和高危组(表1)。

HB危险度分组
HB危险度分组
| 分组 | AFP(ng/ml) | PRETEXT | COG分期 | 病理分型 | P+/V+/M+/E+/H+/N+ | 备注 | |
|---|---|---|---|---|---|---|---|
| 极低危组 | Ⅰ期 | 分化良好的单纯胎儿型 | 须同时满足2个条件 | ||||
| 低危组 | ① | ≥100 | Ⅰ或Ⅱ期 | 均未累及 | 须3者同时满足 | ||
| ② | Ⅰ或Ⅱ期 | 非单纯胎儿型和非SUC型 | 须2者同时满足 | ||||
| 中危组 | ① | Ⅲ期 | |||||
| ② | Ⅰ或Ⅱ期 | SUC型 | 须2者同时满足 | ||||
| ③ | Ⅲ期 | ||||||
| 高危组 | ① | <100 | 满足任何一条即可 | ||||
| ② | Ⅳ期 | ||||||
| ③ | Ⅳ期 | ||||||
| ④ | P+/V+ | ||||||
术后COG分期为stageⅠ且组织病理学类型为分化良好的单纯胎儿型患儿。
符合以下标准任何一条均纳入低危组:
(1)血清AFP≥100 ng/ml的PRETEXT Ⅰ期或Ⅱ期,且除外P+(侵犯门静脉)、V+(侵犯下腔静脉或者肝静脉)、M+(远处转移)、E+(肝外腹内疾病)、H+(肿瘤破裂或腹膜内出血)、N+(侵犯淋巴结);
(2)术后COG分期为stageⅠ期或Ⅱ期,且组织病理学类型为非单纯胎儿型和非小细胞未分化型。
符合以下标准任何一条均纳入中危组:
(1)术前PRETEXT Ⅲ期;
(2)术后COG分期为stageⅠ期或Ⅱ期,且组织病理学类型为小细胞未分化型;
(3)术后COG分期为stage Ⅲ。
符合以下标准任何一条均为高危组:
(1)血清AFP<100 ng/ml;
(2)术前PRETEXT Ⅳ期;
(3)术后COG分期为stageⅣ期;
(4) P+(侵犯门静脉)、V+(侵犯下腔静脉或者肝静脉)。
(1)美国麻醉师协会评分1~2级;
(2)经影像学评估,残存肝脏组织大于原体积的35%,功能能够满足代谢需要;
(3)PRETEXT Ⅰ、Ⅱ期的单发肿瘤病灶,距离重要血管有足够间隙(≥1 cm);
(4)预计镜下残留(COG Ⅱ期)无需2次手术者。
(1)PRETEXT Ⅲ期、Ⅳ期患儿,在活检明确诊断先行新辅助化疗后,再行延期手术;
(2)化疗后评估为POST-TEXT Ⅰ期、Ⅱ期,或没有重要血管(门静脉或下腔静脉)累及的POST-TEXT Ⅲ期患儿,可行肝叶切除或分段切除;
(3)对PRETEXT Ⅳ期和化疗后评估为POST-TEXT Ⅲ期并伴有下腔静脉(V+)或门静脉(P+)累及的患儿,应该尽早转入具有复杂肝段切除或肝移植能力的医院治疗;
(4)新辅助化疗后仍残留肺或脑单发转移病灶者,可行残留病灶手术切除。
1.极低危组患儿术后不化疗,密切随访。
2.低危组化疗方案(C5V)
(1)顺铂(CDDP),第1天90 mg·m-2·d-1,避光持续静滴≥6 h;
(2)5-氟脲嘧啶(5-FU),第2天,600 mg·m-2·d-1,静滴4 h;
(3)长春新碱(VCR),第2天,1.5 mg·m-2·d-1,静推(单次最大剂量≤2 mg)。
每一轮化疗间隔3周,且中性粒细胞≥1.0×109/L,血小板≥100×109/L,肝肾功能正常,可进行下一轮化疗。
3.中危组化疗方案(C5VD)
(1)顺铂(CDDP),第1天,90 mg·m-2·d-1,避光持续静滴≥6 h;
(2)5-氟脲嘧啶(5-FU),第2天,600 mg·m-2·d-1,静滴4 h;
(3)长春新碱(VCR),第2天,1.5 mg·m-2·d-1,静推(单次最大剂量≤2 mg);
(4)阿霉素(Doxo),第2、3天,d3,25 mg·m-2·d-1,静滴2 h。
每一轮化疗间隔3 ~ 4周,且中性粒细胞≥1.0×109/L,血小板≥100×109/L,肝肾功能、心肌酶谱及心电图正常,可进行下一轮化疗。
4.高危组化疗方案(C-CD+ ICE)
高危组HB治疗流程图见图2。
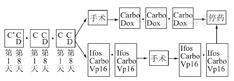

(1)术前化疗
①第一轮
a.顺铂(CDDP),第1天,80 mg·m-2·d-1,静滴24 h;
b.顺铂(CDDP),第8天,70 mg·m-2·d-1,静滴24 h;
c.阿霉素(Doxo),第8、9天,30 mg·m-2·d-1,静滴24 h。
②第二轮
a.顺铂(CDDP),第1、8天,70 mg·m-2·d-1,静滴24 h;
b.阿霉素(Doxo),第8、9天,30 mg·m-2·d-1,静滴24 h。
③第三轮
a.顺铂(CDDP),第1、8天,70 mg·m-2·d-1,静滴24 h;
b.阿霉素(Doxo),第8、9天,30 mg·m-2·d-1,静滴24 h。
(2)术后化疗:共3轮
a.卡铂(Carbo),第1天500 mg·m-2·d-1,静滴2 h;
b.阿霉素(Doxo),第1、2天,20 mg·m-2·d-1,静滴24 h。
(3)如术前化疗后评估仍无法手术,则改用ICE方案化疗
a.异环磷酰胺(Ifos),第1~5天,1.5 g·m-2·d-1,静滴2~3 h;
b.卡铂(Carbo),第1天,450 mg·m-2·d-1,静滴2~4 h;
c.足叶乙甙(VP16),第1~3天,100 mg·m-2·d-1,静滴2~4 h。
2疗程后评估手术可行性,术后重复上述ICE方案化疗2疗程。
备注:高危组患儿每一轮化疗间隔4周,至中性粒细胞≥1.0×109/L,血小板≥100×109/L,肝肾功能、心肌酶谱及心电图正常,可进行下一轮化疗。
5.化疗疗程
(1)低危组:Ⅰ期手术后化疗总疗程为4~ 6个疗程;
(2)中危组:化疗2~4个疗程后择期手术,总疗程为6~8个;
(3)高危组:化疗3~5疗程后择期手术,总疗程6~7个疗程。
1.新辅助化疗后评估为POST-TEXT Ⅳ期,或POST-TEXT Ⅲ期伴有肝静脉或下腔静脉等重要血管受累,手术会影响残存肝脏血供的病例;
2.手术切除或化疗后不存在肝外病灶和远处转移病灶;
3.诊断时存在肝外病变的患儿,如果病灶被完全清除,也可行肝移植术。
体格检查及CT或MRI显示肿瘤完全消失,且AFP正常4周以上;
肿瘤缩小≥50%,无任何新发或疾病进展的证据;
肿瘤缩小<50%,无任何肿瘤增大或新发病损证据;
肿瘤增大≥25%,或有新发肿瘤或AFP升高;
(1)活检证实;
(2)明确的影像学证据且血清AFP 4周内连续3次增高。
1.第一年:AFP/1个月,胸部CT平扫(推荐)或胸片,腹部MRI或B型超声/2个月;
2.第二年:AFP/3个月,胸部CT平扫(推荐)或胸片,腹部MRI或B型超声/3个月;
3.第三年:AFP/3个月,胸部CT平扫(推荐)或胸片,腹部MRI或B型超声/6个月;
4.第四~五年:AFP/6个月,胸部CT平扫(推荐)或胸片、腹部MRI或B型超声/1年。
(袁晓军 执笔)
参与本专家共识起草的专家(按姓氏汉语拼音顺序排序):陈肖鸣(温州医科大学附属第二医院)、董蒨(青岛大学附属医院)、高怡谨(上海交通大学医学院附属上海儿童医学中心)、黄东生(北京同仁医院)、蒋马伟(上海交通大学医学院附属新华医院)、李玉华(上海交通大学医学院附属新华医院)、李璋琳(天津医科大学附属肿瘤医院)、卢俊(苏州大学附属儿童医院)、陆勤(南京儿童医院)、马晓莉(首都医科大学附属北京儿童医院)、施诚仁(上海交通大学医学院附属新华医院)、孙晓非(中山大学附属肿瘤医院)、汤静燕(上海交通大学医学院附属新华医院)、汤永民(浙江大学医学院附属儿童医院)、唐锁勤(解放军301医院)、王焕民(首都医科大学附属北京儿童医院)、王金湖(浙江大学医学院附属儿童医院)、王立峰(上海交通大学医学院附属新华医院)、王宁玲(安徽医科大学第二附属医院)、王珊(重庆医科大学附属儿童医院)、王忠荣(安徽省立医院)、吴晔明(上海交通大学医学院附属新华医院)、徐涛(广州市妇女儿童医疗中心)、闫杰(天津医科大学肿瘤医院)、殷敏智(上海交通大学医学院附属上海儿童医学中心)、袁晓军(上海交通大学医学院附属新华医院)、赵强(天津医科大学肿瘤医院)
上海交通大学医学院附属新华医院王成栋博士及汤梦婕医生为本文绘制文中插图
1.所有HB患儿的完整诊断均应包含PRETEXT分期、POSTTEXT分期、COG分期及危险度分组。
2.临床高度怀疑HB,但肿块巨大、患儿一般情况差,肿块切除或活检存在极大风险时,如AFP异常增高(>正常年龄组)及影像学均支持HB诊断,则建议先给予中危组化疗方案(C5VD)2疗程后(需监护人签署知情同意书),再进行评估择日手术。
3.争取活检术后7 d内尽早予以化疗,肿块切除术后10~14 d予以化疗(具体时间间隔视肝脏切除体积而定)。
4.药物剂量调整原则和方法
(1)对于体重<10 kg的婴幼儿,需要按照体重调整药物剂量,按照1 m2体表面积等于30 kg换算。
(2)肥胖患儿剂量调整原则(体重大于标准体重的2SD或125%及以上):
调整体重=标准体重+ 0.4×(实际体重-标准体重),需根据调整体重计算体表面积,且最大体表面积不超过1.73 m2。
(3)如某一疗程出现化疗相关严重并发症(感染性休克、非常严重的口腔黏膜溃疡等)或外周血象恢复时间超过6周,下一疗程可降低药物剂量(建议按照75%~50%~25%原则减量;如严重并发症不再出现,则按照25%~50%~75%原则增加剂量)。
5.粒细胞减少症的处理
化疗结束24 h以后,如外周血中性粒细胞绝对值≤1.0×109/L,可给予粒细胞集落刺激因子(G-CSF)或粒-巨噬细胞集落刺激因子(GM-CSF),皮下注射,一般剂量为5 μg·kg-1·d-1,粒细胞减少严重者剂量可增加至10 μg·kg-1·d-1,至少持续应用至连续2 d外周血中性粒细胞绝对值≥1.0×109/L。
6.听力测定[23]
铂类是治疗肝母细胞瘤最重要的药物,但可能引起约60%的婴幼儿出现不同程度的双侧永久性、进行性高频听力损伤,因此建议5岁以上或可以配合的患儿进行纯音听阈测定,其余患儿给予畸变产物耳声发射和脑干听觉诱发电位检测。检测时间点为:治疗前、每2疗程及化疗结束时,化疗结束后每半年检测一次至停药5年。
7.鉴于蒽环类药物对心肌的毒性作用[24],当阿霉素累积剂量≥400 mg/m2时,建议谨慎使用蒽环类药物,同时密切监测心功能(心肌酶谱、肌钙蛋白、脑钠肽、心脏彩超)。
8.复方磺胺甲基异恶唑(SMZco):为预防卡氏肺囊虫肺炎,在整个治疗期间及全部化疗完成后3~6个月内,建议所有患儿均服用SMZco 25 mg·kg-1·d-1,分2次口服,每周连用3 d。
9.每化疗1疗程后进行血清AFP+B型超声评估,每2个疗程后进行AFP+影像学CT /MRI的评估。
10.按照危险度分组化疗后2疗程评估,肿瘤最大直径缩小<25%或疾病进展,则危险度升级或进行个体化治疗,或选用附件2其他治疗措施(介入、射频消融、超声聚焦刀等),但统计本方案疗效时应予以注明。
11.停化疗指征:影象学无残留+AFP正常后3个疗程可以停药;无AFP增高者,需影象学无残留后4个疗程可以停药。
12.由于儿童复发性HB患儿病例较少,目前无标准的治疗方案。
对于规范化治疗后仍无法达到完全缓解的患儿可试用以下治疗手段。
1.介入治疗(TACE)
(1)适应证
a.PRETEXT分期Ⅲ期及以上和/或肺部转移,经规范治疗后仍无法手术切除者为TACE的主要适应证;
b.等待肝移植的患儿,TACE可控制肿瘤的进展;
c.经3个周期的全身化疗,影像学出现新发病灶,肿瘤缩小不明显或缩小程度<50%。
(2)禁忌证
a.碘过敏试验阳性或明显过敏体质;
b.全身状况差,合并严重心、肝、肾功能衰竭;
c.Child-Pugh C级,合并门脉主干癌栓(PVTT);
d.重度全身性感染或穿刺部位炎症;
e.肝内动静脉瘘;
f.凝血功能异常。
2.射频消融治疗(RFA)
对于多发、且治疗后仍无法手术的病灶,可试用RFA。
3.高强度超声聚焦刀治疗[25]
难治性的多灶性、未能进行肝移植、手术后残留的患儿,也可选择高强度超声聚焦刀治疗。
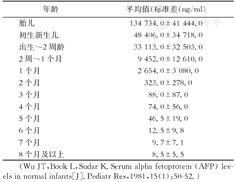
| 年龄 | 平均值(标准差(ng/ml) |
|---|---|
| 胎儿 | 134 734.0±41 444.0 |
| 初生新生儿 | 48 406.0±34 718.0 |
| 出生~2周龄 | 33 113.0±32 503.0 |
| 2周~1个月 | 9 452.0±12 610.0 |
| 1个月 | 2 654.0±3 080.0 |
| 2个月 | 323.0±278.0 |
| 3个月 | 88.0±87.0 |
| 4个月 | 74.0±56.0 |
| 5个月 | 46.5±19.0 |
| 6个月 | 12.5±9.8 |
| 7个月 | 9.7±7.1 |
| 8个月及以上 | 8.5±5.5 |
(Wu JT,Book L,Sudar K.Serum alpha fetoprotein (AFP) levels in normal infants[J].Pediatr Res,1981,15(1):50-52.)

























