
回顾性分析6例儿童结、直肠恶性肿瘤患儿的临床表现、病理特征及疾病转归,同时寻找与成人临床病理不同点。
回顾性分析2010年1月至2016年1月共收治的结、直肠癌患儿共3 401例,其中<14岁以下6例,占0.17%。男4例,女2例,平均年龄13岁,均经病理检查证实。同时在同期20 ~ 30岁年龄组和50 ~ 60岁年龄组中采用随机数字表法随机抽样分别产生17例和67例病例,分别与儿童结、直肠癌临床表现、病理特征做一比较。
临床表现以腹痛、便血、腹部肿块、肠梗阻为主,1例有大便习性改变。病理特征:肿瘤部位在结肠5例,直肠1例。病理诊断:结肠黏液腺癌2例,印戒细胞癌3例,管状腺癌1例,均有区域性淋巴结转移,1例远处转移。病理检查中还发现1例合并肠神经元发育异常改变(例6)。例2十年前曾做肝母细胞瘤切除,辅以化疗,此为二次肿瘤。6例儿童均予以化疗,至随访日(2016年8月30日)有3例死亡,1例失随访,2例存活,继续化疗中。后者生活质量低于同龄儿童。对照20 ~ 30岁年龄组,与50 ~ 60岁年龄组,后二组临床表现则以大便习性改变为主。从病理特征分析,20 ~ 30岁组以管状腺癌、低分化腺癌、印戒细胞癌、黏液腺癌(以多少排序)多见,50 ~ 60岁组以管状腺癌、黏液腺癌、乳头状管状腺癌、低分化腺癌、未分化癌(以多少排序)多见。
儿童结、直肠癌罕见,本组6例占全年龄段结、直肠癌数中0.17%。临床表现仍与成年人结、直肠癌相似,但首发症状以反复腹痛、便血、腹部肿块、肠梗阻为主,大便习性改变少见。而成年人结、直肠癌则以大便习性改变为主。儿童结肠部位多见,以黏液腺癌和印戒细胞癌为主,大多有周边淋巴转移。成年组以管状腺癌为主,儿童结肠癌有肠神经元发育异常。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
儿童结肠、直肠癌(colorectal carcinoma,CRC)是一种罕见的儿童肿瘤。< 20岁的发病率约为10万分之一[1]。儿童高发年龄在15岁左右,文献中最年幼的仅9个多月。众所周知,结直肠癌高发于50岁以后成年人,约占80 %左右,在我国上海地区近年已列入高发恶性肿瘤第二位[2]。但有关儿童CRC仅是一些极罕见的散在个案报告,而且预后差。结合文献对其临床表现、诱因、病理及转归等进行分析,为儿童CRC诊断,防治提供有益的资料。
回顾性分析2010年1月至2016年1月上海交通大学医学院附属新华医院收治的结肠、直肠癌患儿共3 401例,其中<14岁有6例,占总数0.18 %,男4例,女2例,平均年龄13岁(年龄范围9 ~ 14岁)。均由病理检查证实。
6例患儿的临床表现、家族史、遗传史及有无诱因,如:肠息肉、炎性肠病等做一登记。并对肠癌标本再次核对病理学检查,有些病例还配合做免疫组织化学、基因等检测。化疗方案的制定。于术后每半年电话或/和门诊随访,5例获随访,1例失随访。
同时我们采用随机数字表法随机抽样同期20 ~ 30岁年龄组16例,50 ~ 60岁年龄组67例,复习病史及病理学检查,比较多见的临床表现与病理类型。
本组报告儿童CRC 6例,临床表现均以反复腹痛、腹部肿块、便血及肠梗阻为主,仅有1例有大便习性改变(例4)。本组均否认有肠息肉、炎性肠病史,例3其祖母2年前因结肠癌死亡。化疗方案均采用FOLFOX方案。
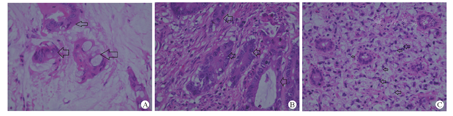
本组病例病理特征见表1。①肿瘤部位:结肠5例,以横结肠多见,直肠1例。②病理诊断:黏液腺癌2例,印戒细胞癌3例,管状腺癌1例,均有区域性淋巴结转移(图1A, 图1B, 图1C)。20 ~ 30岁组以管状腺癌及低分化型为主,而50 ~ 60岁年龄组则以管状腺癌为主(表2)。③病理中还发现1例横结肠肿瘤同时存在有肠壁肠神经元发育异常,例6自2岁起有典型便秘史。④例2十年前曾在外院做肝母细胞瘤切除术,术后常规辅以化疗,此次为二次肿瘤。
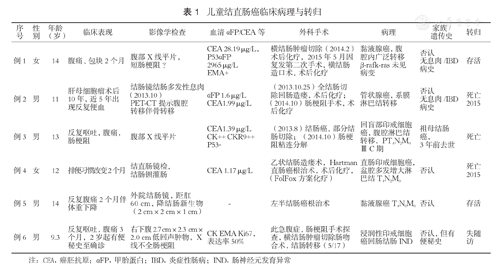
儿童结直肠癌临床病理与转归
儿童结直肠癌临床病理与转归
| 序号 | 性别 | 年龄(岁) | 临床表现 | 影像学检查 | 血清¦ÁFP/CEA等 | 外科手术 | 病理 | 家族/遗传史 | 转归 |
|---|---|---|---|---|---|---|---|---|---|
| 例1 | 女 | 14 | 腹痛、包块2个月 | 腹部X线平片,短肠梗阻? | CEA 28.19μg/L,P53¦ÁFP 2965μg/LEMA+ | 横结肠肿瘤切除(2014.2)术后化疗,2015年5月因复发第二次手术,横结肠造口术,术后化疗 | 黏液腺癌,腹腔内广泛转移¦Â-rafk-ras未见病变 | 否认无息肉/IBD病史 | 存活 |
| 例2 | 男 | 11 | 肝母细胞瘤术后10年,近5年出现反复便血 | 结肠镜结肠多发性息肉(2013.10)PET-CT提示腹腔转移伴骨转移 | ¦ÁFP 1.6μg/LCEA1.99μg/L | (2013.10.25)全结肠切除回肠造瘘,术后化疗;(2014.10)肠梗阻手术,术后化疗 | 管状腺癌,系膜淋巴结转移 | 否认无息肉/IBD病史 | 死亡2015 |
| 例3 | 男 | 13 | 反复呕吐,腹痛,肠梗阻 | 腹部X线平片 | CEA1.39μg/LCK++ CKR9++ P53- | (2013.8)结肠癌,部分结肠切除;(2014.10)肠梗阻粘连分解 | 回盲部印戒细胞癌,腹腔淋巴结转移,PT4N2M0 ⅢC期 | 祖母结肠癌,3年前去世 | 死亡 |
| 例4 | 女 | 12 | 排便习惯改变2个月 | 结直肠镜检,结肠钡灌肠 | CEA 1.17μg/L | 乙状结肠造瘘术,Hartman直肠癌根治术,术后化疗,(FolFox方案化疗) | 直肠印戒细胞癌,盆腔多发增大淋巴结T4N2M0 | 否认 | 死亡2015 |
| 例5 | 男 | 14 | 反复腹痛2个月伴体重下降 | 外院结肠镜,距肛60 cm,降结肠新生物(2 cm×2 cm×1 cm) | - | 左半结肠癌根治术 | 黏液腺癌T4N0M0 | 否认 | 存活 |
| 例6 | 男 | 9.3 | 反复呕吐,腹痛3个月,2岁起有便秘史至确诊 | 右下腹2.7 cm×2.3 cm×2.0 cm低回声肿物,X线不全肠梗阻 | CK EMA Ki67,表达率50% | 此急腹症,肠梗阻手术探查,横结肠肿瘤切除肠吻合术,结肠转移(5/17) | 浸润性印戒细胞癌回肠结肠IND | 否认,但有便秘史 | 失随访 |
注:CEA,癌胚抗原;¦ÁFP,甲胎蛋白;IBD,炎症性肠病;IND,肠神经元发育异常
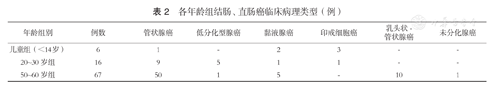
各年龄组结肠、直肠癌临床病理类型(例)
各年龄组结肠、直肠癌临床病理类型(例)
| 年龄组别 | 例数 | 管状腺癌 | 低分化型腺癌 | 黏液腺癌 | 印戒细胞癌 | 乳头状-管状腺癌 | 未分化腺癌 | |
|---|---|---|---|---|---|---|---|---|
| 儿童组(<14岁) | 6 | 1 | - | 2 | 3 | - | - | |
| 20~30岁组 | 16 | 9 | 5 | 1 | 1 | - | - | |
| 50~60岁组 | 67 | 50 | 1 | 5 | - | 10 | 1 | |

6例儿童结肠、直肠癌术后以电话或/和门诊回访,除1例失随访外,5例中已有3例死亡,2例存活并在继续化疗中。后者有胃纳差、体重下降等表现,生活自理能力明显比同龄儿童差。
儿童CRC是一种罕见的肿瘤,占所有儿童恶性肿瘤的1%[3]。近期美国国家肿瘤登记表统计了13年全美1 462 782例CRC,<21岁儿童918例,约占0.06%[4]。根据我们单中心的数据结果,儿童CRC占所有年龄段病例的0.18%。
成人CRC的常见症状是便血、贫血及大便习性改变,而儿童中表现为反复腹痛、便血、腹部包块。Kim等[5]曾统计约有2/3的<40岁CRC有反复腹痛。本组6例儿童CRC中大多数初发症状是反复腹痛,我们建议在临床上对反复腹痛的患儿检查时也需做结肠镜检查,以及时诊断治疗,改善预后。儿童CRC大多数发生在横结肠部位,较少发生在直肠,本组资料类同,而成人发病部位在直肠多见[6]。
成人与小儿CRC的组织学类型均为常见的腺癌,但儿童的组织类型以黏液腺癌,印戒细胞癌多见,导致小儿CRC预后较差[4]。据Sultan等[7]报道,儿童CRC 5年生存率仅40%左右,而成人可达60%。本组结果也是相似的。
与成人相比,儿童结肠直肠癌的癌前病变比例较高,其中常见的有家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)、Lynch综合征、家族性幼年性息肉病、炎性肠病等[8]。
肠神经元发育异常(inteotinal neuronal dyop-lasia,IND)是由Meier-Ruge[9]于1971年首先报道,是继先天性巨结肠后一种以小儿便秘为主的疾病。其组织学特征是肠神经节增生,伴神经节细胞发育幼稚。本组例6自幼起即有较严重便秘,时有腹胀,不全梗阻,未做治疗,致使慢性便秘持续存在,肠壁血运障碍抵抗力下降,发生结肠炎[10],这是CRC前期诱因病变,使其发生结肠癌风险增高。
例3父母提供其祖母3年前因结肠癌死亡的明确结肠癌家族史。众所周知,遗传因素、环境因素和基因突变是肿瘤临床发生学上重要的因素[11,12]。
在儿童结肠癌报告中也曾提到APC基因突变,MMR基因失错修复而引起的遗传性非息肉病结肠癌(hereditary nonpolyposis colen cancer,HNPCC)。
目前HNPCC诊断仍按Amsterdm标准[13]。可惜的是该患儿未做进一步基因检测,如MMR基因突变等有关病因的检查[14,15]。
二次肿瘤也称后发性恶性肿瘤(subsequent malignant neoplasms,SMNs)其概念是指在原发肿瘤治疗完成后至少2个月以上又发生组织学上另一种独立的恶性肿瘤[16,17]。这在儿童恶性实体瘤中也屡有报告,如儿童Wilm’s瘤、胚胎型RMS治疗后出现第二次肿瘤、甲状腺肿瘤放疗后第二次出现乳腺癌等[18,19]。SMNs发生的机制尚不明确,但文献研究报告其发病率的高低可能与原发肿瘤诊断早晚、是否接受化疗、遗传等状况有关[20]。本组例2一周岁时曾做过肝母细胞瘤手术切除后辅助化疗,整整十年后出现了SMNs,为结肠管状腺癌。
我们通过对文献的复习发现,儿童结肠、直肠癌作为第二次肿瘤发生极少见。曾有报告1例13岁男性患儿确诊肝母细胞瘤,外科切除肿物和放疗后接受6个疗程的PLADO方案化疗,20年以后出现第二次恶性肿瘤,病理诊断"胃肠道透明细胞肉瘤"[21]。
综上所述,儿童结、直肠癌罕见,我院报告6例,占我院同期全年龄段结、直肠癌总数的0.18%。临床表现与成年人结、直肠癌相似,但首发症状以反复腹痛、便血、腹部肿块、肠梗阻为主,大便习性改变少见。而成年人结、直肠癌则以大便习性改变为主。病理特征以结肠部位多见,以黏液腺癌和印戒细胞癌为主,大多有周边淋巴转移。成年组以管状腺癌为主。儿童结肠癌病理同时有肠神经元发育异常的病例。
所有作者均声明不存在利益冲突



























