
分析儿童滑膜肉瘤的临床特点、治疗方法及预后。
回顾性分析2008年1月至2014年11月重庆医科大学附属儿童医院、上海交通大学附属上海儿童医学中心、中山大学附属肿瘤医院、首都医科大学附属北京儿童医院4家医院收治的33例滑膜肉瘤患儿的临床资料和治疗情况,并进行预后分析。
33例患儿中位诊断年龄为8.0岁(4个月至16岁)。初诊时27例为局部肿块,6例出现肺、胸膜、骨或远处淋巴结转移。24例直接手术,9例行肿瘤活检术,其中3例在新辅助化疗3~4疗程后行二期手术;22例术后进行化疗,中位疗程数为7个(1~12个);10例术后进行局部放疗,总剂量为25~60 Gy,次数为5~25次。8例患儿在活检明确诊断或直接手术后化疗0~2疗程,放弃进一步治疗;其余25例按计划完成治疗,治疗结束时21例达到完全缓解(CR),3例疾病稳定(SD),1例疾病进展(PD)。11例患儿在缓解后中位随访时间14.5个月(3~48个月)因肿瘤原位复发或转移出现PD。除去8例放弃治疗的患儿,25例患儿中位随访时间为36个月(3~92个月)。随访至2015年11月,25例完成治疗的患儿,预计3年无病生存率(event-free survival, EFS)为(61.9 ± 10.1)%。将患儿的年龄(≤10岁,>10岁)、性别,肿瘤原发部位(四肢,轴线部位)、体积大小(≤5 cm,>5 cm)、IRS分期、诊断时是否远处转移以及首次术后有无残留各临床特征进行单因素预后分析,发现首次术后无残留患儿的无事件生存率更高(P=0.017),未发现其余各因素对预后的影响有统计学意义。
儿童滑膜肉瘤最多见于四肢,治疗方法以综合治疗为主,但缓解后易晚期复发或转移,首次术后无残留是影响预后的重要因素,有待寻找更有效的治疗方法提高长期疗效。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
滑膜肉瘤是一种高度恶性的间质肿瘤,可以发生于身体的各个部分[1],四肢尤其是下肢最常见,其次为头颈部和躯干,可以发生于任何年龄,中位诊断年龄为34岁[2],但仍是儿童最常见的非横纹肌软组织肉瘤[3],易发生晚期复发和转移[4]。儿童滑膜肉瘤最佳治疗方案有待确定,目前以手术、化疗和放疗综合治疗为主。儿童滑膜肉瘤与生存相关的预后因素包括肿瘤大小、转移、分期、部位、组织学亚型、分级和不完全切除等[5]。现总结2008年1月至2014年11月重庆医科大学附属儿童医院、上海交通大学附属上海儿童医学中心、首都医科大学附属北京儿童医院、中山大学附属肿瘤医院四家医院收治的33例滑膜肉瘤患儿的临床资料,分析其临床特点、治疗及预后,为国内首次对儿童滑膜肉瘤进行多中心临床研究。
入组患儿为2008年1月至2014年11月在重庆医科大学附属儿童医院、上海交通大学附属上海儿童医学中心、首都医科大学附属北京儿童医院、中山大学附属肿瘤医院收治的滑膜肉瘤患儿33例。其中,男24例,女9例,中位年龄8.0岁(4个月至16岁)。
收集患儿的年龄、性别、首诊症状、影像学、治疗情况等资料。
①患儿均行手术切除或者活检取得病理标本并符合以下特点:完全由卵圆形或梭形细胞构成的单相型;由梭形细胞及上皮样成分构成的双相型;由单相型和双相型成分及具有高侵袭性的多形性或圆形细胞组成的低分化型;②通过细胞遗传学,荧光原位杂交(FISH)或RT-PCR检测SYT-SSX融合基因及其表达产物来诊断。同时完成患儿头、胸、腹、盆腔、骨等部位CT或者MRI的检查,甲胎蛋白(AFP)、乳酸脱氢酶(LDH)的检查等。
由于对于儿童滑膜肉瘤,目前国内外没有专门的分期系统,常常根据Intergroup Rhabdomyosarcoma Study (IRS)术后分期系统分为Ⅰ、Ⅱ、Ⅲ和Ⅳ期[6] (表1)。

IntergroupRhabdomyosarcoma Study (IRS) 术后分期系统
IntergroupRhabdomyosarcoma Study (IRS) 术后分期系统
| 分期 | 特点 |
|---|---|
| Ⅰ期 | 局部肿瘤,手术完全切除,切缘阴性 |
| Ⅱ期 | 手术大体切除肿瘤,切缘镜下残余或局部淋巴结转移 |
| Ⅲ期 | 局部肿瘤,不能完全切除或仅手术活检,肿瘤大部分残留 |
| Ⅳ期 | 诊断时肿瘤已发生远处转移,包括胸水、腹水、脑脊液中找到肿瘤细胞 |
①手术治疗:包括初诊完全切除、不完全切除和活检,化疗后完全切除、不完全切除和始终未能切除肿瘤;②化疗;③放疗。
完全缓解状态(CR):CT、MRI和体检均未发现肿瘤残留迹象;部分缓解(PR):肿瘤体积减少34%~99%;疾病稳定(SD):肿瘤体积减少≤33%;疾病进展(PD):肿瘤体积增大40%或出现新的肿瘤。
门诊或电话随访。以诊断日期为开始随访时间,随访至2015年11月。统计终点为CR、PR、SD、PD和死亡。失访者以末次随访时疾病状态及时间为终点。
用SPSS20.0软件进行数据统计,非正态分布计量资料以中位数表示,计数资料以例数表示,生存资料及预后分析采用Kaplan Meier生存分析法,单因素分析采用Log-rank检验,以P<0.05为差异有统计学意义。
一般情况结果见表2。
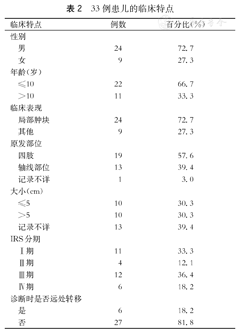
33例患儿的临床特点
33例患儿的临床特点
| 临床特点 | 例数 | 百分比(%) | |
|---|---|---|---|
| 性别 | |||
| 男 | 24 | 72.7 | |
| 女 | 9 | 27.3 | |
| 年龄(岁) | |||
| ≤10 | 22 | 66.7 | |
| >10 | 11 | 33.3 | |
| 临床表现 | |||
| 局部肿块 | 24 | 72.7 | |
| 其他 | 9 | 27.3 | |
| 原发部位 | |||
| 四肢 | 19 | 57.6 | |
| 轴线部位 | 13 | 39.4 | |
| 记录不详 | 1 | 3.0 | |
| 大小(cm) | |||
| ≤5 | 10 | 30.3 | |
| >5 | 10 | 30.3 | |
| 记录不详 | 13 | 39.4 | |
| IRS分期 | |||
| Ⅰ期 | 11 | 33.3 | |
| Ⅱ期 | 4 | 12.1 | |
| Ⅲ期 | 12 | 36.4 | |
| Ⅳ期 | 6 | 18.2 | |
| 诊断时是否远处转移 | |||
| 是 | 6 | 18.2 | |
| 否 | 27 | 81.8 | |
就诊时24例临床表现为局部肿块,其余9例分别表现为右上臂压痛、右上肢无力、右下肢疼痛伴活动障碍、胸痛伴双下肢乏力、反复腹痛、间歇性腹痛、发热伴胸闷、胸痛、双下肢乏力、间断憋喘、咳嗽以及吞咽困难。
19例位于四肢,13例位于轴线部位(例如:头-颈部、躯干、肺-胸膜、腹膜后等),1例原发部位记录不详。
初诊时27例为局部肿块,4例出现肺、胸膜或骨转移,2例出现远处淋巴结转移;1例患儿在治疗过程中出现颅内多发转移;3例患儿在CR后出现转移,1例为肺转移,另外2例具体部位记录不详。
所有患儿都通过手术切除或者活检取得病理标本明确诊断。只有1例进行了SYT-SSX融合基因检测,并且为阳性。
治疗情况见表3。
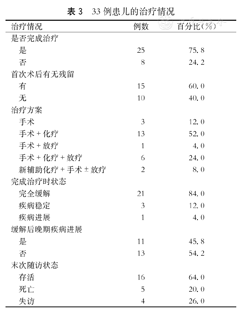
33例患儿的治疗情况
33例患儿的治疗情况
| 治疗情况 | 例数 | 百分比(%) | |
|---|---|---|---|
| 是否完成治疗 | |||
| 是 | 25 | 75.8 | |
| 否 | 8 | 24.2 | |
| 首次术后有无残留 | |||
| 有 | 15 | 60.0 | |
| 无 | 10 | 40.0 | |
| 治疗方案 | |||
| 手术 | 3 | 12.0 | |
| 手术+化疗 | 13 | 52.0 | |
| 手术+放疗 | 1 | 4.0 | |
| 手术+化疗+放疗 | 6 | 24.0 | |
| 新辅助化疗+手术±放疗 | 2 | 8.0 | |
| 完成治疗时状态 | |||
| 完全缓解 | 21 | 84.0 | |
| 疾病稳定 | 3 | 12.0 | |
| 疾病进展 | 1 | 4.0 | |
| 缓解后晚期疾病进展 | |||
| 是 | 11 | 45.8 | |
| 否 | 13 | 54.2 | |
| 末次随访状态 | |||
| 存活 | 16 | 64.0 | |
| 死亡 | 5 | 20.0 | |
| 失访 | 4 | 26.0 | |
初诊时9例患儿因肿瘤巨大或者部位特殊无法切除仅行活检,其中3例在新辅助化疗3~4疗程后行二期手术切除,3例术后均有残留;24例直接手术切除,10例完全切除,14例术后有残留;2例因术后有残留及6例因疾病复发行二次手术切除。手术切除方式包括肿物部分切除,大部分切除,完整切除,扩大切除以及截肢术。2例患儿因肿瘤无法切除行放射性粒子(I125)植入术,1例行自体造血干细胞移植术。
3例患儿在新辅助化疗3~4疗程后行二期手术,2例达CR; 22例术后进行化疗,其中19例按计划完成化疗,化疗结束时18例达CR,1例仍然PD。初始化疗方案主要是以异环磷酰胺和/或阿霉素为基础药物,包括:①环磷酰胺或异环磷酰胺+阿霉素;②环磷酰胺或异环磷酰胺+阿霉素+长春新碱;③异环磷酰胺+阿霉素+达卡巴嗪;④异环磷酰胺+顺铂+足叶乙甙;⑤顺铂+阿霉素。化疗疗程中位数为7个(1~12个)。
10例患儿术后进行局部放疗,总剂量为25~60 Gy,次数为5~25次,除2例未完成治疗,7例达CR,1例SD。
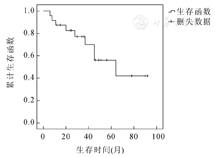
4例患儿在活检明确诊断后放弃治疗,4例患儿在直接手术后化疗0~2疗程,放弃进一步治疗;其余25例按计划完成治疗,其中21例患儿达到完全缓解(CR),3例疾病稳定(SD),1例疾病进展(PD)(为局部肿块进展,并出现颅内多发病灶转移,后放弃治疗,死亡)。11例患儿在缓解(2例SD,9例CR)后中位随访时间为14.5个月(3~48个月)因肿瘤原位复发或者转移出现PD,其中2例放弃进一步治疗后失访;1例患儿中药治疗后失访;1例患儿中药治疗后,行截肢术,肿瘤侵犯椎管,仍然PD后失访;其余7例手术或手术+化疗,截止随访时间2例CR,1例SD,4例死亡。完成治疗的25例患儿,中位随访时间为36个月(3~92个月)。随访至2015年11月,用SPSS20.0软件Kaplan-Meier法计算25例完成治疗患儿的无事件生存曲线如图1所示,预计3年无病生存率(event-free survival, EFS)为(61.9±10.1)%。

进一步用SPSS20.0软件Kaplan-Meier法进行生存分析,Log rank法比较不同年龄(≤10岁,>10岁)、性别,肿瘤原发部位(四肢,轴线部位)、体积大小(≤5 cm,>5 cm)、分期、诊断时是否有远处转移以及术后是否有残留各临床特征对预后的影响(检验水准为0.05)。结果如表4所示,显示首次术后无残留患儿EFS更好(P=0.017),而未发现本组患儿不同年龄(≤10岁,>10岁)(P=0.391)、性别(P=0.179)、肿瘤原发部位(四肢,轴线部位)(P=0.121)、大小(≤5 cm,>5 cm)(P=0.479)、IRS分期(P=0.090)、诊断时是否有远处转移(P=0.816)各组间EFS差异有统计学意义。
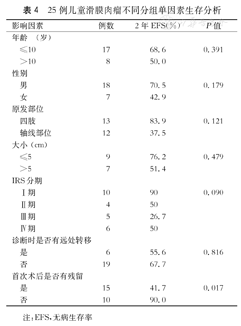
25例儿童滑膜肉瘤不同分组单因素生存分析
25例儿童滑膜肉瘤不同分组单因素生存分析
| 影响因素 | 例数 | 2年EFS(%) | P值 | |
|---|---|---|---|---|
| 年龄 (岁) | ||||
| ≤10 | 17 | 68.6 | 0.391 | |
| >10 | 8 | 50.0 | ||
| 性别 | ||||
| 男 | 18 | 70.5 | 0.179 | |
| 女 | 7 | 42.9 | ||
| 原发部位 | ||||
| 四肢 | 13 | 83.9 | 0.121 | |
| 轴线部位 | 12 | 37.5 | ||
| 大小(cm) | ||||
| ≤5 | 9 | 76.2 | 0.479 | |
| >5 | 7 | 51.4 | ||
| IRS分期 | ||||
| Ⅰ期 | 10 | 90 | 0.090 | |
| Ⅱ期 | 4 | 50 | ||
| Ⅲ期 | 5 | 26.7 | ||
| Ⅳ期 | 6 | 50 | ||
| 诊断时是否有远处转移 | ||||
| 是 | 6 | 55.6 | 0.816 | |
| 否 | 19 | 67.7 | ||
| 首次术后是否有残留 | ||||
| 是 | 15 | 41.7 | 0.017 | |
| 否 | 10 | 90.0 | ||
注:EFS,无病生存率
儿童滑膜肉瘤的临床症状无特异性,常常表现为局部肿块,几乎可以发生于全身各个部分,除了四肢、头颈部等常见原发部位,还有肾脏[7]、心脏[8]、结肠[9]、脊柱[10]、咽部[11]等罕见原发部位的报道,这增加了诊断的困难,容易延误诊断,常常需病理组织活检明确诊断。由于滑膜肉瘤的特异性染色体异位,导致18号染色体上的SS18与X染色体上的SSXs (SSX1、SSX2或SSX4)之一发生基因融合,可见于超过90%的患儿。因此通过细胞遗传学、荧光原位杂交(FISH)或RT-PCR检测SYT-SSX融合基因及其表达产物是诊断滑膜肉瘤的金标准[1]。
33例患儿中19例原发于四肢,6例原发于头颈部,2例原发于腰背部,其他罕见部位有胃肠道、腹膜后、椎管内以及纵隔旁,都通过手术或活检病理组织明确诊断。只有1例进行了SYT-SSX检测,并且为阳性。儿童滑膜肉瘤基本没有性别差异,但本组男性患儿多于女性患儿。
滑膜肉瘤患儿的治疗以手术、化疗和放疗的综合治疗为主要方案。由于儿童滑膜肉瘤属于一种高度恶性肿瘤,加上患儿的依从性差,4例患儿(均为Ⅲ期)在活检明确诊断后放弃治疗;4例患儿(1例Ⅰ期,3例Ⅲ期)在术后化疗0~2疗程,放弃进一步治疗。其余25例患儿(10例Ⅰ期,4例Ⅱ期,5例Ⅲ期,6例Ⅳ期),治疗结束时21例CR,3例SD,1例PD,缓解率为96.0%(24/25)。儿童滑膜肉瘤易发生晚期复发和转移[4], 45.8%(11/24)的患儿在缓解后中位随访时间为14.5个月(3~48个月)因肿瘤原位复发或者转移出现PD,预计3年EFS为(61.9±10.1)%。
Krieg等[12]发现手术是否完全切除肿瘤对预后的影响有统计学意义。本研究完成治疗的25例患儿中,10例首次术后完全切除肿瘤,达CR,与术后有残留的患儿相比,无事件生存率也更高。儿童滑膜肉瘤与成人软组织肉瘤相比,对化疗更加敏感,许多研究提倡术后进行化疗,但是否进行化疗或者新辅助化疗仍然存在争议,因为尚缺乏明确证据及前瞻性随机试验证明化疗的意义。最常用的化疗方案包括异环磷酰胺和阿霉素[13]。3例在新辅助化疗3~4疗程后行二期手术,达CR;19例术后进行化疗,化疗结束时18例达CR,1例仍然PD 。8例患儿术后根据病情进行局部放疗,7例达CR,1例SD。但由于各组病例数较少,病情严重程度也不一致,并不能很好地评估化疗及放疗对预后的影响。欧洲的一项前瞻性实验研究(EpSSG NRSTS 2005)[14]基于对患儿的风险分层不同,给予相应的治疗方法:低危患儿只行手术治疗,中危患儿行手术+化疗±放疗,高危患儿行新辅助化疗+手术+放疗。该研究患儿的3年EFS为81.9%,高于本组(61.9±10.1)%,可能由于本组肿瘤大小数据收集不完整,未能根据相应风险分层进行治疗。
各临床特征对儿童滑膜肉瘤预后的影响存在争议。Andrea等[15]发现原发于四肢的肿瘤较轴线部位预后更好。Speth等[16]发现原发于四肢的滑膜肉瘤较躯干部位的总生存率(OS)和无转移生存率更高,可能是因为位于躯干部位的肿瘤在晚期才能被发现,导致延误诊断。并且肿瘤的部位作为肿瘤风险分层的因素之一,原发于轴线部位的肿瘤,不管其他临床因素,都被划分为高危肿瘤[17]。Brecht等[18]对儿童和青少年滑膜肉瘤的回顾性分析发现,诊断时出现浸润转移的患儿的预后更差。许多研究还证明肿瘤大小对滑膜肉瘤预后有影响[2,4,12,16,17,19]。一项多中心多因素的回顾性分析[20]发现,肿瘤体积更大、出现远处转移或者IRS分期Ⅲ、Ⅳ期的患儿总生存率更低。本研究并没有证明各临床特征对预后的影响有统计学意义,可能与患儿依从性差,总病例数少且各组人数分布相差比较大有关。
综上所述,滑膜肉瘤可以发生于全身多个部位,临床症状无特异性,需活组织检查明确诊断。治疗方案以手术、化疗和放疗综合治疗为主。欧洲的前瞻性实验研究(EpSSG NRSTS 2005)[14]基于对患儿的风险分层不同,给予相应的治疗方法提高了患儿的3年EFS,在国际欧洲组(International European Group)达成了治疗儿童滑膜肉瘤的标准方法,但由于各风险层病例数过少,仍需进行临床随机试验来验证该方法。因此我们可以基于风险分层治疗儿童滑膜肉瘤,验证该方法的同时以期提高患儿长期疗效。儿童滑膜肉瘤易出现晚期复发和转移,因此需要长期随访,及时发现疾病进展,并进一步治疗,提高长期生存率。
所有作者均声明不存在利益冲突



























