
探讨新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis,NEC)后肠狭窄的临床特点及外科治疗。
回顾性分析浙江大学医学院附属儿童医院从2011年1月至2016年12月收治的确诊为NEC后肠狭窄患儿的临床资料。
全组107例患儿中,男68例,女39例;67例经过保守治疗后出现肠狭窄,临床表现为喂养不耐受,腹部立位X线平片检查表现为肠胀气或者低位肠梗阻,部分患儿行结肠造影可发现结肠狭窄;40例经过手术造瘘治疗,在二次手术常规探查远端肠管时发现肠狭窄,但并无肠狭窄相关症状。所有患儿均接受手术治疗,2例行肠造瘘分期手术,其余均行一期肠狭窄切除肠吻合术。伴发动脉导管未闭(patent ductus arteriosus,PDA)患儿31例,4例术中行PDA结扎术。1例伴发PDA患儿未行PDA结扎,术后死于肺纤维化,2例术后切口裂开,其余患儿均恢复良好。
NEC患儿经过保守治疗后出现喂养不耐受,需要警惕肠狭窄的发生;一期肠狭窄切除肠吻合效果良好,对病情危重的患儿可行分期手术;一期造瘘的NEC患儿二期手术时,需注意远端肠管的探查,警惕继发性肠狭窄;影响预后的伴发畸形,可在术中同步处理。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis,NEC)是新生儿尤其是早产儿、低出生体重儿常见的严重胃肠道疾病,具有发病迅速、早期诊断困难、病死率高、并发症多等特点。在早产儿中NEC的发生率在3%~5%,病死率高达50%[1]。近年来,NEC患儿经过急性期治疗后存活率大大提高,但相关并发症的发生率也随之提高。肠狭窄是NEC治疗后最常见的继发性病变,由于肠狭窄早期缺乏特异性临床表现,很难与喂养困难或胃肠炎相鉴别,易漏诊或误诊而导致生长发育迟缓、营养不良甚至出现穿孔、败血症和死亡等严重后果。本研究是对NEC后肠狭窄患儿的临床特点进行分析,总结诊疗经验。
回顾性分析我院2011年1月至2016年12月收治的确诊为NEC后肠狭窄患儿107例,其中67例(保守治疗组)经过内科保守治疗后出现肠狭窄,40例(手术造瘘组)在一期小肠造瘘术后出现肠狭窄。所有患儿中男68例,女39例;入院年龄1 d至7个月;出生体重890~4 150 g,出生体重平均为1 747 g,其中保守治疗组出生体重890~3 550 g,平均1 653 g,手术造瘘组出生体重在950~4 150 g,平均1 905 g。11例出生体重≥2 500g,53例出生体重为1 500~2 500g,37例出生体重为1 000~1 500 g,6例出生体重<1 000 g。107例患儿的孕周为26~42周,平均为32周,其中早产儿97例(90.7%),孕周平均为31.2周。保守治疗组孕周平均为31.6周,手术造瘘组孕周平均为32.6周。31例伴发动脉导管未闭(patent ductus arteriosus,PDA),动脉导管直径为0.1~0.5 cm;21例并发胆汁淤积症;9例发现有腹股沟斜疝;2例伴发梅克尔憩室;1例伴发肠重复畸形。具体见表1。
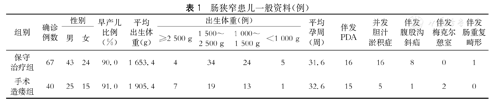
肠狭窄患儿一般资料(例)
肠狭窄患儿一般资料(例)
| 组别 | 确诊 例数 | 性别 | 早产儿 比例 (%) | 平均 出生体 重(g) | 出生体重(例) | 平均 孕周 (周) | 伴发 PDA | 并发 胆汁 淤积症 | 伴发 腹股沟 斜疝 | 伴发 梅克尔 憩室 | 伴发 肠重复 畸形 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | ≥2 500 g | 1 500~ 2 500 g | 1 000~ 1 500 g | <1 000 g | ||||||||||
| 保守 | |||||||||||||||
| 治疗组 | 67 | 43 | 24 | 90.0 | 1 653.4 | 4 | 34 | 24 | 5 | 31.6 | 16 | 16 | 8 | 0 | 1 |
| 手术 | |||||||||||||||
| 造瘘组 | 40 | 25 | 15 | 91.0 | 1 905.4 | 7 | 19 | 13 | 1 | 32.6 | 15 | 5 | 1 | 2 | 0 |
对保守治疗组中的65例行一期肠狭窄切除肠吻合术,其中开放性手术49例,腹腔镜手术16例;2例因术中发现仍有活动性病变,伴有多发性狭窄,病情较重,于其近端行肠造瘘,二期再行肠造瘘关闭术。对40例手术造瘘组患儿行一期肠狭窄段切除肠吻合术。31例伴发PDA,5例动脉导管较粗,直径均大于0.4 cm,肺血增加明显,4例在术中同步行PDA结扎。9例伴发腹股沟斜疝,均在术中行疝囊高位结扎术。21例胆汁淤积症患儿,有4例大便颜色较浅,B型超声提示胆囊较小,在术中行胆道造影,胆总管显影均清晰,排除胆管畸形。伴发的梅克尔憩室、肠重复畸形均在术中完整切除。
采用SPSS 19.0软件进行统计分析,计数资料的比较采用卡方检验,以P<0.05为差异有统计学意义。
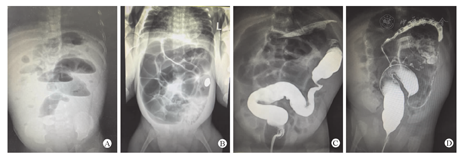
保守治疗组经过急性期治疗后,开奶不久出现喂养不耐受,如胃潴留、呕吐、腹胀等症状,排便次数及量减少。本组中有8例患儿肠狭窄出现在近端回肠,距离回盲部约50~60 cm,狭窄位置偏高(图1A),临床表现以呕吐腹胀为主,呕吐发生率为87.5%,腹胀发生率为75%,腹部X线立位片提示肠梗阻。59例患儿肠狭窄位置以远端回肠和结肠为主,远端回肠的肠狭窄距离回盲部约2~12 cm,临床表现以腹胀为主,腹胀发生率为100%,腹部X线立位片提示不同程度的肠胀气或低位肠梗阻(图1B)。对22例患儿行结肠造影,其中16例发现典型结肠狭窄(图1C),6例未见结肠狭窄,造影剂无法顺利通过回盲部,但可见明显扩张的近端小肠。手术造瘘组患儿经过肠造瘘后,近端肠管未发生狭窄,肠狭窄发生在造瘘口远端,患儿并无肠狭窄相关临床症状,只在肠造瘘回纳时常规探查远端肠管发现肠狭窄。14例患儿行结肠造影,检查结果均显示结肠狭窄(图1D)。

保守治疗组患儿肠狭窄出现的时间范围在13~86 d,平均30.5 d。手术造瘘组患儿在二次手术时常规探查远端肠管发现有肠狭窄,肠狭窄出现的时间无法确定。关于肠狭窄的部位,107例患儿共有185处狭窄,53例患儿伴多发肠狭窄,其中9处狭窄出现在近端回肠,42处出现在远端回肠(回盲部),63处出现在升结肠,41处出现在横结肠(脾曲),19处出现在降结肠,11处出现在乙状结肠。保守治疗组患儿肠狭窄部位以远端回肠(回盲部)、升结肠和横结肠(脾曲)为主,手术造瘘组以升结肠和横结肠(脾曲)为主。整组结肠狭窄所占比例为72.4%(134/185),其中保守治疗组为67.5%(79/117),手术造瘘组为80.9%(55/68)。
1例伴发PDA的患儿,动脉导管较粗,但未行PDA结扎术,术后患儿反复发生肺炎肺淤血,最终因肺纤维化、肺功能衰竭死亡,2例因术后切口裂开行再次手术缝合。除上述死亡病例外,余106例在术后3~6 d恢复饮食,均恢复良好。术后随访,2例因粘连性肠梗阻再次入院予以保守治疗,好转后出院,其余患儿无粘连性肠梗阻或吻合口狭窄等并发症。
肠狭窄是NEC最常见的继发性病变,可发生在NEC保守治疗后或手术造瘘后。尽管对NEC的发病原因已经有了很多研究,但对NEC后肠狭窄的发生原因及临床特点的研究较少。有学者在1968年发表了第一个NEC后肠狭窄的报告[2]。随着NEC保守治疗成功率的不断提高,近年来,NEC后肠狭窄的发生率呈上升趋势,发生率高达40%[3,4]。
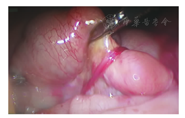
NEC并发的肠狭窄系继发性肠狭窄,任何引起新生儿肠管损伤和肠系膜血管缺血的原因,均可导致肠狭窄甚至肠闭锁。肠内肌层的缺血性损伤在NEC后肠狭窄的发病中起重要作用[1,5]。多数学者认为继发性肠狭窄是血栓及炎症造成的肠壁缺血性损伤修复的结局,尤其是既往有肠道炎症性疾病的患儿,局部肠道炎症反应导致胶原沉积、纤维化和伤口收缩,形成肠腔的狭窄或完全性梗阻[1,6]。也有观点认为机械性压力可能是部分继发性肠狭窄及闭锁的发生机制。如肠粘连带、肠管及其系膜供血血管被索带压迫,导致肠壁的供血中断,肠壁缺血坏死、炎症及重吸收最终发展成肠狭窄或闭锁[7]。本研究中狭窄位于回肠的患儿,狭窄部位的肠管与周围组织多有不同程度的粘连或索带压迫(图2)。肠壁局部血供障碍、持续炎症和坏死组织吸收,三者共同作用继而发生肠狭窄甚至出现肠闭锁[8]。

NEC后肠狭窄发生的时间因患儿初始病情的严重程度及发病部位不同而有差异,在急性期缓解后的前3个月是肠狭窄发展的关键时期[3]。Heida等[3]研究发现患儿经过保守治疗后出现肠狭窄症状的时间为16~91 d。Goettler等[9]报道了1例于NEC后11年继发了肠狭窄的病例。本研究中67例保守治疗患儿,肠狭窄发生的时间为13~86 d,平均30.5 d。文献报道NEC后肠狭窄的部位以结肠为主,Gaudin等[4]研究报道80%以上的肠狭窄发生在结肠。Heida等[3]发现经过保守治疗后肠狭窄的部位主要为横结肠和降结肠,经过手术治疗后的部位主要为升结肠。肠狭窄以结肠和末端回肠为主,可能与回盲部的解剖位置及功能特殊性相关。左半结肠的血流低于其他肠段,结肠的活动也伴随减少,尤其是脾区,是肠系膜上和肠系膜下动脉供血的终端,对缺血的敏感性相应增加,所以是狭窄的常见部位。本研究保守治疗组患儿肠狭窄部位以远端回肠(回盲部)、升结肠和横结肠(脾曲)为主,手术造瘘组以升结肠和横结肠(脾曲)为主,整组结肠狭窄所占比例为72.4%(134/185),其中保守治疗组为67.5%(79/117),手术造瘘组为80.9%(55/68),两组之间的差异考虑与手术造瘘组切除病变坏死的小肠有关,切除了可能发展为肠狭窄的小肠,结肠狭窄比例增加。需要强调的是肠狭窄有很大的可能性是多发的,本研究中有53例患儿为多发肠狭窄,故术中需探查所有肠段以防多发肠狭窄。
NEC后肠狭窄患儿的临床表现为反复出现喂养不耐受,如胃潴留、呕吐、腹胀、便秘等。肠狭窄严重程度不同或梗阻位置不同,其症状严重程度和发生时间均有不同,肠狭窄严重或梗阻位置较高的患儿,症状出现的早,反之症状出现较晚。对于肠造瘘的患儿,狭窄段往往在造瘘远端,可无明显的临床症状。NEC后肠狭窄的辅助检查,腹部立位X线平片为首选,多数可表现为低位肠梗阻或肠胀气。结肠造影检查对于结肠狭窄有很高的特异性[10]。本研究中36例患儿接受结肠造影检查,有30例提示结肠狭窄,其中19例提示降结肠狭窄,11例提示乙状结肠狭窄,与术中证实狭窄位置一致。对于结肠造影检查未见肠狭窄的患儿,要注意近端小肠的扩张情况,结合临床症状及病史予以甄别,必要时行全消化道造影。对于NEC病史明确,临床症状典型,腹部立位X线平片提示肠梗阻的患儿,就有手术探查指征。
外科手术是治疗NEC后肠狭窄唯一有效的手段。目前多数采取一期狭窄段切除肠吻合,对不能排除先天性巨结肠的患儿,可同时行肠活检手术。本研究对保守治疗组患儿中的65例行一期肠狭窄切除肠吻合术,对于狭窄段近端过度扩张肥厚的肠管,由于失去蠕动能力予以一并切除;2例术中发现仍有活动性病变,伴有多发性狭窄,病情较重,于其近端行的肠造瘘,二期再行肠造瘘关闭术。对40例手术造瘘组患儿行一期肠狭窄切除肠吻合术。随着小儿腹腔镜技术的发展,部分患儿可行腹腔镜探查治疗NEC后肠狭窄[11]。腹腔镜手术较传统手术具有创伤小,恢复快,探查范围广以及并发症减少等优点,可有效避免腹部长切口,防止过多的肠管暴露以及损伤,减少腹腔内肠粘连。本研究中16例患儿在腹腔镜辅助下行一期狭窄段切除肠吻合,术后创伤小,恢复快。
影响NEC后肠狭窄预后的因素较多,对伴发畸形的处理是其中之一。先天性心脏病是影响NEC预后的重要危险因素,PDA是最常见的先天性心脏病,在低出生体重儿中比例达33%,极低出生体重儿中比例高达65%[12]。伴发PDA的患儿,若动脉导管过粗,左向右分流增大,肺血增加明显,不利于术后肺功能的恢复。出生孕周越小,需要手术结扎的概率就越高,出生孕周为24周的早产儿需要手术结扎的概率高达40%,26周概率约30%[13]。本研究31例伴发PDA ,27例系早产儿,其中5例动脉导管直径均大于0.4 cm,平均直径为0.45 cm,肺血增加明显,4例术中同步行PDA结扎,术后恢复良好。1例未行PDA结扎术,术后患儿因肺纤维化、肺功能衰竭死亡。因此,伴发PDA的患儿,若动脉导管过粗、肺血增加明显则需要高度重视并积极处理。
经过保守治疗后出现肠狭窄的患儿,由于喂养不耐受,需要肠外营养支持(parenteral nutrition,PN),而小肠造瘘术后的患儿,由于过多的肠管切除致短肠综合征,也需要PN的支持。长时间接受PN的患儿易出现与PN相关的并发症,PN相关胆汁淤积(PN-associated cholestasis,PNAC)是最常见的严重并发症[14]。本研究中21例胆汁淤积症患儿,16例为保守治疗组,占76%,考虑手术造瘘组患儿经过手术造瘘后,可以缩短禁食时间,伴发胆汁淤积比例明显减少。对于PNAC患儿均加用鱼油脂肪乳剂,能防止肝细胞损伤和胆汁淤积,可以有效的逆转PNAC[15]。对于黄疸怀疑胆道闭锁的患儿,可以在术中同时行胆道探查、造影予以明确。
综上所述,肠狭窄是NEC后最常见的继发性病变。NEC后患儿若出现反复喂养不耐受,需考虑伴发肠狭窄。狭窄段常发生于结肠和远端回肠,以结肠为主,且有多发狭窄的可能。一期肠切除肠吻合的效果良好,若部分患儿伴发PDA、腹股沟斜疝等畸形,可于术中一并处理。
所有作者均声明不存在利益冲突



























