
探讨影响儿童肢体骨肉瘤患儿(≤14岁)临床预后的相关因素。
回顾性分析2000年6月至2017年10月国内7家骨肿瘤治疗中心收治的14岁以下肢体骨肉瘤患儿的病历资料,记录其一般资料、外科分期、术前有无穿刺活检、化疗方案、化疗次数、手术方式、复发转移及生存预后情况,应用Kaplan-Meier法描绘生存曲线并计算生存率,应用Log-rank检验进行单因素生存预后分析,应用Cox回归模型进行多因素的生存预后分析。
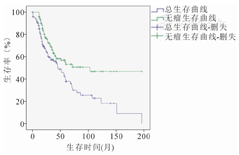
肢体骨肉瘤患儿共147例,男73例,女74例。肢体骨肉瘤患儿的3、5年总生存率分别为65%、53%,中位总生存时间103个月(95%CI:92.8~128.5),3、5年的无瘤生存率分别为46%、38%,中位无瘤生存时间为33个月(95%CI:71.9~104.3)。膝关节周围:123例,膝关节以外:24例。Enneking外科分期:Ⅱ期139例,Ⅲ期8例。其中应用保肢术128例,截肢术19例。规范化疗组78例,非规范化疗组69例,规范化疗组与非规范化疗组5年总生存率分别为62%、43.8%;5年无瘤生存率分别为50.2%、31.6%。无复发转移的有75例,单纯复发13例,单纯转移41例,多发转移(包括复发伴转移)18例,其5年总生存率分别为88%、51.3%、21.4%、0。单因素分析结果显示:规范化疗、Enneking外科分期、术后辅助化疗次数和复发转移是影响肢体骨肉瘤患儿生存预后的相关因素(P<0.05);而性别、部位、手术方式及化疗方案中是否应用甲氨蝶呤(MTX)不是影响患儿生存预后的相关因素(P>0.05)。Cox回归多因素分析结果显示:规范化疗和复发转移是影响肢体骨肉瘤患儿生存预后的独立因素。
规范的进行辅助化疗、有效的控制复发和转移可以提高肢体骨肉瘤患儿(≤14岁)的生存率,改善患儿的预后,化疗的不规范及复发转移严重影响患儿的预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨肉瘤作为最常见的骨原发性恶性肿瘤,其年发病率约为100万分之2~3,发病总数占人类恶性肿瘤的0.2%,占原发骨肿瘤的11.7%[1,2,3]。研究表明,骨肉瘤在所有种族和性别的年发病率在0~14岁范围内为4.0 (3.5~4.6)/1 000 000,其发病率与年龄的变化有相关性,骨肉瘤发病有两个高峰期,第一个高峰期出现在10~14岁的年龄组,与青春期生长激增同时出现。第二个高峰期出现在65岁以上的老年人[4]。骨肉瘤的发病部位主要发生于长骨的干骺端[5]。其作为一种骨的恶性肿瘤,不仅容易复发而且早期容易发生转移。肿瘤一旦发生复发和转移,往往预示着预后较差[6]。目前,随着新辅助化疗的推广和有效的早期手术干预,我国骨肉瘤患者的5年生存率已经从过去的不足20%提高到现在的60%以上,保肢率也达到了90%以上[7] 。儿童骨肉瘤的临床特点及预后和成人虽有相似之处,但是儿童骨肉瘤发病也有其特有的临床特征:发病率高,预后较成人差[4,8],保肢和肢体功能的恢复要求较高等,因此改善儿童肢体骨肉瘤患者的临床预后及提高其生活质量,已成为当代骨肿瘤科医生们关注的热点。
目前因国内对于多中心儿童肢体骨肉瘤患者的临床特点及生存预后分析的大宗样本报道较少,谭平先等[9]曾在2012年报道了单中心39例儿童骨肉瘤患者的生存预后情况。为了解我国近些年来多中心儿童肢体骨肉瘤患者的临床预后现状,本研究收集了从2000年6月至2017年10月国内7家医院骨肿瘤治疗中心的部分儿童肢体骨肉瘤患者(≤14岁)的临床资料,包括:中国人民解放军第960医院、空军军医大学西京医院、东部战区总医院、上海市第六人民医院、上海瑞金医院、河北医科大学第三附属医院和天津医院。记录其一般资料、发病、诊治及生存预后情况等,逐个分析各个因素及相关因素对儿童肢体骨肉瘤患者的生存预后的影响,并与国内外有关儿童骨肉瘤患者临床预后的研究进行比较,进一步探讨影响儿童肢体骨肉瘤患者临床预后的相关因素,以期反映我国儿童肢体骨肉瘤患者的临床预后现状。本研究经过中国人民解放军第960医院伦理委员会批准通过[(2019)科研伦理审第(82)号]。
①年龄≤14岁;②病理确诊为骨肉瘤者;③原发部位为肢体长骨者;④随访时间≥12个月者。
①治疗过程中未行手术治疗者;②骨肉瘤为继发者;③随访过程中因非肿瘤相关疾病及意外等死亡的患儿。
记录患儿的一般资料、外科分期、术前有无穿刺活检、化疗情况、手术方式、复发转移、生存预后情况,一般资料包括姓名、性别、年龄、发病部位等。外科分期按照Ennecking外科分期。化疗情况包括:手术前后化疗方案、有无规范化疗及术后化疗次数。手术方式主要包括保肢和截肢两大类。复发转移包括:无复发及转移、单纯复发、单纯转移、多发转移(包括复发伴转移)。
2000年6月至2003年12月,化疗方案尚不统一(对于手术前后均采用一线化疗药物并且化疗次数符合本研究拟定的规范化疗组要求的,均列入了规范化疗组)。2004年1月至2017年10月,手术前后主要采用一线化疗药物:顺铂(DDP)-阿霉素(ADM)-异环磷酰胺(IFO)三药联和化疗(即DIA方案),应用或不应用甲氨蝶呤(MTX);二线化疗药物主要包括紫杉醇(TAX)、长春新碱(VCR)、培美曲塞(MTA)、多西他赛(TXT)等。根据患儿化疗情况分为规范化疗组和非规范化疗组(因目前国内尚未形成有关骨肉瘤规范化疗的专家共识,规范化疗组的定义为本研究所拟定),规范化疗组定义为:①手术前后分别应用DIA(或DIA+MTX/二线化疗药物) ,剂量分别为DDP 120~140 mg / m2,IFO 15 g / m2,ADM 90 mg / m2,MTX 8~10 g / m2 ;②术前≥2次,术后≥4次,化疗方案及次数与上述条件不符合者均定义为非规范化疗。对于复发和转移后的治疗,会根据化疗药物的有效性,复发、转移的部位和类型,选择个体化的治疗方案。术后化疗次数也是根据术后应用DIA(或DIA+MTX /二线化疗药物)的次数来统计的。
分为保肢术和截肢术。保肢术包括:瘤段灭活回植术、单纯瘤段切除肿瘤型假体置换术、瘤段切除自体(或异体)骨重建术等。手术方式的选择主要根据肿瘤侵袭的程度,患儿的骨骺有无闭合,重要神经血管受累的情况,当地骨肿瘤科医生的临床经验,患儿及家属的意愿,等多方面因素所决定。
总的随访时间:12~196个月,中位随访时间为103个月,随访的时间间隔为手术治疗结束后,最初的2年,每3个月1次;第3年,每4个月1次;第4、5年,每6个月1次;6年以后,每年1次。随访内容主要包括患儿生存情况和确定有无复发及转移,并评估患儿的肢体功能。随访方式采用门诊复查及电话随访,对于不能按时门诊复查的患儿会电话通知并询问其生存情况,每次门诊复查均进行体格检查并完善患肢及肺部的相关影像学检查,以确定是否有复发及转移。
应用SPSS 13.0统计软件,用Kaplan-Meier法计算生存率并绘制总的和无瘤的生存曲线。其中总生存期为自确诊时间至死亡或末次随访的时间;无瘤生存期为自确诊时间至肿瘤复发或转移的时间或末次随访的时间。对性别、发病部位、是否穿刺活检、手术前后化疗方案、手术方式、Enneking外科分期等10项因素应用Log-rank检验进行单因素生存预后分析,检验水准为α=0.05,并将单因素分析中有统计学意义的因素纳入Cox回归模型进行多因素预后分析。
共有147例符合纳入标准的儿童骨肉瘤患者,总的生存情况及无瘤生存情况:3、5年总生存率分别为65%、53%,中位总生存时间103个月(95%CI:92.8~128.5),3、5年的无瘤生存率分别为46%、38%,中位无瘤生存时间为33个月(95%CI:71.9~104.3)。(图1)

男73例,女74例。男、女5年的总生存率分别为:56.6%、50.2%(χ2 =0.566,P=0.452)(表1)。
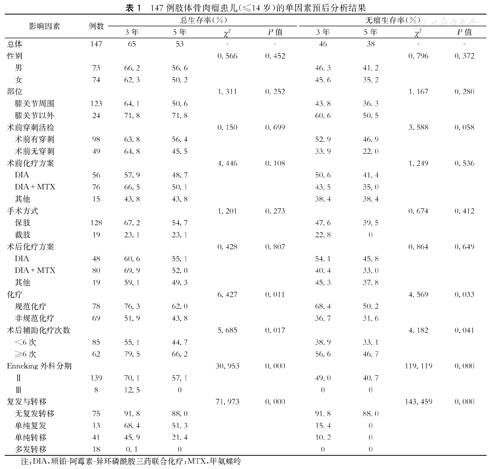
147例肢体骨肉瘤患儿(≤14岁)的单因素预后分析结果
147例肢体骨肉瘤患儿(≤14岁)的单因素预后分析结果
| 影响因素 | 例数 | 总生存率(%) | 无瘤生存率(%) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 3年 | 5年 | χ2 | P值 | 3年 | 5年 | χ2 | P值 | |||
| 总体 | 147 | 65 | 53 | - | - | 46 | 38 | - | - | |
| 性别 | 0.566 | 0.452 | 0.796 | 0.372 | ||||||
| 男 | 73 | 66.2 | 56.6 | 46.3 | 41.2 | |||||
| 女 | 74 | 62.3 | 50.2 | 45.6 | 35.2 | |||||
| 部位 | 1.311 | 0.252 | 1.167 | 0.280 | ||||||
| 膝关节周围 | 123 | 64.1 | 50.6 | 43.8 | 36.3 | |||||
| 膝关节以外 | 24 | 71.8 | 71.8 | 60.6 | 50.5 | |||||
| 术前穿刺活检 | 0.150 | 0.699 | 3.588 | 0.058 | ||||||
| 术前有穿刺 | 98 | 63.8 | 56.4 | 52.9 | 46.9 | |||||
| 术前无穿刺 | 49 | 64.8 | 45.5 | 33.9 | 22.0 | |||||
| 术前化疗方案 | 4.446 | 0.108 | 1.249 | 0.536 | ||||||
| DIA | 56 | 57.9 | 48.7 | 50.6 | 41.4 | |||||
| DIA+MTX | 76 | 66.5 | 50.1 | 43.5 | 35.0 | |||||
| 其他 | 15 | 43.8 | 43.8 | 38.4 | 38.4 | |||||
| 手术方式 | 1.201 | 0.273 | 0.674 | 0.412 | ||||||
| 保肢 | 128 | 67.2 | 54.7 | 47.6 | 39.5 | |||||
| 截肢 | 19 | 23.1 | 23.1 | 22.8 | 0 | |||||
| 术后化疗方案 | 0.428 | 0.807 | 0.864 | 0.649 | ||||||
| DIA | 48 | 60.6 | 55.1 | 54.1 | 45.8 | |||||
| DIA+MTX | 80 | 69.9 | 52.0 | 40.4 | 33.0 | |||||
| 其他 | 19 | 59.1 | 49.3 | 45.3 | 37.8 | |||||
| 化疗 | 6.427 | 0.011 | 4.569 | 0.033 | ||||||
| 规范化疗 | 78 | 76.3 | 62.0 | 68.4 | 50.2 | |||||
| 非规范化疗 | 69 | 51.9 | 43.8 | 36.7 | 31.6 | |||||
| 术后辅助化疗次数 | 5.685 | 0.017 | 4.182 | 0.041 | ||||||
| <6次 | 85 | 55.1 | 44.7 | 38.9 | 33.1 | |||||
| ≥6次 | 62 | 79.5 | 66.2 | 56.6 | 46.7 | |||||
| Enneking外科分期 | 30.953 | 0.000 | 119.119 | 0.000 | ||||||
| Ⅱ | 139 | 70.1 | 57.1 | 49.0 | 40.7 | |||||
| Ⅲ | 8 | 12.5 | 0 | 0 | 0 | |||||
| 复发与转移 | 71.973 | 0.000 | 143.459 | 0.000 | ||||||
| 无复发转移 | 75 | 91.8 | 88.0 | 91.8 | 88.0 | |||||
| 单纯复发 | 13 | 68.4 | 51.3 | 15.4 | 0 | |||||
| 单纯转移 | 41 | 45.9 | 21.4 | 10.2 | 0 | |||||
| 多发转移 | 18 | 0.1 | 0 | 0 | 0 | |||||
注:DIA,顺铂-阿霉素-异环磷酰胺三药联合化疗;MTX,甲氨蝶呤
膝关节周围123例,股骨远端79例,胫骨近端39例,腓骨近端5例。膝关节以外24例,股骨近端8例,胫骨远端6例,肱骨近端9例,桡骨远端1例。膝关节周围及以外的5年总生存率分别为:50.6%、71.8%(χ2=1.311,P=0.252)。
术前进行穿刺活检98例,未穿刺活检49例,术前穿刺活检比率:66.7%,是否穿刺活检的5年总生存率分别为56.4%、45.5%(χ2=0.150,P=0.699)。
保肢手术128例,截肢手术19例,保肢和截肢的5年总生存率分别为:54.7%、23.1%(χ2=1.201,P=0.273)(表2)。
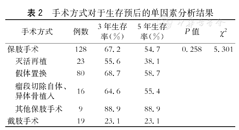
手术方式对于生存预后的单因素分析结果
手术方式对于生存预后的单因素分析结果
| 手术方式 | 例数 | 3年生存率(%) | 5年生存率(%) | P值 | χ2 | |
|---|---|---|---|---|---|---|
| 保肢手术 | 128 | 67.2 | 54.7 | 0.258 | 5.301 | |
| 灭活再植 | 23 | 55.6 | 38.1 | |||
| 假体置换 | 80 | 68.7 | 58.7 | |||
| 瘤段切除自体、异体骨植入 | 16 | 64.6 | 55.4 | |||
| 其他保肢手术 | 9 | 88.9 | 88.9 | |||
| 截肢手术 | 19 | 23.1 | 23.1 | |||
初诊时Ⅱ期139例,Ⅲ期8例,Ⅱ期、Ⅲ期的5年总生存率分别为57.1%、0,(χ2=30.953,P=0.000)。术后辅助化疗次数<6次:85例,≥6次:62例,其5年总生存率分别为44.7%和66.2%(χ2=5.685,P=0.017)。
规范化疗组78例,非规范化疗组69例,规范化疗与非规范化疗组的5年总生存率分别为62%和43.8%,(χ2=6.427,P=0.011)(图2)。
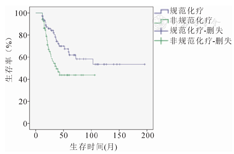

73例男性患儿中规范化疗组与非规范化疗组分别为42例和31例,5年总生存率分别为66.8%、42.1%(χ2=4.431,P=0.035)。74例女性患儿中:规范化疗组与非规范化疗组分别为39例和35例,5年总生存率分别为61.5%、39.4%(χ2=4.774,P=0.029)。
128例保肢手术患儿中规范化疗组与非规范化疗组分别为70例和58例,5年总生存率分别为66%和42.5%(χ2=9.778,P=0.002)。19例截肢手术患儿中规范化疗组与非规范化疗组分别为8例和11例,3年总生存率分别为12.5%和0(χ2=8.924,P=0.003)。
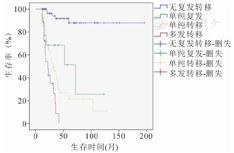
所有肢体骨肉瘤患儿在随访过程中,无复发转移共有75例(51%),单纯复发13例(9%),单纯转移41例(28%),多发转移18例(12%),其5年总生存率分别为88%、51.3%、21.4、0(多发转移5年生存的患儿未统计到),(χ2=71.973,P=0.000)(图3)。

将单因素分析中有统计学意义的"规范化疗、Enneking外科分期、术后辅助化疗次数和复发转移"这4项因素纳入Cox回归模型进行多因素分析,结果显示:规范化疗和复发转移是影响儿童肢体骨肉瘤患者预后的独立因素(表3)。

COX多因素回归分析结果
COX多因素回归分析结果
| 影响因素 | 回顾系数 | 标准误 | Wald χ2值 | 自由度 | P值 | OR值 |
|---|---|---|---|---|---|---|
| 规范化疗 | 0.795 | 0.290 | 7.501 | 1 | 0.006 | 2.214 |
| 复发转移 | 1.083 | 0.150 | 51.999 | 1 | 0.000 | 2.952 |
目前我国对于多中心的儿童肢体骨肉瘤患者的发病及生存预后尚未有大规模的数据报道,谭平先等[9]在2012年报道了1998~2008年10年间单中心39例11岁以下儿童四肢骨肉瘤患者的生存预后情况,其3年及5年生存率分别为:41.2%、41.2%。Moreno等[10]在2017年报道了在阿根廷2000~2013年间的515例14岁以下儿童骨肉瘤患者的发病及预后情况,当地的年发病率约为3.2/1 000 000,5年总生存率约为45%,骨肉瘤病灶局限的患儿5年生存率为52%,发生转移的患儿5年生存率为22%。在Gorlick等[11]报道的美国儿童骨肉瘤患者的预后研究中:肿瘤病灶局限的骨肉瘤患儿5年总生存率为70%,而出现转移的10年总生存率为25%。Bacci等[12]曾在2008年报道了意大利的133例10岁以下儿童骨肉瘤的5年总生存率和无瘤生存率分别为71%和63%。Hsieh等[13]在2009年报道了台湾儿童骨肉瘤患者的5年总生存率为51.3%。本研究中儿童肢体骨肉瘤患者的5年总生存率为53%,略高于Hsieh等[13]及Moreno等[10]报道的5年总生存率。发生转移的儿童患者5年总生存率为21.4%,基本和Moreno等[10]报道的22%持平,但明显低于美国和意大利等发达国家报道的儿童骨肉瘤患者的5年生存率。由此可见,儿童骨肉瘤的预后和国家的社会经济水平有一定相关性的,原因可归结为:发达国家具有较好的医疗配套设施、正规的骨肿瘤诊疗机构比较完善、综合性医院更加注重多学科、多专业的综合治疗、以及治疗过程中规范的进行辅助化疗。
自20世纪70年代Rosen等提出新辅助化疗的概念,证实新辅助化疗对原发性肿瘤有确切的疗效,经过多年的发展和完善,新辅助化疗可改善骨肉瘤患者的生存预后已成为共识[14,15,16,17]。本研究中定义的规范化疗也是建立在新辅助化疗基础之上的。目前因国内研究报道中,对于规范化疗的定义尚未形成专家共识,其作为影响儿童肢体骨肉瘤患者临床预后因素的研究报道较少,本研究也可为以后骨肉瘤规范化疗的制定提供的参考。本研究中规范化疗组与非规范化疗组的患儿分别为78例(53%)和69例(47%),其中规范化疗组的3、5年总生存率分别为76%、62%,要明显高于非规范化疗组3、5年的51.9%和43.8%,这与国内部分研究结果一致[9,18]。另外,本研究从不同性别及不同手术方式进行了规范化疗与非规范化疗组的预后对比分析,结果均P<0.05,即进一步证实了是否规范化疗在儿童患者预后中具有统计学意义。虽然儿童组的规范化疗的患者5年总生存率能达到62%,但是和韩加等[18]研究的全部年龄段骨肉瘤规范化疗的5年总生存率为72%,还是有一定差距的,这可能因为儿童骨肉瘤患者的体质相对青壮年较差,化疗后的身体耐受性及肿瘤的反应性较差等原因。另外Bacci等[8]也认为14岁以下骨肉瘤患儿的预后明显比14岁以上患者的预后要差,这也更加证实了儿童骨肉瘤的预后相对成人来说,预后较差的临床特征。本研究中还分析出术后辅助化疗≥6次的患儿,其5年总生存率66.2%,要明显高于<6次的44.7%,并且术后辅助化疗次数对于儿童肢体骨肉瘤患者的预后差异具有统计学意义(χ2=5.685,P=0.017)。祁伟祥等[19]及李磊等[20]在儿童和青少年骨肉瘤的预后研究中也得出此结论。
复发转移是导致骨肉瘤患者死亡的主要原因之一,肺是骨肉瘤发生远处转移的最常见部位[21],据研究报道有15%~20%的骨肉瘤患者初次就诊时便发现存在有转移,40~60%的患者在治疗过程中发现有病灶的转移,而这其中近85%的转移即是肺转移,骨肉瘤发生转移,是导致骨肉瘤患者治疗失败和死亡的最主要原因[22]。本研究中单因素和Cox多因素分析均提示复发转移是影响儿童肢体骨肉瘤患者预后的影响因素,在147例儿童骨肉瘤患者中,按照Enneking外科分期,Ⅱ期139例,Ⅲ期8例,预示着8例(5%)患儿在初次就诊时即发现肺或其他部位的转移,随访期间共有34例患儿(23%)发生肺转移或其他组织的单纯转移,17例患儿(12%)既有复发又出现肺及其他组织远处转移,其中发生转移的部位中肺转移超过90%。其中无复发转移、单纯复发、单纯转移、多发转移(包括复发伴转移)的5年总生存率分别为:88%、51.3%、21.4%、0(多发转移中未统计到5年生存的患儿)。从本研究复发转移后的生存预后情况,便可发现儿童骨肉瘤患者一旦发生转移,其5年生存率不超过21.4%,其生存率要大大低于无复发及转移的患儿。因此,我们应当对儿童骨肉瘤患者规范的进行辅助化疗及适当的手术干预,以降低儿童肢体骨肉瘤患者的复发及转移。
本研究中性别、部位、手术方式对于预后的分析结果中均P>0.05,即不具有统计学意义。Bacci等[12]及Hsieh等[13]的研究中也分别指出性别、部位、手术方式等和儿童骨肉瘤患者的生存预后不具有相关性,和本研究相一致。另外本研究中还发现术前是否穿刺活检及手术前后DIA化疗方案中是否应用甲氨蝶呤(MTX)也不是影响儿童肢体骨肉瘤患者生存预后的相关因素。
综上所述,我国近些年来儿童骨肉瘤患者的生存预后有所改善但仍低于国外发达国家。在对我国儿童肢体骨肉瘤患者的生存预后分析中:性别、部位、术前是否穿刺活检、手术方式及手术前后DIA化疗方案中是否应用MTX均不是影响儿童肢体骨肉瘤患者生存预后的相关因素。规范化疗、Enneking外科分期、术后辅助化疗次数和复发转移是影响儿童肢体骨肉瘤患者生存预后的相关因素,其中规范化疗和复发转移是影响儿童骨肉瘤患者生存预后的独立影响因素。因此,规范的进行辅助化疗、有效的控制复发和转移可以提高儿童肢体骨肉瘤患者(≤14岁)的生存率,改善患儿的预后,化疗的不规范及复发转移严重影响患儿的预后。
本研究也存在一些不足:在10多年的多中心回顾性分析资料的整理中,有一些影响因素资料的统计不够全面,例如:化疗后肿瘤坏死率、术后并发症等。此外对于儿童年龄的划分,国内外也有所差异,本研究在查找多篇关于儿童骨肉瘤的国内文献中,大多以14岁为界限,而国外则有以10、12、14等的不同划分,故在结果比较时可能存在偏差。
所有作者均声明不存在利益冲突



























