
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
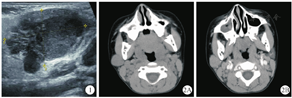
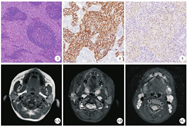
男,6岁,3个月前无意中发现右侧耳下区有一肿物,约大拇指大小,局部无肿胀疼痛、无皮肤瘙痒及破溃糜烂等不适,后肿块缓慢增大,约核桃样大小,于2019年2月来院就诊。体检:右侧耳下区可及肿块,大小约2 cm×2 cm,质中,界清,活动可,表面皮肤完整,口内腮腺导管口无红肿,分泌物清亮,无口角歪斜、鼓气漏气、鼻唇沟变浅等,右颈部未及异常肿大淋巴结。B型超声检查示右侧腮腺内见2.8 cm×1.9 cm×1.7 cm混合性回声肿块,边界尚清,形态不规则(图1)。CT检查示右侧腮腺内见一团块状软组织密度影,大小约2.0 cm×2.0 cm,形态欠规则,密度略欠均匀,增强后呈轻中度不均匀强化,颈部散在淋巴结显示(图2)。实验室检查未见明显异常。随后在超声引导下穿刺,穿刺病理示淋巴上皮癌。排除手术禁忌证后,患儿于2019年3月15日在全身麻醉下行"右侧腮腺恶性肿瘤局部扩大切除术"。手术可见肿瘤位于腮腺浅叶后份,约1.5 cm×1.5 cm大小,与面神经颊支及下颌缘支粘连明显,将肿瘤及邻近腺叶组织一并切除,并进一步扩大切除粘连部分咬肌,术后标本送检。病理检查肉眼观:灰白结节一枚,大小2.7 cm×2.0 cm×1.8 cm,切面呈实性,灰白质中,带包膜;镜检可见肿瘤细胞不规则岛状排列,细胞呈合体细胞样,胞质淡嗜酸性,胞界不清,卵圆形泡状核,核仁明显,间质见较多以小淋巴细胞为主的炎细胞,反应性淋巴滤泡形成(图3)。免疫组织化学检查示CK(+)(图4),P63(+),P40(+),P53(+),CD3(T细胞+),CD20(B细胞+),CD8(T细胞+);原位杂交检测可见EBER/对照(+)(图5)。病理诊断:(右侧腮腺)淋巴上皮癌。术后患儿恢复可,切口愈合佳,无耳垂周皮肤麻木不适等耳大神经损伤症状,无流涎流液、鼻唇沟变浅、鼓颊鼓气乏力等面神经受损症状,予出院,嘱休息2~3周后放疗科门诊复诊,行局部辅助放疗。患儿术后1个月至我院放疗科就诊,复查腮腺MR提示右侧腮腺下部斑片状异常信号(图6A、图6B),术后改变?两侧颈部及颌下多发淋巴结肿大(图6C)。临床考虑不能除外腮腺LEC局部淋巴结转移的可能。结合患儿年龄较小,颈部淋巴结清扫术难免造成相应功能障碍,影响生活质量,故欲行单纯性肿块及周边、腮腺淋巴结引流区照射放疗,患儿家属要求出院,至上级医院进一步诊治。本例随访15个月,术后赴上级医院行PF方案(顺铂+氟尿嘧啶)化疗一周期,右腮腺区放疗95%PTVtb 60Gy 30次,过程顺利,颈部肿大淋巴结消退,未见局部复发及远处转移。


淋巴上皮癌(lymphoepithelial carcinoma,LEC),定义为未分化或低分化鳞状细胞癌,伴有明显的非肿瘤性反应性淋巴浆细胞浸润[1]。虽然非鼻咽部未分化癌、淋巴间质未分化癌、淋巴上皮样癌、淋巴上皮瘤等多种命名法已被用于非鼻咽部LEC,但世界卫生组织(World Health Organization,WHO)已批准使用淋巴上皮癌一词[2]。
LEC最常发生在头颈部,包括鼻咽、鼻旁窦、口腔、喉和唾液腺,也可以发生在许多其他器官,如肺[3]、胃[4]、肠[5]、宫颈[6]、乳腺[7]、食管[1]等。唾液腺淋巴上皮癌最早在1962年由Hilderman等[8]提出,是一种罕见的恶性唾液腺肿瘤,占唾液腺肿瘤的0.4%,主要发生于大涎腺,以腮腺最为常见(约80%),其次是颌下腺,具有显著的地理和民族分布,包括因纽特人、中国南方人和日本人[9,10,11]。许多危险因素与LEC的发生相关,如紫外线辐射、木材和木屑、吸烟、酒精、染发剂和EB病毒(Epstein-Barr virus,EBV)[12]。其中EBV感染是目前认为关系最为密切的,在流行区几乎100%相关[13,14]。一般来说,男性比女性更易受到影响,平均诊断年龄为40~50岁,儿童LEC极为罕见。
腮腺LEC早期大多数表现为单侧生长缓慢的无痛性肿块,晚期可侵犯周边组织并固定,活动度差,侵犯面神经可伴随面神经麻痹症状的出现,如面部表情肌瘫痪、鼻唇沟变浅、口角下垂、鼓腮乏力等[9]。相关文献报道10%至50%的LEC患儿在发病时出现颈部淋巴结受累[14]。在本病的诊断中,超声检查最为简单易行,初诊时也常常采用,肿块常表现为形态不规则,边缘不清晰,内部回声以低回声为主,较为杂乱[15]。由于超声检查的局限性,临床工作中为了进一步鉴别诊断,多需完善增强CT或MR检查。在CT扫描中,大多数LEC呈单发、实性占位、界限不清、分叶状、均匀等密度或稍低密度,少见囊性变、钙化、中度或明显均匀强化[11]。在MR检查中,病灶T1WI呈等信号,T2WI呈稍高信号;增强后均匀或不均匀中度及以上强化。肿大淋巴结强化与腮腺病灶一致,较大者呈环形强化[16]。但该病的临床表现及影像学检查常常是非特异性的,难以明确诊断,故其确诊还需借助组织病理学检查。其病理形态学特征与鼻咽部非角化性癌没有明显区别[1]。即肿瘤细胞呈大的合体细胞样,胞质淡嗜酸性,胞界不清,核呈圆形或卵圆形泡状,核仁清晰,间质内有丰富的淋巴浆细胞浸润,常可见反应性淋巴滤泡。免疫组织化学检测显示肿瘤细胞的细胞角蛋白(cytokeratin,CK)阳性,间质包含CD20阳性的B淋巴细胞和CD3、CD8阳性的T淋巴细胞。尤其重要的是,LEC与EB病毒感染的关系,原位杂交中肿瘤细胞核对EBV编码RNA(EBV encoded RNA,EBER)呈阳性[1]。故腮腺LEC诊断前需排除鼻咽癌的转移。本例行鼻咽部检查及头颈部CT均未发现鼻咽部新生物,结合病理检查结果,考虑为原发性腮腺淋巴上皮癌。
在治疗方面,该肿瘤与原发性鼻咽癌一样具有放射敏感性。目前推荐的治疗方案包括完全手术切除和术后放化疗。对于广泛的软组织侵犯和手术切缘阳性的病人应接受放射治疗[17]。虽然10%至50%的LEC患儿在发病时会出现颈部淋巴结受累,但选择性的颈部淋巴结清扫术通常不是强制性的,但术后对主要病变周围和同侧颈部淋巴结区域进行放疗是推荐的。如果在初次诊断时发现临床和病理阳性的淋巴结,应进行同侧颈部淋巴结清扫[17]。本例术后1个月复查腮腺MR提示两侧颈部及颌下多发淋巴结肿大,临床考虑不能除外腮腺LEC局部淋巴结转移的可能。结合患儿年龄较小,颈部淋巴结清扫术难免造成相应功能障碍,影响生活质量,故欲行单纯性肿块及周边、腮腺淋巴结引流区照射放疗,患儿家属要求出院,至上级医院进一步诊治。
预后方面,由于该肿瘤对放疗或铂类药物具有良好的敏感性,虽然40%的患者出现颈部淋巴结转移,20%的患者有远处转移,但其预后还是优于其他未分化的唾液腺癌,其5年生存率在50%~90%[10,17,18]。但不适当的治疗方式仍可导致其治疗失败和复发[12]。本例随访15个月,在本院行"右侧腮腺恶性肿瘤局部扩大切除术"后赴上级医院行PF方案(顺铂+氟尿嘧啶)化疗一周期,右腮腺区放疗95%PTVtb 60 Gy 30次,过程顺利,颈部肿大淋巴结消退,未见局部复发及远处转移。
所有作者均声明不存在利益冲突


























