
探究原代胆管细胞培养胆道闭锁患儿胆囊来源的胆管类器官体进行实验研究的可行性。
选取2017年9月至2018年3月期间在复旦大学附属儿科医院4例Ⅲ型胆道闭锁患儿行Kasai手术及4例胆总管囊肿患儿行胆总管囊肿切除术获得的部分胆囊胆管细胞,采用三维原代胆管细胞培养方法培养胆道闭锁患儿胆囊来源的胆管细胞(实验组)和胆管扩张症(对照组)胆囊来源的胆管细胞类器官体;利用实时荧光定量PCR检测胆管相关的基因表达水平;利用HE染色、免疫荧光染色初步观察类器官体形态与基因表达特点;观察人工合成胆闭素对该胆管类器官体的影响。参数检验采用Student'st检验、方差分析,非参数检验采用Spearman检验、Kruskal-Wallis检验。
胆道闭锁患儿胆囊来源的胆管细胞和胆管扩张症胆囊来源的胆管细胞均可形成有结构的胆管类器官体,呈现空心球状或管状,均表达胆管标志基因,且两种来源的类器官体在形态和胆管标志基因表达水平上差异无统计学意义。P0、P1、P2代的胆道闭锁来源的胆管细胞的基因表达水平差异无统计学意义,表明胆管类器官体在体外培养时可以长期维持较稳定的基因表达水平。在培养基中加入人工合成的胆闭素后,与对照组相比,胆管类器官体细胞出现明显死亡现象。
利用胆道闭锁患儿来源的胆管细胞类器官体研究胆道闭锁的发病机制有一定的科学意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胆道闭锁(biliary atresia,BA)是一种新生儿时期发生的严重肝脏疾病[1,2],其发病机制至今尚不明确,存在很多假说与争论。目前研究胆道闭锁使用的动物模型为新生的感染轮状病毒BALB/c小鼠,但是感染小鼠寿命短暂,以及小鼠肝脏不易发生纤维化,对研究发病机制和药物筛选有很大的限制。所以建立人源的模型对于研究胆道闭锁的发病机制是很重要的。类器官体(Organoids)一词表示"微观的组织",就是由独特的三维培养系统培养的,由多个细胞聚集成的"微组织"。类器官体可以更稳定地保留供体组织的基因信息,比二维培养的细胞更好地体现生理和病理的状态,并且可以长期培养和传代。随着细胞培养技术的发展,类器官体技术已经广泛地应用在疾病研究中,如理解器官发育机制、正常生理功能,应用于再生医学以及药物安全性研究等。作为疾病模型,可以辅助研究疾病的发生、发展机制,高通量药物筛选等。虽然近年来原代胆管细胞类器官体培养技术有了较大的进展,但目前还没有利用原代胆管细胞类器官体研究胆道闭锁的相关报道,故本研究对胆道闭锁患儿胆囊来源的胆管上皮细胞进行原代培养,初步探索其作为研究胆道闭锁体外模型的可能性。
胆管细胞来自2017年9月至2018年3月期间在复旦大学附属儿科医院4例Ⅲ型胆道闭锁患儿行Kasai手术及4例胆总管囊肿患儿(choledochal cyst,CC)行胆总管囊肿切除术获得的部分胆囊。本研究通过医院伦理委员会批准[复儿伦审(2019)320]。样品浸入William's E培养基中防止干燥,切开暴露内壁,刮下胆管上皮细胞,收集、离心后加入适量用冰预冷的原代胆管细胞培养基(primary cholangiocyte medium,PCM)[3],加入Matrigel(BD),使PCM/Matrigel混合物最终体积比例为2∶1。用预冷的枪头将混合液转移至24孔板,每孔50 μl,使每个孔中混合液形成一个水滴状,37°C培养箱中凝固后,每孔加入1 ml 37°C的PCM培养基。每3~4 d换液,第10天传代。
加入预冷的PBS,经含有胎牛血清的培养基润洗过的枪头反复吹打,将孔中的胶样物质完全溶解。转移、离心、去上清,加入少量的含有胎牛血清的培养基,反复吹打至细胞球明显变小。转移细胞至PCM/Matrigel混合物(方法同前)。
吸弃培养板中的液体培养基,用预冷的4%多聚甲醛固定24 h,倒入Tris-acetate-EDTA(TAE)缓冲液配制的琼脂糖凝胶,凝固后将含有类器官体的Matrigel和琼脂糖凝胶整体取出,适当修剪,石蜡包埋、切片。之后进行常规的H&E染色及免疫荧光染色。
细胞和Matrigel整体在4%多聚甲醛中固定后,使用蔡司体视显微镜SteREO Discovery.V12观察拍照。
来自胆总管囊肿患儿的胆管类器官体在传代后第4天加入2 μg/ml合成胆闭素(溶于DMSO),对照组为来源相同、代数相同的胆管类器官体,加入等体积DMSO,每3 d换液,第10天观察。
抽提RNA使用TRIzol(Thermo Fisher),取1 μg RNA用M-MLV反转录酶(Promega)试剂盒获得cDNA。采取SYBR Premix Ex Taq(TaKaRa)试剂盒进行实时定量PCR,利用StepOne plus real-time PCR system(Applied Biosystems)检测基因表达。检测基因表达水平时选择胆管细胞特征基因EPCAM、CK7、CK19、NOTCH2、HNF1B、HES1、SOX9、CFTR、AQP1;肝细胞特征基因ALB;内参基因GAPDH。
参数检验采用Student'st检验、方差分析,非参数检验采用Spearman检验、Kruskal-Wallis检验,使用GraphPad Prism 8软件。数据表示为Mean±SD,P<0.05时认为差异有统计学意义。
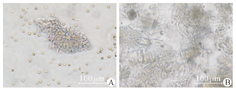
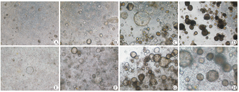
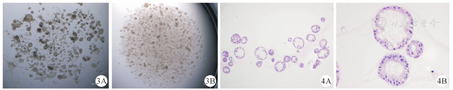
胆道闭锁和胆总管囊肿患儿来源的胆囊各收集4例,平均手术年龄分别为54.75 d和54.3个月。用手术刀片刮下胆囊内壁细胞后,将组织置于少量磷酸缓冲盐(PBS)缓冲液中,在显微镜下观察,胆管细胞仍然以体内的方式聚集,刚分离的胆管细胞呈柱状,胆道闭锁和胆总管囊肿没有明显的区别(图1)。两种来源的胆管类器官体在形态上大体均为球形,有少量管状结构,没有明显的区别(图2、图3)。胆管类器官体囊状结构会随着培养时间而增多、体积变大。H&E染色呈现出与体内肝外胆管黏膜上皮相似的形态,类器官体由单层柱状细胞构成,细胞核偏向基底侧(外侧),核上区有黏液泡(图4)。



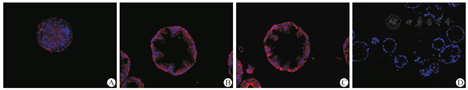
免疫荧光染色表明类器官体表达CK7、CK19、CFTR;少量表达ZO-1,但ZO-1并没有如体内胆管一样呈极性分布(图5)。

实时荧光定量PCR分别检测两种来源(BA,CC)的第一代类器官体胆管标志基因的表达水平(图6)。以正常成人肝组织为对照组,BA和CC来源第一代类器官体标志基因相对表达量分别为EPCAM(16.03±2.075)和(16.3±1.306),P=0.91;CK7(6.225 ± 0.885 3)和(6.036±0.5821),P=0.868 1;CK19(54.97 ± 13.85)和(52.78±9.74),P=0.907 1;HNF1B(0.447 8±0.033 23)和(0.490 7±0.059 5),P=0.688 7;HES1(0.075 31±0.000 901 9)和(0.098 86±0.011 66),P=0.281 5;SOX9(3.514±0.126)和(2.906±0.427 3),P=0.436 5;CFTR(0.582 2±0.057 81)和(0.297 6±0.051 94),P=0.027 2。BA和CC胆管细胞在基因表达上差异不明显,二者均不表达肝细胞标志ALB,BA中CFTR表达相对较高。
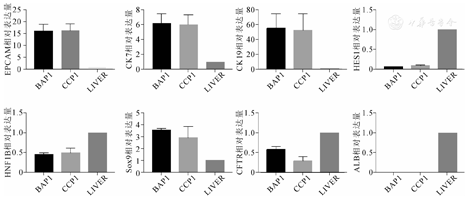

注:BAP1,胆道闭锁来源第一代类器官体;CCP1,胆总管囊肿来源第一代类器官体;LIVER,正常肝组织;CFTR,P=0.027 2
检测P0(培养前)、P1、P2代的胆道闭锁来源的胆管细胞的基因表达,P0为刚分离未进行培养的胆管细胞,以正常成人肝组织为对照组,P0P1P2代胆道闭锁来源的胆管细胞基因表达相对量分别为CK7(7.367±5.539)、(4.793±2.242)和(6.06±1.697),P=0.596;CK19(45.6±32.73)、(38.12±7.573)和(69.54±21.59),P=0.250;NOTCH2(0.093±0.006)、(0.102±0.037)和(0.141 2±0.030),P=0.153;HNF1B(0.392±0.217)、(0.327±0.183)和(0.482 5±0.074),P=0.390;SOX9(1.976±0.185 3)、(2.595±1.112)和(5.095±1.507),P=0.049;CFTR(0.082±0.046)、(0.055±0.004)和(0.120±0.105),P=0.146;AQP1(0.158±0.178),(0.038±0.033)和(0.047±0.038),P=0.284。除了SOX9每代表达增长差异有统计学意义,不同代数细胞在其他基因表达上差异无统计学意义,表明胆管类器官体在体外培养可以维持较稳定的基因表达(图7)。
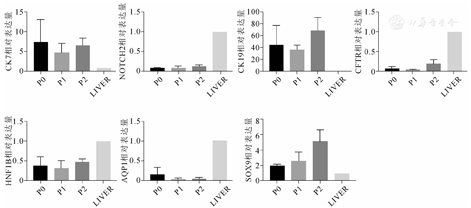

注:P0,刚分离未进行培养的胆管细胞;P1,第一代,胆道闭锁来源的胆管细胞;P2,第二代,胆道闭锁来源的胆管细胞;LIVER,正常肝组织
培养基中加入胆闭素6 d后,实验组与对照组(加入等体积DMSO)相比,细胞数量明显减少,类器官体球状结构体积较小,细胞出现明显的死亡现象(图8)。
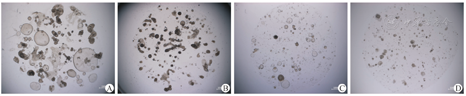

目前常用的胆道闭锁动物模型为新生的感染轮状病毒的BALB/c小鼠,由于感染小鼠寿命短,肝脏不易产生纤维化,对研究机制和相应治疗药物有局限性[4],由此,建立人源的模型对于研究胆道闭锁很重要。人诱导多能干细胞(induced pluripotent stem cells, iPSC)技术提供了用于模拟疾病和寻找药物的细胞来源,理论上所有细胞都可以从iPSCs经过体外分化而得到,而iPSCs的起始细胞较易获取,同时iPSCs较容易被基因编辑,使得体外验证发育疾病相关候选基因成为可能。近年来高通量测序技术的发展,使胆道闭锁的相关基因研究取得一定突破,通过GWAS研究发现glypican 1(GPC1)、adducin 3(ADD3)、ADP-ribosylation factor 6(ARF6)等基因可能于胆道闭锁相关研究[5,6,7,8,9,10,11],而这些基因敲除的斑马鱼中也出现了胆管发育的异常[7,11]。Tian等[12]利用CRISPR/Cas9技术将iPSCs中ADD3和GPC1敲除,细胞在体外分化胆管细胞时出现障碍,认为iPSCs分化的胆管类器官体可以作为新的研究胆道闭锁的体外模型。
虽然iPSCs体外胆管类器官体分化模型可以帮助验证一些基因是否对胆管细胞的发育产生影响,以及筛选患儿基因测序中发现的候选基因变异是否为胆道闭锁的致病基因,但仍然没有解决一个关键问题:患儿病变部位的胆管细胞本身是否有缺陷。我们认为研究体外培养的原代的胆管细胞也许可以回答这个问题。原代细胞的培养和维持一直存在技术难题,2017年Sampaziotis等[3]发表原代胆管细胞类器官体培养方法,用手术刀片或ERCP刷将肝移植手术修剪下来的胆管、胆囊的内衬组织刮/刷下来并培养成胆管类器官体。Soroka等[13]利用ERCP术中取得的2~5 ml胆汁也成功培养出胆管类器官体,可以长期培养、增殖、冻存。Tysoe等[14]利用聚已酸酯和浓缩的胶原作为支撑构建了胆管细胞生物工程组织,以研究组织移植治疗。原代胆管细胞与此前iPSCs分化、Lgr5+"双潜能"细胞分化形成的胆管细胞相比,更加成熟,没有分化趋势,没有混杂的干细胞、肝细胞,并且可以长期传代,更适合用于研究胆管疾病和细胞移植治疗。本组首次利用已发表的原代胆管细胞类器官体培养方法[3],培养了来源于胆道闭锁和胆总管囊肿两种疾病患儿肝外胆管(胆囊)细胞原代类器官体。选择胆囊来源的原因是胆道闭锁患儿的肝总管和胆总管位置严重纤维化,管腔仅在显微镜下可观察到,难以取得胆管细胞。实验结果证明,BA和CC胆囊来源的胆管上皮细胞均可形成同样的三维结构,表达胆管标志基因。
虽然在本组的实验中两种来源细胞在形态和标志基因表达水平上没有明显的差异,表明胆道闭锁患儿体内存在与胆总管囊肿患儿相似的肝外胆管细胞,不能证明胆道闭锁患儿的肝外胆管细胞是完全正常的,原因有如下三点。首先,作为"正常"对照的胆总管囊肿来源细胞在分离之前处于长期炎症的状况,并不是完全正常的胆管细胞。其次,胆管标志基因表达水平的检测仅起到鉴定胆管细胞身份的作用,不能反映胆管细胞是否遭受免疫攻击,胆道闭锁是至今没有发现病因的疾病,几乎不可能是由这些熟知的胆管标志基因缺陷造成。第三,我们检测的是培养10 d之后的P1代细胞,不能完全排除培养系统对细胞造成的影响。从患儿对照体内新鲜分离的、未经过培养的、尽量单纯的胆管细胞的RNA测序对比研究,以去除培养条件对于细胞的影响,无疑是回答这个问题更加直接、简单的方法。
此外,在本实验中检测到的两种来源细胞的HES1和CFTR表达的差异,以及不同代次存在SOX9表达水平的变化,仍然很难解释,可能是由于样本量较少,也可能为培养系统对于细胞的影响。
已经有研究证明天然胆闭素在体内和体外均可以损伤胆管细胞[15,16,17],但由于其目前并未与人类胆道闭锁疾病产生明确联系,所以目前为止,与胆闭素相关的斑马鱼、胆管类器官体模型,只能作为毒素损伤胆管的模型。本研究通过胆总管囊肿患儿来源的胆管类器官体验证人工合成的胆闭素对胆管上皮损伤的作用,经胆闭素处理体内外胆管发生的胆管细胞异常表达特征与人类胆道闭锁胆管表达谱特征相似,但尚不能构成"胆闭素是胆道闭锁病因"的直接证据。
肝脏类器官体研究近年来非常火热,作为已知致病基因的疾病模型,如Alagille综合征、ɑ-1抗胰蛋白酶缺乏症等,已有较明确的研究思路:机制研究、药物筛选、基因治疗。而类器官体作为未知病因的、且体外培养表现无明显异常的疾病模型,如胆道闭锁,目前还缺乏研究思路。本研究表明来源于胆道闭锁患儿病变部位(胆囊)的原代胆管细胞类器官体培养是可行的,原代胆管类器官体培养技术未来会回答与胆道闭锁相关的何种问题,尚待全新的研究思路的出现。
所有作者均声明不存在利益冲突



























