
探讨血小板活化因子(platelet activating factor,PAF)对小儿急性肠套叠的诊断意义。
收集2018年8月至2020年8月于山西省儿童医院普外科就诊的69例急性肠套叠患儿的临床资料及实验室指标。根据患儿有无肠坏死分为肠坏死组(36例)和无坏死组(33例);根据患儿在术后3~4 d进食后是否口服双歧杆菌分成服药组(39例)和非服药组(30例)。另取同期体格检查的30例健康婴幼儿作为对照组。69例急性肠套叠患儿中,男47例,女22例,年龄为(8.70±4.81)个月,体重为(10.17±4.11)kg;30例健康婴幼儿中,男20例,女10例,年龄为(8.31±2.12)个月,体重为(9.54±3.51)kg。分别检测对照组、急性肠套叠患儿术前及术后7 d的外周血中PAF、C反应蛋白(C-reactive protein,CRP)、T淋巴细胞亚群CD3+、CD3+CD4+、CD3+CD8+、CD4+/CD8+并进行统计学分析。
①术前,与对照组相比,肠坏死组和无坏死组各项指标均发生改变,差异具有统计学意义(P<0.05);肠坏死组与无坏死组相比,肠坏死组中只有PAF的含量明显升高,差异具有统计学意义(P<0.05);②术后7 d,对照组、服药组及非服药组3组间的CRP的含量、CD3+、CD3+CD4+、CD4+/CD8+的水平差异均无统计学意义(P>0.05),服药组及非服药组的CD3+CD8+仍高于对照组,差异具有统计学意义(P<0.05),但较术前的服药组及非服药组患儿的CD3+CD8+均降低,差异具有统计学意义(P<0.05);③术后7 d,非服药组及服药组中肠坏死患儿的PAF的含量仍高于对照组,但较术前显著降低,差异具有统计学意义(P<0.01)。服药组中无肠坏死的患儿PAF的含量与对照组相比差异无统计学意义(P>0.05)。
PAF对诊断小儿急性肠套叠的肠坏死有重要意义,有利于监测术后使用双歧杆菌对患儿的预后作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
小儿急性肠套叠是小儿外科常见的急腹症之一,因该病多发于4~10个月的儿童、病程发展快,局部缺血缺氧等特点,如果治疗不及时会导致肠坏死,引发代谢性内毒素血症[1,2,3]。因为受小儿生理机能和疾病特点等影响,术后仍可能出现迟发型肠坏死、肠漏等并发症,导致全身炎症反应综合征,所以术前诊断及术后对预后的有效判断显得至关重要。越来越多的研究表明双歧杆菌可调节机体能量代谢和免疫功能,减轻局部炎症反应,改善肠黏膜屏障功能[4]。目前认为血小板活化因子(platelet activating factor,PAF)可作为肠套叠术后的炎症级联反应中起关键作用的指标,但临床中仍未见这方面的报道[5]。
收集2018年8月至2020年8月于山西省儿童医院普外科就诊的69例急性肠套叠患儿和同期体格检查的30例健康婴幼儿的临床资料及实验室指标。急性肠套叠患儿中,男47例,女22例,年龄为(8.70±4.81)个月,体重为(10.17±4.11)kg;健康儿童中,男20例,女10例,年龄为(8.31±2.12)个月,体重为(9.54±3.51)kg。根据患儿有无肠坏死分为肠坏死组(36例)和无坏死组(33例);根据患儿在术后3~4 d可进食后是否口服双歧杆菌,分为服药组(39例)和非服药组(30例),其中双歧杆菌的服用剂量为500 mg/次,2次/d,早晚各服用1次。将30例健康婴幼儿作为对照组。两组患儿在性别、年龄和体重上的差异均无统计学意义(P>0.05)。
本研究患儿的纳入标准:经腹部彩色多普勒超声检查及诊断性空气灌肠证实为急性肠套叠且空气灌肠复位不成功,需行手术治疗的患儿。排除标准:先天性及后天免疫缺陷,有结核接触史且肝肾功能严重不全的患儿。
本研究已通过山西省儿童医院伦理委员会审查并批准,伦理批号:IRB-KY-2015。所有患儿的监护人均了解本研究内容并签署知情同意。
分别抽取对照组、急性肠套叠患儿术前和术后7 d的外周血标本1 ml,在4 000 r/min的离心机下高速离心8 min,汲取上清液。采用PAF的ELISA检测试剂盒(武汉博士德生物工程有限公司),按照说明书操作。在450 nm处读取光密度(optical density,OD)值,根据所测标准品的OD值绘制标准曲线,计算被检血清中PAF的浓度。
采用全自动特定蛋白分析仪PA120分别检测对照组、急性肠套叠患儿术前和术后7 d的外周血标本中的CRP水平。
分别抽取对照组、急性肠套叠患儿术前和术后7 d的外周血标本1 ml,加入抗凝剂,在2 500 r/min的离心机下,采用密度梯度离心20 min,分离出单个核细胞(mononuclear cell,MNC),将抗CD3、CD4、CD8单抗分别加入抗凝血中,避光室温培养30 min,固定后避光静置30 min,最后用流式细胞仪(BD公司,美国)检测CD3+、CD3+CD4+、CD3+CD8+和CD4+/CD8+的表达水平。
采用SPSS 22.0软件进行数据分析,计量资料两两比较采用t检验分析、3组以上的比较采用单因素方差分析,计数资料使用χ2检验进行分析,相关性分析采用Pearson或Spearman相关分析,P<0.05为差异具有统计学意义。
与对照组相比,可见肠坏死组和无坏死组中CD3+CD8+均升高,差异具有统计学意义(P<0.05),PAF与CRP的含量显著升高,差异具有统计学意义(P<0.01),CD3+CD8+、CD3+CD4+和CD3+/CD4+均降低,差异具有统计学意义(P<0.05);但肠坏死组与无坏死组相比,肠坏死组中只有PAF的含量升高,差异具有统计学意义(P<0.05)。说明PAF的含量升高可作为急性肠套叠患儿肠道有无坏死的诊断指标之一(表1)。
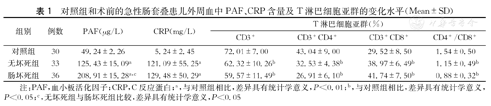
对照组和术前的急性肠套叠患儿外周血中PAF、CRP含量及T淋巴细胞亚群的变化水平(Mean±SD)
对照组和术前的急性肠套叠患儿外周血中PAF、CRP含量及T淋巴细胞亚群的变化水平(Mean±SD)
| 组别 | 例数 | PAF(μg/L) | CRP(mg/L) | T淋巴细胞亚群(%) | |||
|---|---|---|---|---|---|---|---|
| CD3+ | CD3+CD4+ | CD3+CD8+ | CD4+/CD8+ | ||||
| 对照组 | 30 | 49.24±2.26 | 5.24±2.45 | 72.01±7.00 | 43.04±9.00 | 29.52±8.50 | 1.54±0.50 |
| 无坏死组 | 33 | 125.43±15.09a | 121.09±55.25a | 62.32±10.26b | 32.53±4.38b | 38.97±6.49b | 1.15±0.49b |
| 肠坏死组 | 36 | 208.91±15.28a,c | 129.48±50.29a | 59.57±11.49b | 26.91±6.10b | 41.74±7.50b | 0.88±0.32b |
注:PAF,血小板活化因子;CRP,C反应蛋白;a,与对照组相比,差异具有统计学意义,P<0.01;b,与对照组相比,差异具有统计学意义,P<0.05;c,无坏死组与肠坏死组比较,差异具有统计学意义,P<0.05
术前,服药组与非服药组的CRP的含量及T淋巴细胞亚群的表达水平的差异无统计学意义(P>0.05);但是,与对照组相比,服药组及非服药组的CRP的含量、CD3+CD8+水平升高,差异具有统计学意义(P<0.05),CD3+、CD3+CD4+和CD4+/CD8+水平降低,差异具有统计学意义(P<0.05)。术后7 d,服药组、非服药组及对照组3组间的CRP的含量、CD3+、CD3+CD4+和CD4+/CD8+水平差异无统计学意义(P>0.05),服药组及非服药组的CD3+CD8+水平仍高于对照组,差异具有统计学意义(P<0.05),但较术前服药组及非服药组的CD3+CD8+水平均降低,差异具有统计学意义(P<0.05)(表2)。
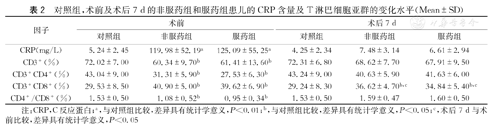
对照组,术前及术后7 d的非服药组和服药组患儿的CRP含量及T淋巴细胞亚群的变化水平(Mean±SD)
对照组,术前及术后7 d的非服药组和服药组患儿的CRP含量及T淋巴细胞亚群的变化水平(Mean±SD)
| 因子 | 术前 | 术后7 d | ||||
|---|---|---|---|---|---|---|
| 对照组 | 非服药组 | 服药组 | 对照组 | 非服药组 | 服药组 | |
| CRP(mg/L) | 5.24±2.45 | 119.98±52.19a | 125.09±55.25a | 4.25±2.34 | 7.48±3.14 | 6.61±2.94 |
| CD3+(%) | 72.02±7.00 | 60.34±9.70b | 61.41±13.60b | 72.31±6.80 | 68.62±7.70 | 67.91±9.50 |
| CD3+CD4+(%) | 43.04±9.00 | 31.31±5.90b | 27.53±6.30b | 43.24±9.00 | 40.63±5.90 | 41.63±6.00 |
| CD3+CD8+(%) | 29.53±8.50 | 40.90±5.00b | 39.62±6.90b | 29.24±8.30 | 36.62±4.70b,c | 34.84±5.40b,c |
| CD4+/CD8+(%) | 1.53±0.50 | 1.08±0.52b | 0.95±0.34b | 1.53±0.50 | 1.59±0.47 | 1.60±0.50 |
注:CRP,C反应蛋白;a,与对照组比较,差异具有统计学意义,P<0.01;b,与对照组比较,差异具有统计学意义,P<0.05;c,术后7 d与术前比较,差异具有统计学意义,P<0.05
术后7 d,服药组及非服药组中肠坏死患儿的PAF的含量仍高于对照组,但较术前显著降低,差异具有统计学意义(P<0.01)。服药组中无肠坏死的患儿PAF的含量与对照组相比差异无统计学意义(P>0.05)(表3)。
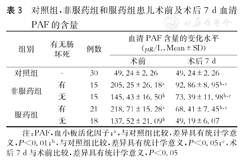
对照组,非服药组和服药组患儿术前及术后7 d血清PAF的含量
对照组,非服药组和服药组患儿术前及术后7 d血清PAF的含量
| 组别 | 有无肠坏死 | 例数 | 血清PAF含量的变化水平(μg/L,Mean±SD) | |
|---|---|---|---|---|
| 术前 | 术后7 d | |||
| 对照组 | - | 30 | 49.24±2.26 | 49.24±2.26 |
| 非服药组 | 有 | 15 | 205.25±26.18a | 92.86±8.95b,c |
| 无 | 15 | 145.43±16.50b | 73.39±11.98b,c | |
| 服药组 | 有 | 21 | 218.71±15.28a | 68.41±7.45b,c |
| 无 | 18 | 137.52±21.09b | 49.19±6.07 | |
注:PAF,血小板活化因子;a,与对照组比较,差异具有统计学意义,P<0.01;b,与对照组比较,差异具有统计学意义,P<0.05;c,术后7 d与术前比较,差异具有统计学意义,P<0.05
小儿急性肠套叠是肠缺血与再灌注的损伤过程,由此会导致肠黏膜屏障损伤和通透性增高,就诊不及时可因肠坏死、腹膜炎而引发全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)[1,2]。又有研究表明淋巴增殖实验成功建立了肠套叠模型,证实肠套叠与肠道免疫相关,所以术前监测炎症和免疫指标是非常必要的[6]。
CRP是典型的急性时相蛋白,在临床上可灵敏地反映出炎症的变化程度,并可作为监测预后情况的指标。T淋巴细胞亚群CD3+、CD3+CD4+、CD3+CD8+和CD4+/CD8+分析则是检验免疫功能的重要指标。PAF是体内活性最强的脂质炎症介质之一,它不仅诱导急性炎症反应,还通过调节宿主免疫系统功能诱导迟发性全身免疫抑制[7]。本研究结果表明肠套叠会引发一系列的炎症反应,诱发全身免疫抑制。肠坏死是肠套叠最严重的并发症之一,需尽早行肠切除手术治疗。临床上不仅需要诊断肠套叠,更要正确判断是否有肠坏死的存在。延误判断可能会导致肠穿孔、感染性休克甚至多器官功能衰竭。据文献报道,PAF可通过激活肠上皮细胞的信号传导及转录激活因子(signal transduction and activator of transcription,STAT),诱导上皮细胞凋亡,改变肠黏膜的通透性,破坏肠黏膜,造成肠黏膜的损伤[8,9,10,11,12]。说明PAF高表达可能致肠坏死,PAF可作为肠坏死的指标。这与我们的研究结果相一致,肠坏死组与无坏死组相比,肠坏死组中只有PAF的含量升高,差异具有统计学意义(P<0.05)。说明PAF可作为急性肠套叠患儿肠管有无坏死的诊断指标之一。
因肠套叠手术创伤较大,且受小儿生理机能和疾病特点等影响,术后会发生炎症反应,肠道菌群破坏,肠黏膜屏障破坏,机体免疫功能低下。为了改善患儿术后炎性反应的情况,促进免疫平衡,减轻肠黏膜的破坏,我们在术后患儿恢复进食后予服用双歧杆菌。双歧杆菌是肠黏膜屏障中生物屏障的主要成分,是人体主要的益生菌之一,能够通过免疫调节加强胃肠防御的各个防线,发挥抗感染的作用[13,14,15,16]。本研究中,非服药组与服药组相关情况之间的差异并无统计学意义,还不足以说明双歧杆菌可有效抗感染及改善免疫平衡。另据文献报道PAF介导了炎症级联反应并在胃肠道系统中起着重要的作用,其中PAF表达增高参与了炎症反应及诱导了免疫反应[17]。那么双歧杆菌是否可以有效抑制PAF的水平呢?急性肠套叠患儿术前,服药组与非服药组中的肠坏死患儿及无肠坏死患儿之间的PAF的含量差异均无统计学意义(P>0.05)。术后7 d,非服药组及服药组中肠坏死患儿的PAF的含量仍高于对照组,但较术前显著降低,差异具有统计学意义(P<0.01)。服药组中无肠坏死患儿PAF的含量与对照组相比差异无统计学意义(P>0.05)。说明服用双歧杆菌在肠道无坏死的情况下可有效抑制PAF的水平,而且术后PAF含量的变化水平,对于急性肠套叠判断预后有着重要的意义。
本研究通过比较急性肠套叠患儿与对照组血清中PAF、CRP的含量及T淋巴细胞亚群CD3+、CD3+CD4+、CD3+CD8+、CD4+/CD8+的表达水平,并结合服用双歧杆菌对这些指标的影响。说明血清中的PAF较CRP与T淋巴细胞亚群在判断小儿急性肠套叠患儿肠管有无坏死及判断预后的恢复水平上更具有临床指导意义。本研究为小儿急性肠套叠诊断及预后提供了方向,为术后的防治提供了依据,方法简单、实用,值得推广。但该研究仅从指标上进行分析研究,而且研究双歧杆菌的服用时效较短,还需进一步跟踪患儿长时间服用的效果以及研究肠道双歧杆菌对免疫系统、细胞激活机制的作用。
所有作者均声明不存在利益冲突



























