
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
先天性肺气道畸形(congenital pulmonary airway malformation,CPAM)是先天性肺发育畸形(congenital lung malformation,CLM)中最常见的一种,是以终末细支气管过度增生与扩张为特征的先天性肺部错构瘤样病变[1,2]。常表现为肺实质内单房或多房囊肿或蜂窝状结构[1]。其发病机制可能是肺胚胎发育过程中上皮细胞与下层间充质细胞之间的信号传导障碍,导致肺部缺乏正常肺泡和形成多囊性肺肿块[3]。CPAM患病率约占出生活胎的1/35 000~1/7 200,且呈逐渐上升趋势[4,5]。
1949年Ch'in和Tang[6]首次将CPAM作为一种罕见的、发生在未成熟胎儿或死产婴儿、且伴有全身水肿的病变提出,命名为先天性囊性腺瘤样畸形(congenital cystic adenomatoid malformation,CCAM)。1977年病理科医生Stocker等[7]根据囊肿大小、病理特征将CCAM分为Ⅰ、Ⅱ、Ⅲ型[7]。其中Ⅰ型占65%,为单个或数个厚壁的较大囊肿(囊径为3~10 cm);Ⅱ型占20%~25%,表现为众多均匀分布的小囊(囊径为0.5~3.0 cm);Ⅲ型占8%,由大面积实性成分组成。但在临床应用过程中,人们逐渐发现有些类型的CCAM无法被准确归为任何一种类型。2002年Stocker[1]根据病变起源部位、病理特征并结合其临床特点将其重新命名为CPAM,根据大体及组织学表现将其分为5型:0、1、2、3、4型(表1)。同时基于CPAM产前超声检查中囊腔的形态学表现,可分为大囊型(囊腔直径>5 mm,病灶内存在一个或多个囊肿)与微囊型(病灶呈实性固体回声团块)。

先天性肺气道畸形分型及特点
先天性肺气道畸形分型及特点
| 类型 | 病变定位 | 发生率(%) | 大体病理 | 镜下病理 | 预后 |
|---|---|---|---|---|---|
| 0型 | 先天性肺泡发育不良 | 1~3 | 实性外观,肺缩小变硬 | 气道壁软骨、平滑肌及腺体被大量间质组织分隔 | 预后差 |
| 1型 | 支气管,常单叶受累(95%) | 60~70 | 由1个以上囊肿组成,壁厚,囊肿直径在2~10cm | 囊壁主要由假复层纤毛柱状上皮构成 | 易发生病灶感染,10岁后有可能恶变成支气管肺泡癌,预后良好 |
| 2型 | 支气管/细支气管 | 10~15 | 多个小囊组成,囊肿直径在0.5~2.0 cm | 囊壁由柱状或立方状上皮构成 | 新生儿期即可出现症状,易合并其他系统畸形,预后良好 |
| 3型 | 细支气管 | 5 | 蜂窝状微囊组成,囊肿直径<0.5 cm | 囊壁由立方上皮构成 | 预后良好,需与叶型肺气肿进行鉴别 |
| 4型 | 肺周边远侧肺泡 | 28 | 单个或分隔大囊,囊肿直径>10 cm | 囊壁由扁平上皮构成 | 预后良好,影像学表现与胸膜肺母细胞瘤不易鉴别 |
目前,关于CPAM患儿的产前、产后干预及处理策略国内尚无指南和专家共识发表,亟须相关专家规范共识以指导临床诊疗过程[8,9,10,11]。本共识采用国际通用的Delphi程序,利用CNKI、万方、维普、中国生物医学全文数据库、Pubmed、Embase及循证医学Cochrane中心数据库中对国内外1949~2021年关于CPAM的文献进行系统检索,纳入较高级别证据。检索中文主题词为"先天性肺气道畸形""先天性囊性腺瘤样畸形""先天性肺囊性病""先天性肺畸形""肺囊肿""产前诊断""治疗";英文主题词为"congenital pulmonary airway malformation""congenital cystic adenomatoid malformation""congenital cystic disease""congenital lung malformation""pulmonary cyst""prenatal diagnosis""treatment"。总结并结合最新文献结论,重点关注CPAM诊疗进展方面报道,中华医学会小儿外科学分会普胸外科学组、中国医疗保健国际交流促进会妇儿医疗保健分会召集全国小儿胸外科相关专家多次讨论,并结合中国多中心小儿胸外科临床经验,最终形成以下共识。
本共识基于推荐分级的评估、制定与评价(Grade of Recommendations Assessment, Developmentand Evaluation, GRADE)系统(表2)对支持各诊疗方法的循证医学证据进行分级,包括证据推荐程度及质量分级。
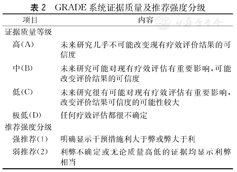
GRADE系统证据质量及推荐强度分级
GRADE系统证据质量及推荐强度分级
| 项目 | 内容 | |
|---|---|---|
| 证据质量等级 | ||
| 高(A) | 未来研究几乎不可能改变现有疗效评价结果的可信度 | |
| 中(B) | 未来研究可能对现有疗效评估有重要影响,可能改变评价结果的可信度 | |
| 低(C) | 未来研究很有可能对现有疗效评估有重要影响,改变评价结果可信度的可能性较大 | |
| 极低(D) | 任何疗效评估都很不确定 | |
| 推荐强度分级 | ||
| 强推荐(1) | 明确显示干预措施利大于弊或弊大于利 | |
| 弱推荐(2) | 利弊不确定或无论质量高低的证据均显示利弊相当 | |
大多数CPAM患儿可在孕18~22周时通过产前超声筛查被发现,敏感度达94%,特异度达95.3%[8,12]。其在超声影像上表现为肺部高回声、低(无)回声或混合回声团块。由于超声检查方便、可重复性高及可观察血供来源等优点,已成为产前CPAM诊断与随访的首选[8]。但由于受胎儿胎位、肋骨和操作者主观影响较大,超声在诊断微囊型病变时可能会发生误诊与漏诊[8]。
胎儿磁共振成像检查(fetal magnetic resonance imaging,fMRI)能更好地发现伴发畸形情况及观察胸部结构及病变形态,可用于评估胎儿肺容量、明确病灶边界及毗邻关系,从而帮助在产前对胎儿行全面评估;对于病变较大者,fMRI在显示肺分叶时较超声更为清晰。因此fMRI可用于超声诊断不明确、需进一步明确分型或分叶、需产前治疗或明确是否伴发其他系统畸形的高风险患儿,尤其在鉴别CPAM与肺隔离症和大叶性肺气肿时,fMRI优势明显[13,14,15,16]。
推荐意见1:超声为CPAM产前诊断的首选方法,且为产前患儿定期随访的主要方式(1A);CPAM的产前fMRI检查一般用于超声诊断不明确、需进一步明确分型或分叶、需产前治疗干预或不确定是否伴发其他系统畸形的高风险患儿,不推荐作为常规检查(1B)。
绝大多数产前诊断的CPAM不影响正常妊娠,预后良好,仅少数因出现胎儿水肿导致预后不良。胎儿水肿是由于患儿肺部病灶体积过大压迫腔静脉,导致静脉回流不畅继而出现胎儿细胞外液过量积聚的表现。胎儿水肿在超声检查中表现为胎儿头皮下组织水肿,颅骨光环呈"双环征";胸腔、腹腔等可见液性暗区;肺被压缩;肠管在胸腔内漂浮,胸、腹壁增厚;胎盘增大增厚;或伴有羊水增多。胎儿水肿的诊断标准为至少存在下列2项:①皮肤水肿(≥5 mm);②胎盘增厚(>6 cm);③腹腔积液;④胸腔积液;⑤心包积液和(或)羊水过多[17]。虽然胎儿水肿发生率极低,但一旦发生,病死率高达82%~93%,是目前导致CPAM胎儿引产、宫内死亡的最主要原因[4,8,18,19]。我国胎儿水肿发生率统计学研究较少,亟待大样本多中心研究。
由于胎儿水肿是导致CPAM患儿预后不良的主要危险因素,而胎儿水肿的发生与病灶体积大小直接相关,因此临床上常通过评估病灶体积大小来预测胎儿水肿出现的风险。具体衡量指标为CPAM容积比(CPAM volume-ratio,CVR),计算公式为:(病灶的长×高×宽×0.523)/头围。CVR值越大提示病灶相对体积越大,胸腔占位效应就越明显[20]。有研究对CVR值与预后情况进行分析后认为,CVR>1.6时CPAM患儿在胎儿期有出现水肿的风险;CVR<0.91时出现胎儿水肿风险较低;CVR<0.56时对胎儿水肿发生的阴性预测值为100%,该类患儿预后良好[8,19,20]。文献报道胎儿CVR峰值多出现在孕中期,此后85%的胎儿CVR值会随孕周增加呈下降趋势,且在妊娠30周后下降更为显著;孕中期CVR值越高,孕后期CVR下降趋势越明显[21]。研究发现,CPAM胎儿CVR增长最快的时期通常为孕20~25周,平均CVR峰值出现在孕25周,且大部分在妊娠25周后开始下降,故大部分低危CPAM胎儿在孕晚期可考虑将超声随访间隔延长[20]。
研究发现,母体肌注类固醇针对CPAM高危胎儿的治疗有一定效果,但对于大囊型病变类固醇治疗效果并不显著[22,23,24]。Knox等[25]对大囊型病变患儿行经羊膜针减压或胸膜羊膜分流术,结果提示羊膜腔引流与胎儿生存率显著相关,可改善围产期胎儿生存状况。
推荐意见2:绝大部分在孕中期发现的CPAM胎儿,预后良好(1B);CPAM胎儿水肿发生率极低,但一旦产前检查发现胎儿水肿,往往预后较差(1B)。CVR>1.6时有出现胎儿水肿风险;CVR<0.91时出现胎儿水肿风险概率低;CVR<0.56时不易出现胎儿水肿,预后良好(1C)。
少数患儿出生时由于病灶压迫心肺、纵隔偏移等,而产生严重的呼吸、循环障碍。这类患儿多为大囊型病灶,生后应及时进行急诊治疗[10]。条件允许时,可行一期根治手术;紧急情况下也可先通过急诊胸腔病灶引流,使病灶体积缩小,解除压迫效应,从而达到缓解症状的目的,后期再根据患儿情况择期或限期手术治疗[10,11,26]。
推荐意见3:CPAM患儿出生后因病灶压迫而发生呼吸、循环系统症状时,可根据病情行急诊手术处理(1A);可先行胸腔病灶引流缓解压迫症状,再根据病情,选择手术治疗时机(1C)。
CPAM患儿出生后大部分无明显症状,这部分患儿选择保守观察还是手术切除存在一定争议[12,27,28]。支持保守观察者认为应在保守观察期间出现症状后再行手术干预,并发症及手术风险发生率无明显增加;且对于良性病灶而言,行肺叶切除对患儿的损害可能比保守观察大,故建议对无症状的CPAM患儿谨慎干预,仅在出现如感染、气胸等症状后再行手术[29,30]。若选择保守观察,可选择的检查包括胸部X线片、超声、CT扫描、MRI或联合检查。目前多数研究建议CPAM患儿在出生后至少应进行1次胸部影像学检查[31]。
但综合文献报道结果提示,部分出生后无明显症状的CPAM患儿,随着年龄增加,可因感染及肿瘤相关风险等原因出现相应症状或问题[32,33,34,35]。Khosa等[35]报道30例产前诊断CPAM患儿,有30%的患儿在生后第1年出现感染症状。Kuroda等[36]报道,在出生时无症状的140例患儿中,有82.4%的患儿在生后3年内因感染出现症状,其中33.6%在生后1年内,22.1%在生后1~2年间,26.7%在生后2~3年间出现症状。Priest一项多中心回顾研究对1986~2007年间收治的35例CPAM患儿进行了随访观察,结果发现出生时无症状的21例患儿中有18例(85.7%)出现症状,包括肺炎、呼吸窘迫、气胸和慢性咳嗽等,症状出现的平均年龄为2岁[33]。该研究认为大部分无症状CPAM患儿在随访过程中,出现症状可能性较高,建议及时手术干预以免患儿症状进一步发展[33]。部分接受手术的无症状患儿,虽未表现出明显的临床症状,但病理检查仍可找到急、慢性炎症发生的证据。Durell等[37]的一项回顾性研究发现,在无症状CPAM患儿切除的病变肺组织中,23.1%有脓液、炎细胞浸润等感染和炎症证据。Till等[38]利用基因测序技术对7例无症状CPAM患儿术后病变部位微生物进行分析,发现有4例存在致病微生物(假单胞菌、链球菌和真菌)基因证据,其中3例存在下呼吸道感染证据。
目前,尚无技术方法能在术前明确区分胸膜肺母细胞瘤(pleuropulmonary blastoma,PPB)与CPAM[34,35,39]。Nasr等[34]报道74例肺切除患儿中有5例在术后病理检查中被确定为PPB,其中3例术前被诊断为CPAM。因此作者认为对于CPAM,尤其是4型CPAM患儿,术前应考虑PPB的可能[35]。Laberge等[40]研究发现CPAM患儿中存在支气管肺泡癌、横纹肌肉瘤以及黏液腺癌病例。Ota等[41]研究发现Ⅰ型CPAM病灶中的黏液细胞能产生类似支气管肺泡癌的胃黏蛋白,说明支气管肺泡癌与CPAM有一定联系。Conforti等[42]将CPAM病灶中的腺体成分与结肠增生性息肉中的黏液细胞进行比较,发现CPAM中的囊性病理改变具有向恶性病变转变的潜在可能。综合文献资料,由于无症状患儿存在感染和恶性肿瘤相关风险,目前手术治疗在处理CPAM上已能实现低风险、低并发症,因此建议无症状CPAM患儿择期手术治疗[10,12,26,27,43,44,45,46]。
推荐意见4:大部分CPAM患儿在出生前或出生时无症状(1A)。产前发现的无症状CPAM患儿,在出生后3~6个月内需至少行1次胸部影像学检查(1B)。
病灶最大直径<2 cm且无明显感染迹象的CPAM患儿,可行保守观察(2B)。观察过程中行影像学检查时,需综合考虑儿童辐射剂量、家庭对风险的衡量等问题,并根据病情变化情况选择是否终止保守观察(2D)。
保守观察终止指征:①病灶出现感染迹象;②病灶与PPB无法鉴别或基因检测提示恶性肿瘤高风险或家族史;③患儿出现明显压迫肺组织或心脏及大血管或气胸症状(1B)。
病灶最大直径>2 cm的无症状CPAM患儿,由于存在较高的感染及恶性肿瘤相关风险,建议择期手术治疗(1B)。
目前,对于无症状CPAM患儿的最佳手术时机,存在较多争论。对于手术年龄的争议主要集中于患儿病灶感染的发生对于CPAM手术治疗及预后的影响和术后肺功能代偿恢复情况[47,48,49,50,51]。
1998年,Nakajima等[47]报道了27例在婴儿或儿童期接受肺叶切除术患儿的长期肺功能随访情况,发现尽管术后患儿早期肺活量(%VC)立即下降,但会在术后2年内逐渐恢复到正常,而4岁后接受肺叶切除术与较早接受切除患儿比较,2年随访时间内%VC显著降低,因此建议CPAM患儿尽早切除病灶,可较大程度地保护患儿肺功能,给予患儿肺代偿发育的机会。Stanton等[31]与Laberge等[40]的研究也支持上述观点,建议在1岁前完成手术。Conforti等[42]认为,随着时间进展和患儿感染率地增加,会使得手术切除更加困难,导致住院和胸腔引流留置时间延长,以及更高的术后并发症发生率。Stanton等[31]的回顾性研究发现,CPAM患儿发生症状后手术(有症状组,136例)与无症状时手术(无症状组,95例)比较,有症状组出现手术并发症的风险比无症状组高2.8倍;同时该研究还发现CPAM患儿出生后出现症状的平均年龄为10月龄(2月龄至8.5岁),因此建议在症状发生前(10月龄前)进行手术切除。但也有文献报道,3月龄内手术的CPAM患儿较3月龄后手术患儿的并发症发生率高[49]。对于出生后无症状的CPAM患儿,综合大多数专家建议,手术年龄以3月龄至1岁为宜[31,40,42,50,51]。
推荐意见5:CPAM无症状患儿无须产后立即手术,在随访过程中行影像学检查时,需综合考虑儿童辐射剂量、家庭对风险的衡量等问题,根据病情变化情况,选择在3月龄至1岁期间进行手术(1C)。
当CPAM患儿出现下列情况时,建议尽早行手术治疗,包括:①与PPB无法鉴别者;②有病灶感染病史者,感染控制后;③病灶体积较大,有较高并发症风险者(1C)。
手术入路包括开放手术、胸腔镜手术与机器人手术。近年来,随着胸腔镜手术/机器人手术的不断成熟、设备的不断发展,与开放手术相比具有较低的手术创伤、较少的肩关节活动与胸廓发育受限、住院时间缩短、切口美观等优点,被越来越多的医生接受[52,53,54,55]。但机器人手术的缺点是费用昂贵。手术入路的选择,建议根据不同医疗机构及医生技术水平及患儿病情确定,以确保手术安全为目标。
推荐意见6:手术入路选择开放与腔镜/机器人手术均可,腔镜/机器人手术损伤较小、住院时间缩短等,符合现代快速康复的理念,临床医师可结合具体病例特点,并根据自身临床经验和医院条件选择合适的手术入路(1B)。
完全切除病灶是手术处理CPAM病灶的黄金治疗标准[56]。目前,CPAM手术治疗的主要方式包括肺叶切除、肺段切除或不规则切除等[31,57,58,59,60,61]。肺叶切除是通过切除病变肺组织所在肺叶达到对病灶的完全切除,是目前公认处理CPAM病灶的标准方式[12]。肺段切除和不规则切除均属于保肺手术(lung-sparing resection,LSR)。肺段切除是近年开始采用的保肺手术方式,其通过对段一级血管支气管组织结构的解剖分离,对病灶累及肺段组织进行精准切除,保留该肺叶内其余肺段正常肺组织;不规则切除,对边缘性病灶且与正常肺组织有明显边界时,可只对病灶累及肺组织进行切除[58,59,60,61]。
CPAM患儿病灶仅累及一个或多个肺段时,采用肺段切除可保留一部分正常肺组织。尤其在病灶累及多个肺叶时,采用肺叶切除的方式可能需行单侧多肺叶甚至全肺切除,术后发生胸廓畸形、纵隔偏移及严重心肺并发症风险增高。为尽可能避免上述并发症,可考虑采用保肺手术方式处理该类病例。采用肺段切除时,需严格把握其适应证,准确判断病灶累及情况、明确病灶累及肺段范围。目前常通过对术前薄层CT的判读、术中病灶探查及肺段断面的病灶累及情况谨慎决定,尽可能避免病灶残留情况发生[57,58]。根据病灶累及情况采用单侧多叶内肺段切除、单侧肺叶肺段联合切除等方式,能在完全切除病灶的同时最大限度地保留更多正常肺组织,避免多肺叶切除甚至全肺切除后产生的并发症。对极为罕见的双肺弥漫累及病例,可考虑肺移植。程凯昇等[58]报道12例病灶累及单侧多个肺叶CPAM患儿,9例行单侧多叶肺段切除,3例行单侧肺叶肺段联合切除,术后均无明显并发症发生,术后3个月随访无病灶残留,提示采用保肺手术处理单侧多肺叶受累病例是安全和有效的。目前认为,肺段切除在处理单叶肺段和多叶肺段累及病例时具有明显优势,但确切结论仍需多中心大样本研究。由于技术上的局限及适应证选择等问题,肺段切除仍存在术后病灶残留及并发症发生率较高等情况,使其运用有一定局限性,要求术者严格把握手术适应证,同时需在熟练掌握肺叶切除基础上开展[26,59,60,61]。
推荐意见7:CPAM手术治疗常用的3种方式(肺叶切除、肺段切除、不规则切除)均可选用,只要做到指征选择合理,完全切除病灶,均可取得满意预后(1B)。肺叶切除术仍是手术治疗CPAM患儿的标准术式(1B)。经过严格选择,对于具备手术适应证的CPAM患儿,LSR是一种安全有效的治疗手段(1C)。
楔形/不规则肺切除手术指征:通过术前高分辨率薄层CT扫描及术中探查确认,病灶位于外周体积较小,且有较确切边界(1C)。
肺段切除手术指征:通过术前高分辨率薄层CT扫描及术中探查确认,病变局限在一个或数个肺段,肺叶内存在未累及病变的肺段(1C)。
对于多叶病变患儿,行LSR可以保留更多肺组织及避免全肺切除后并发症,具有较大优势,但需严格把握手术指征(1B)。双侧弥漫性病变者终末阶段,可考虑肺移植(2C)。
近年来,随着儿童腔镜/机器人手术技术的不断成熟,手术中转例数正逐渐减少,远低于早期报道[43,44,45,53]。腔镜/机器人手术在CPAM治疗中具有一定优势,但在实际临床操作中也存在一定局限性。首先,儿童腔镜/机器人肺切除手术难度较大,术者需熟悉掌握儿童肺部解剖结构;同时由于CPAM患儿单肺通气困难、肋间狭窄、手术空间较小,较其他腔镜手术难度大[62]。其次,CPAM患儿叶间裂、支气管与血管解剖结构常出现不同程度变异,使得手术处理更加困难,技术要求更高;术中需处理肺部大血管,若处理不当易出现大出血,且由于儿童血容量较小,易出现严重手术并发症,甚至危及患儿生命[63]。此外,CPAM患儿病灶常发生感染,导致胸腔组织结构粘连,影响手术操作,增加手术难度;同时,在处理大囊型病例时,由于病灶体积过大,影响胸腔内视野与操作空间,也会使得腔镜手术难度增大,在无法保证安全时,建议中转开放手术[48]。综上所述,在行腔镜/机器人手术处理CPAM患儿时,存在较多技术难点,只有熟练掌握腔镜/机器人手术技巧,同时把握好中转开放手术指征,才能充分发挥腔镜/机器人手术优势,降低手术风险,力求以最小的手术创伤获得最佳手术效果。此外,对于压迫肺组织或心脏及大血管症状明显、全身状况较差、无法耐受单肺通气或人工气胸的CPAM患儿,应积极选择开放手术[64,65]。
推荐意见8:术中意外损伤导致难以控制的出血,无法有效止血时,应紧急开胸止血以免延误抢救时机(1A)。术中发现合并叶间裂严重发育不良或支气管、血管有较大变异,腔镜/机器人手术下操作困难,难以完成手术时,应及时中转开胸手术处理(1B)。术中腔镜/机器人手术下操作空间不足,预计难以完成手术操作时,建议转为开放或直接采用开放手术(1B)。患儿无法耐受单肺通气或人工气胸时,建议直接采用开放手术(1B)。
目前,手术治疗CPAM仍存在一定并发症。由于CPAM患儿肺组织常会出现叶间裂发育不全、肺部支气管或血管等结构变异,一旦处理不当,可能产生术后出血、漏气等并发症[31,43,44,45,56,61]。这些并发症的出现主要是由于在处理发育不全的叶间裂时,需对叶间裂组织进行劈离操作,术后存在较大肺组织断面,继而出现断面漏气与渗血,而这类并发症在感染患儿中发生率更高[31,42,49,63]。因此,术者应在手术过程中仔细分辨各组织结构并行精细化处理,在手术结束前对各断面、断端进行反复检查,确保无大血管及支气管出血和漏气。术后应保持胸腔闭式引流管通畅,并注意记录引流情况、引流量和引流物性状,重点了解有无术后出血和漏气发生,同时应在术后及时复查胸部X线平片或CT,结合胸腔闭式引流情况,评估并发症发生情况及严重程度,决定治疗策略。
若术后胸腔闭式引流管持续有气体漏出,可暂时予以观察;小的肺泡性漏气可自行愈合,若持续有大量气体漏出,考虑有支气管胸膜瘘发生,应及时手术处理。若引流管内有持续较大量鲜红液体引出,应考虑术后出血可能,根据引流量大小及其变化情况和患儿一般情况及生命体征,决定是否再次行手术处理[66,67,68]。若术后患儿出现发热,应对发热原因进行判断,鉴别患儿是因术后较多创面渗出物的吸收而导致的吸收热,还是因术后感染而导致的发热。若为感染导致的发热,应及时足量给予抗生素治疗,特别是在术前已有感染病史的病例中,术后应常规使用抗生素治疗[44]。此外,对于术中肺组织牵拉钳夹所致挫伤及术后支气管因分泌物堵塞等因素,术后肺不张常有发生,可通过加强患儿术后物理治疗,并辅以雾化、必要时使用纤支镜。
由于部分CPAM患儿病灶范围较大、边界不清且易对正常肺组织造成推挤,行肺段或楔形切除等保肺术后,可能发生病灶残留[31,59,60]。Stanton等[31]报道有15%的患儿在行肺段切除后发生病灶残留。Johnson等[59]报道有6.6%的患儿行保肺手术后因病灶残留行二次手术切除。在行肺段切除或不规则切除时,应严格把握手术适应证,准确判断病灶范围,明确病灶累及情况,并结合术中病灶探查谨慎决定,尽量避免病灶残留[58]。当术后随访过程中发现病灶残留时,多数研究建议再次手术切除病灶,具体术式根据残留情况而定[31,57,60]。对于再次手术的时机,目前相关文献报道较少,Fascetti等[60]认为,对于出现术后残留者,宜在术后5个月左右再次行手术切除。
推荐意见9:①术后应及时行影像学检查,并根据检查结果和引流情况,评估并发症发生情况及严重程度,决定治疗策略(1B)。②若术后胸腔闭式引流管持续有气体漏出,可暂时保留引流管予以观察,肺泡性漏气与小支气管漏气多可经保守观察自行愈合;若持续有大量气体漏出,考虑有支气管胸膜瘘发生,应及时手术处理(1B)。③若术后胸腔闭式引流管内有持续鲜红液体引出,应考虑术后出血可能,根据引流量大小和变化情况,患儿一般情况及生命体征变化情况,决定是否再次行手术处理(1B)。④严格把握手术适应证,对病灶累及情况进行明确判断,选择合适的手术方式,减少病灶残留的发生(1B)。若随访发现术后残留病灶存在变大趋势及明显感染可能,建议再次行手术切除(2C)。
对于产前发现的CPAM胎儿,大多能顺利分娩出生;极少部分胎儿会因病灶压迫导致胎儿水肿,发生宫内死亡[8,19,36,69]。少数CPAM患儿出生时由于病灶压迫,导致心肺受压、纵隔偏移从而产生呼吸窘迫等症状,若未及时处理可能会造成患儿死亡[8,69]。此类患儿应在出生后积极采取措施,在给予呼吸循环支持的同时急诊手术治疗[10,11]。大部分无症状的CPAM患儿,病程中可能会出现患侧肺部反复感染及气胸,同时与其他肺部恶性肿瘤存在一定相关性,具有向恶性病变转变的潜在可能[12,40,41,42]。
CPAM为良性疾病,大多数患儿出生后按计划早期接受手术治疗,总体预后良好。对CPAM患儿行手术切除,在严格把握手术指征、熟练掌握手术技术的前提下,并发症发生率及术后病灶残留率均较低,可以达到快速康复的目的[43,44,45,61]。研究发现,接受早期手术治疗的CPAM患儿,术后肺功能(%VC、RV/TLC)较正常参考值无明显差异;在用力肺活量(forced expiratory volume,FVC)、第一秒用力呼气容积(forced expiratory volume in one second,FEV1)、第一秒用力呼气容积与用力肺活量比例(FEV1/FVC)等方面,与正常儿童肺功能相比,无显著性差异[47,70,71]。同时研究发现,CPAM肺叶切除术后患儿的运动能力和心肺功能与正常儿童无显著性差异[72]。目前为数不多的中、远期术后肺功能研究均显示,CPAM患儿术后肺功能恢复较好,与正常儿童无显著差异,但仍需长时间的随访观察。
推荐意见10:①产前发现的CPAM胎儿大多能顺利分娩出生,极少部分会因病灶压迫导致胎儿水肿,发生宫内死亡(1B);CPAM为良性疾病,大多数患儿出生后按计划早期接受手术治疗,术后肺功能可恢复到正常儿童水平,总体预后良好(1B)。
执笔专家(排名不分先后):徐畅(四川大学华西医院)、莫绪明(南京医科大学附属儿童医院)、彭卫(南京医科大学附属儿童医院)
指导委员会成员(排名不分先后):曾骐(首都医科大学附属北京儿童医院)、冯杰雄(华中科技大学同济医学院附属同济医院)、贾兵(复旦大学附属儿科医院)
共识制定及讨论专家组成员(以单位拼音为序):安徽省儿童医院(段贤伦);长春市儿童医院(陶永欣);成都市妇女儿童中心医院(张利兵);重庆医科大学附属儿童医院(李勇刚);大连市儿童医院(文平);复旦大学附属儿科医院(贾兵);广东省妇幼保健院(洪淳);广州市妇女儿童医疗中心(刘威);广州医科大学附属第三医院(俞钢);河北医科大学附属第二医院(李索林);哈尔滨市儿童医院(李怀宁,戚家峰);海南省妇女儿童医学中心(陈仁伟);河北省儿童医院(岳芳);河南省儿童医院(翟波);湖南省儿童医院(黄鹏);华中科技大学同济医学院附属同济医院(冯杰雄);华中科技大学同济医学院附属协和医院(汤绍涛、李帅);江西省儿童医院(明腾);南京医科大学附属儿童医院(莫绪明、彭卫);青岛市妇女儿童医院(邢泉生、陈瑞);山东大学齐鲁医院(李爱武);上海儿童医学中心(刘锦纷、孙彦隽);上海市儿童医院(张儒舫);首都儿科研究所附属儿童医院(李龙、张晓伦、武玉睿);首都医科大学附属北京儿童医院(曾骐、黄金狮、张娜);四川大学华西医院(徐畅);四川省人民医院(刘文英);山西省儿童医院(刘彩霞);深圳市儿童医院(王元祥);武汉儿童医院(皮名安);西安交通大学第二附属医院(李鹏);西安市儿童医院(施伟栋);香港大学深圳医院(黄格元);新疆维吾尔自治区人民医院(李水学);徐州市儿童医院(崔传玉);浙江大学附属儿童医院(舒强、李建华、张泽伟);中国医科大学附属盛京医院(贾慧敏)
所有作者均声明不存在利益冲突

























