
肾盂输尿管连接部梗阻(ureteropelvic junction obstruction,UPJO)是梗阻性肾积水的主要原因,治疗时机和对预后的预测仍存在争议。目前常用超声和放射性检查来进行随访监测,以判断患儿的肾损害程度及是否需要手术干预,存在一定的局限性。近年来,一些研究已经探讨了对UPJO具有潜在诊断价值及对预后有预测价值的生物标志物,如中性粒细胞明胶酶相关脂质载运蛋白、转化生长因子β1、表皮生长因子、单核细胞趋化肽-1、N-乙酰-β-D-氨基葡萄糖苷酶、内皮素-1等。本文就此类生物标志物在UPJO患儿中的研究进展做一综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
产前肾积水(antenatal hydronephrosis,ANH)是产前超声检查最常见的异常之一,在所有妊娠中占1%~5%。超过一半的病例在妊娠末期或产后早期缓解,无须手术干预即可消退,因此被认为是集合系统暂时性生理扩张即暂时性肾积水。肾盂输尿管连接部梗阻(ureteropelvic junction obstruction,UPJO)约占ANH的10%~30%,是非暂时性肾积水的主要原因[1,2]。
先天性尿路梗阻(congenital urinary tract obstruction,CUTO)指的是妨碍肾盂系统的排尿,导致压力升高和尿流率降低,并且如果不加以纠正,将限制发育中肾脏的最终功能,包括肾功能的储备能力和对压力的反应[3]。CUTO在所有妊娠中的发病率是1∶2 000,是患儿先天性梗阻性肾病(congenital obstructive nephropathy,CON)及肾衰竭的主要原因。UPJO是梗阻性肾积水的主要原因,是CUTO中最常见也是最棘手的疾病[4,5]。因为并非所有病例都需要手术治疗,且缺乏足够的生物标志物来描述病变的严重程度和预测肾损害的进展,所以对UPJO患儿的理想治疗方式仍是一个很有争议的问题。
目前在各种UPJO动物模型、UPJO患儿血液和(或)尿液中均发现了一些相关的新型生物标志物。许多文章对其进行了研究,大部分都是有价值的结果。但鉴于在梗阻过程中肾损害的多因素性,将这些生物标志物用于临床诊断实践尚在探索阶段。本文就UPJO的生物标志物在儿科患儿中的研究进展做一综述。
目前可用于临床测量的肾结构和功能包括肾脏超声、利尿剂核素肾显像和血浆肌酐(creatinine,Cr)浓度检查,对部分患儿的未来病程预测较差,且耗费时间较长,在给患儿带来心理负担的同时也不易进行随访监测[6,7]。除此之外,由于发育过程中的功能变化,监测患儿肾功能的变化则变得尤为复杂,加大了根据这些检查及时识别出需手术治疗的患儿的难度[8]。
根据欧洲小儿泌尿外科协会指南[9]建议,目前用于手术的主要指征是:①利尿性核素显像提示排泄受阻;②分肾功能<40%;③在随访过程中分肾功能下降>10%;④超声检查发现肾盂前后径(anteroposterior diameter of renal pelvis,APD)进行性增加;⑤胎儿泌尿外科学会(society for fetal urology,SFU)分级系统Ⅲ级及以上。人们担心这可能会产生不必要的手术或者观察时间太久而导致肾功能低下,尤其在年纪比较大的孩子中,可能会导致进行性肾小管萎缩和间质纤维化,最终造成肾功能衰竭[10]。
专家们越来越担心,这些指征既不能筛选出理想的手术患儿,也不能保证最合适的手术时机[7]。因此,迫切需要更加敏感、特异且能反映梗阻性肾损伤后的病理生理变化,易于测量且不受外源性物质干扰的评价指标。
UPJO致梗阻性肾病(obstructive nephropathy,ON)的病因是多因素的,可能的病理生理机制包括:①肾小管扩张、表型细胞迁移和细胞死亡;②间质炎症;③肾小球损伤和进行性间质纤维化,以此为切入点来探寻其生物标志物是目前的一个研究方向[11]。早期和进行性CON的潜在生物标志物可能要从泌尿道和肾脏(包括单个肾单位和肾小管段)的结构、CON对肾功能的影响或肾细胞对梗阻性损伤的反应中去寻找[12]。目前研究的主要内容也主要基于此,包括中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)、转化生长因子β1(transforming growth factor beta 1,TGF-β1)、表皮生长因子(epidermal growth factor,EGF)、单核细胞趋化蛋白-1(monocyte chemoattractant peptide-1,MCP-1)、N-乙酰-β-D-氨基葡萄糖苷酶(N-acetyl-beta-D-glucosaminidase,NAG)、内皮素-1(endothelin-1,ET-1)等(表1)。
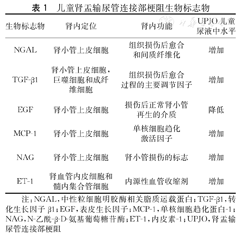
儿童肾盂输尿管连接部梗阻生物标志物
儿童肾盂输尿管连接部梗阻生物标志物
| 生物标志物 | 肾内定位 | 肾内功能 | UPJO儿童尿液中水平 |
|---|---|---|---|
| NGAL | 肾小管上皮细胞 | 组织损伤后愈合和间质纤维化 | 增加 |
| TGF-β1 | 肾小管上皮细胞,巨噬细胞和成纤维细胞 | 组织损伤后愈合过程的主要调节因子 | 增加 |
| EGF | 肾小管上皮细胞 | 损伤后正常肾小管再生的介质 | 降低 |
| MCP-1 | 肾小管上皮细胞 | 单核细胞趋化激活因子 | 增加 |
| NAG | 肾小管上皮细胞 | 肾小管损伤的标志 | 增加 |
| ET-1 | 肾血管内皮细胞和髓内集合管细胞 | 内源性血管收缩剂 | 增加 |
注:NGAL,中性粒细胞明胶酶相关脂质运载蛋白;TGF-β1,转化生长因子β1;EGF,表皮生长因子;MCP-1,单核细胞趋化蛋白-1;NAG,N-乙酰-β-D-氨基葡萄糖苷酶;ET-1,内皮素-1;UPJO,肾盂输尿管连接部梗阻
NGAL是一种与中性粒细胞明胶酶共价结合的蛋白质,又名脂质运载蛋白-2、蛋白酶-3或噬铁蛋白,被认为是一个对肾小管间质纤维化敏感的早期生物标志物,在肾小管上皮细胞中局部合成,并释放到尿液中,也可从受损的肾小管上皮细胞释放到血液循环中。梗阻时其在尿液中的表达是远端肾单位基因表达增加和近端肾小管重吸收改变共同作用的结果。受损肾小管上皮细胞NGAL表达的上调可能是由缺血损伤早期微循环中的中性粒细胞释放细胞因子引起的。也有报道指出在机体有炎症反应时,由于炎症细胞和上皮细胞之间的相互作用,NGAL的表达也会明显上调[13,14]。
Kuwabara等[15]对单侧ON小鼠模型进行了研究,发现NGAL通过局部合成作用,特异性定位于梗阻肾远端的肾单位,然后通过重吸收作用局限在对侧肾的近端肾小管中,并积聚在肾盂收集的尿液中,与正常小鼠对比,NGAL mRNA在梗阻肾中的表达增加了100倍。在Wasilewska等[16]的研究中,平均年龄为2.16岁的患儿被分为3组(需手术的重度UPJO致肾积水患儿20例,不需手术的非梗阻型肾积水患儿20例,健康儿童25例),取术前第一天晨尿用酶联免疫吸附试验测定尿NGAL浓度,发现需手术治疗的患儿术前膀胱尿NGAL明显高于其他两组,因此NGAL可用于鉴别需手术治疗的患儿与保守治疗的患儿,采用受试者操作特征(receiver operator characteristic,ROC)曲线分析,发现其对分肾功能<40%的UPJO患儿具有很好的诊断价值,曲线下面积分别为0.814和0.868。Bienias'和Sikora[14]对45例平均年龄为11岁的单侧UPJO患儿进行研究,取同一天中段晨尿并用酶联免疫吸附试验进行尿蛋白定量分析,并采用超声分级将其分组,发现肾积水伴ON患儿的尿NGAL水平明显高于肾积水不伴ON患儿,且尿NGAL水平与肾动态显像中梗阻肾的功能恶化程度呈正相关;ROC曲线分析显示,尿NGAL/Cr比值对ON的检测具有很好的诊断价值。因此尿NGAL可能是诊断UPJO所致肾积水引起ON的潜在生物标志物[14]。Karakus等[17]对平均年龄为4岁的13例单侧UPJO行肾盂成形术的患儿和9例健康儿童进行研究并用酶联免疫吸附试验检测尿液上清液,发现术前UPJO患儿膀胱尿NGAL水平明显高于健康对照组,且在术后第六个月下降到与对照组相似的水平,因此尿NGAL水平的降低可作为预测手术结果的指标。然而,也有文章提出在泌尿生殖系统局部感染时NGAL也会升高,导致其诊断特异性降低[18]。此外,上述研究都存在样本数量不够大的缺陷且缺乏足够长时间的随访,因而需扩大样本量并延长随访时间以进一步确定其价值。
TGF-β1由肾小管上皮细胞、巨噬细胞和间质成纤维细胞合成,是组织损伤后愈合的主要调节因子,可刺激间质成纤维细胞的活化和肾小管上皮细胞向成纤维细胞的分化以及肾小管上皮细胞的凋亡,并使得肾瘢痕形成和肾固有细胞丢失,是ON及各种晚期慢性肾脏病发展的共同发病机制[19,20]。
Palmer等[21]采用ELISA法第一次证实了UPJO患儿患侧肾盂尿和膀胱尿中TGF-β1升高。Yang等[22]应用免疫组织化学染色、原位杂交以及实时逆转录聚合酶链反应技术检测发现UPJO患儿梗阻肾组织中TGF-β1基因与蛋白表达都显著升高,且与造影剂清除时间及组织学分级呈正相关。Almodhen等[23]研究了产前诊断为单侧肾积水的患儿中膀胱尿TGF-β1水平与肾积水严重程度的关系,用酶联免疫吸附试验测定造影期间通过导尿获得的膀胱尿液,结果发现手术组膀胱尿TGF-β1水平明显高于非手术组,患儿出生后3个月的尿TGF-β1在预测产前诊断为肾积水患儿手术需求方面具有82%的敏感性和86%的特异性(TGF-β1/Cr截止值为17 pg/mmol),并且随着时间的推移,尿TGF-β1浓度与肾积水级别的变化相似。Kostic等[3]研究证实TGF-β1可与视黄醇结合蛋白(retinol-binding protein,RBP)联合应用以提高双侧及单侧UPJO患儿的诊断敏感性。Taha等[20]用酶联免疫吸附试验在单侧UPJO行肾盂成形术的平均年龄为5.7岁的患儿中证实术前膀胱尿TGF-β1水平明显高于健康对照组,并且与术前相比TGF-β1在术后1年的随访中明显降低,提示其作为UPJO患儿术后1年长期随访的无创性指标的可能性。在El-Sherbiny等[24]和Taha等[20]的随访研究中均发现术后1个月内TGF-β1的水平暂时性升高,提出可能与肾盂输尿管的愈合对生长因子的需求有关。不过,TGF-β1升高并不是ON所特有,在IgA肾病、膜性肾病及糖尿病患儿中也可升高,导致其诊断特异性降低[10]。
EGF是一种低分子量、热稳定的多肽,与EGF受体结合发出信号,在调节上皮细胞生长和代谢方面发挥关键作用,在肾小管间质损伤中,它在调节肾小管细胞生长和组织反应中起着重要作用,是肾损伤后肾小管再生的介质[25,26]。EGF主要在肾脏生成,具体位于髓袢升支粗端和远曲小管,在调控肾脏发育、肾小球血流动力学、肾脏代谢及肾小管转运中起着重要作用[22]。
在动物实验中发现,慢性单侧输尿管梗阻(unilateral ureteric obstruction,UUO)的新生大鼠肾EGF的生成受到抑制,外源性EGF可极大减少UUO新生大鼠的肾小管凋亡,并促进梗阻解除后的恢复[27,28]。Yang等[22]的研究证实EGF在UPJO肾组织中的表达下调,且EGF基因及蛋白表达水平与造影剂清除半衰期和组织学分级呈负相关,并在发育不良的肾小管中发现了阳性颗粒,提示EGF的异常表达可能在肾发育过程中改变肾小管的分支形成,导致先天性肾积水肾小管发育不良。Li等[29]对SFU 3~4级的单侧UPJO肾积水的手术组及随访观察组患儿运用酶联免疫吸附试验测定膀胱尿EGF水平,发现随访观察组患儿尿EGF水平明显高于手术组,采用ROC曲线分析发现其在患儿出生后的前6个月可以预测ANH患儿是否需行手术治疗。然而,EGF作为肾积水患儿肾小管损伤标志物的作用仍存在争议。Taha等[20]采用酶联免疫吸附试验对平均年龄为5.7岁的35例单侧UPJO患儿与30例健康对照组的研究发现,UPJO组术前膀胱尿EGF水平与对照组无显著差异,术后随访膀胱尿EGF水平也与对照组无明显差异。Li等[29]和Taha等[20]研究结论的差异可能是因为两项研究中的对照组不同。Mohammadjafari等[30]对有ANH史(重度梗阻、轻度梗阻和产后超声检查正常新生儿),年龄为1周至2个月的患儿进行研究,发现严重梗阻患儿膀胱尿EGF∶Cr的值明显升高,提出可能和研究对象年纪过小有关,因此EGF在UPJO患儿中的应用仍需进一步验证。
MCP1是一种促进单核细胞趋化的趋化因子。在梗阻的情况下,其在肾小管的表达可能与这些炎症细胞在间质内的募集密切相关。因此,尿中MCP-1的排泄可能与单核细胞浸润的程度以及由此引起的间质性肾纤维化的进展有关[31]。
Diamond等[32]通过免疫组织化学检测的方式发现UUO大鼠MCP-1的表达增加,且与间质巨噬细胞数量增加的时间一致。Stephan等[33]进行的动物研究发现MCP-1在肾组织内的表达和肾盂尿浓度及梗阻程度有关,并且可以提示肾积水继发肾损害的程度。Yu等[34]对17例平均年龄为84个月的UPJO患儿在术中麻醉诱导后立即插管取膀胱尿,并用酶联免疫吸附试验进行尿蛋白定量分析,发现与健康对照组相比,UPJO患儿尿液中MCP-1水平显著升高,且双侧UPJO患儿尿MCP-1水平明显高于健康对照组和单侧UPJO患儿。Grandaliano等[27]的研究证实了这一发现,肾活检采用免疫组织化学检测和原位杂交技术发现MCP-1 mRNA在健康肾组织中无表达,在UPJO患肾组织中高表达,而在有尿路感染史的UPJO患儿中平均尿MCP-1浓度明显高于无感染史组,并且梗阻侧肾盂尿中的MCP-1浓度与99mTc-MAG3清除率呈显著负相关。Taranta-Janusz等[35]及Mohammadjafari等[36]对UPJO引起的儿童肾积水的研究发现,有手术指征的患儿MCP-1/Cr比值明显升高,提示MCP-1有作为判断UPJO患儿手术指征的可能性[35,36]。Karakus等[17]将平均年龄为4岁的单侧UPJO患儿分为肾盂成形术组13例、非梗阻型扩张随访组14例和健康对照组27例,运用酶联免疫吸附试验分析尿液上清液,发现UPJO组膀胱尿MCP-1水平明显高于健康对照组及非梗阻型扩张随访组,根据ROC曲线分析,MCP-1具有良好的诊断特征,可用于区分UPJO和非梗阻型扩张,且MCP-1水平在术后第3个月明显下降,可作为预测手术结果的指标。
NAG是一种存在于近曲小管细胞中的溶酶体酶,由于其分子量较大,无法通过肾小球基底膜滤过并在循环过程中被肝脏迅速清除。因此,尿NAG主要来源于近曲小管,梗阻性肾损害发生后会损害近曲小管,导致细胞膜损伤,其尿排泄增加是肾小管细胞破裂的结果,且NAG的稳定性较好,这就为发现肾小管损伤提供了极好的早期指标[37,38]。
Carr等[39]对CUTO的患儿研究发现,单侧UPJO患儿肾盂尿NAG水平是健康对照组的7倍,膀胱尿NAG水平也比对照组显著升高,揭示了其在UPJO诊断中的可能性。Taha等[40]进一步研究,将35例行肾盂成形术的年龄范围为6个月至12岁单侧UPJO患儿作为研究组,15例年龄相仿的单侧扩张无梗阻的患儿作为对照组,用快速比色测定法测定各组患儿的随机尿NAG,发现术前研究组尿NAG活性明显高于对照组,ROC曲线分析表明尿NAG在判断UPJO患儿手术需求上有97.1%的敏感性和80%的特异性(NAG/Cr截止值=7.8 mU/mg),当与碱性磷酸酶合用时,其敏感性可达到100%,因此尿NAG可作为判断UPJO患儿手术的准确指标。术后长期随访发现,UPJO患儿在术后12个月时尿NAG显著降低,因此可作为术后长期随访的指标。然而,尿NAG在术后前3个月的时候并无显著降低,这表明在梗阻解除后,肾脏需要时间来恢复功能和超微结构。马洪等[41]采用酶联免疫吸附试验检测患儿健侧肾和患肾术前行逆行肾盂造影检查时留取的尿液上清液,发现肾积水患儿尿NAG水平与病理分级呈正相关。另有研究发现,尿NAG/Cr水平与梗阻程度无关,因此其与肾积水患儿肾损害程度的关系需进一步确定[36,42]。同时,虽然NAG的敏感性很高,但特异性并不是很高,在膀胱输尿管反流、尿路感染、肾盂肾炎及糖尿病时均会增加[37,40,43]。
ET-1是一种含有21个氨基酸的多肽,主要由肾脏的血管内皮细胞和髓内集合管细胞产生,是目前已知最强效的内源性血管收缩剂。在肾脏中,ET-1在维持肾灌注及调控肾小球小动脉张力和血流动力学方面起着至关重要的作用[44,45]。已有研究证实,ET-1在肾小球前小动脉狭窄的发生中参与了梗阻后肾间质纤维化的进展,是泌尿系统梗阻过程中血管和细胞损伤的介质[46,47,48]。
Hegarty等[49]对单侧UUO大鼠模型研究发现梗阻肾组织ET-1的表达增加,对侧肾ET-1的表达降低。给一组UUO大鼠注射ET-1受体拮抗剂后,观察到这组大鼠的ET-1受体的抑制作用与梗阻肾的血流恢复有关,且细胞凋亡率降低到与对照组相似的水平,提示ET-1参与了梗阻进程且ET-1受体拮抗剂作为治疗用药的可能性。Knerr等[50]采用实时逆转录聚合酶链反应测定20例平均年龄为5.1岁的UPJO患儿和21例平均年龄为23.5岁因肿瘤或肾外伤接受肾切除术的成年患者组织标本中ET-1的含量,发现梗阻肾组织中ET-1的表达明显增加。Taha等[51]的研究中,将行肾盂成形术的35例年龄范围为6个月至12岁的单侧UPJO患儿作为研究组,30例年龄相仿患儿作为对照组,对照组包括10例健康儿童,10例膀胱输尿管反流,10例肾结石;术前收取UPJO患儿的膀胱尿,麻醉诱导后肾盂穿刺取尿,术后和对照组同时收集膀胱尿,用酶联免疫吸附试验测定发现术后研究组肾盂尿ET-1水平明显高于术前同一患儿膀胱尿ET-1水平;UPJO患儿术前膀胱尿ET-1水平明显高于对照组,是健康儿童的4倍,采用ROC曲线分析发现在肌酐截止值为3×10-3 μmol/kg,敏感性为74.3%,特异性为90%。长期随访发现,在肾盂成形术后12个月,膀胱尿ET-1较术前明显降低,提示ET-1可作为UPJO患儿的无创性诊断和长期随访指标。然而Mohammadjafari等[36]对梗阻型肾积水患儿的研究发现尿ET-1/Cr水平与梗阻程度无明显关系,因此其与肾积水患儿肾损害程度的关系需进一步研究确定。
尿液蛋白质组学分析是一种寻找新型生物标志物的好方法。在最新的一项研究中,Chen等[52]采用串联质谱技术对单侧肾功能不全(分肾功能<40%)UPJO患儿的膀胱尿和肾盂尿进行蛋白质组学分析,并与健康对照组的尿液进行比较。然后利用基因本体(gene ontology,GO)功能富集分析来分析蛋白质的一般特性。发现与对照组相比,膀胱尿液组和肾盂尿液组的尿液蛋白质组学分析结果存在显著差异,结果经蛋白质印迹法检测证实胎球蛋白A、α 1-酸性糖蛋白1、α 1-酸性糖蛋白2、α 1-微球蛋白/bikunin前体和前列腺素-H2D-异构酶在尿液中的浓度增加,可能是UPJO潜在的生物标志物。
寻找尿生物标志物的一种方法是通过尿液蛋白质组学分析进行大规模搜索。另一种方法是研究已知在UPJO或其他类型肾病中上调或下调的细胞因子。肾脏损伤分子-1(kidney injury molecule-1,KIM-1)是近年来公认的肾小管间质纤维化的生物标志物,在肾损伤时,其在近端肾小管上皮细胞中明显上调,促进上皮细胞再生并吞噬凋亡细胞[14]。近期的几项在UPJO致HN患儿的研究中发现,重度HN患儿膀胱尿KIM-1水平明显高于轻度HN患儿以及健康患儿[16]。进一步研究发现,膀胱尿KIM-1/Cr的测定有助于新生儿重度梗阻性肾积水的鉴别诊断,且在尿KIM-1/Cr截止值为0.4 765时的敏感度为81%,特异性为71%[30]。长期随访发现肾盂成形术后第3个月膀胱尿KIM-1水平明显下降,可作为预测手术结果的指标[18]。在近期的两项研究中发现,RBP可单独或联合使用,鉴别出可通过早期手术获益的CUTO患儿,且当其与TGF-β1联用时可提高诊断敏感性[3,53]。还有研究发现,UPJO患儿膀胱尿液中白细胞介素-6(interleukin-6,IL-6)蛋白的表达显著升高,且双侧UPJO患儿膀胱尿中IL-6水平明显高于单侧UPJO患儿和健康对照组[34]。其他已被评估的生物标志物包括碱性磷酸酶、谷氨酰胺转移酶、水通道蛋白-1、干扰素-γ-诱导蛋白-10、白介素-18、β2-微球蛋白等。这些新型梗阻型肾病标志物能否在UPJO患儿中得到应用,仍需进一步研究。
综上所述,在各种疾病的诊断和治疗中,尿生物标志物作为一种无创性的检查越来越多地在文献中被报道,而且这些生物标志物的使用在儿童患儿中尤其重要,因为有创性检查在儿童中的使用是一个非常值得关注和考虑的问题。尿液中的生物标志物不仅有助于UPJO的诊断,而且有助于鉴别需要保守治疗的患儿和需要手术矫正的患儿。此外,一些研究表明,有些尿生物标志物还有助于评价UPJO患儿肾积水手术治疗的成功率。因此,膀胱尿液生物标志物具有重要的临床应用价值。然而,现有研究可能会因样本量小和缺乏不同类型的对照组而受到质疑。
考虑到UPJO的多因素性及不可预测的病程,采用单一生物标志物作为UPJO生物标志物的敏感性和特异性较低,可以考虑建立一组生物标志物。生物标志物组合的选择可以基于其已知的生理特征,如肾小管缺血损伤时NGAL和KIM-1的急性分泌,缺血状态延长时TGF-β1的排泄,以及RBP和胱抑素C几乎被肾小管重吸收等。采用ROC曲线分析等方法,判断单一或组合生物标志物的敏感性和特异性,以确定其在临床应用的价值。TGF-β1和MCP-1等生长因子可能在术后有短暂的升高,可能与肾盂输尿管的愈合对生长因子的需求有关,因此应采用更长时间的随访来验证其效应。
未来的研究应严格按照患儿群体定义,例如针对不同程度的UPJO患儿、非梗阻性肾积水患儿和健康儿童来设计,以研究生物标志物的鉴别能力。对于生物标志物的应用,一个基本的挑战是建立参考值,考虑到它们可能受到分析方法、个体差异以及患儿年龄等的影响,我们需要更多病例数的临床研究和更长的随访时间来确定参考值。
所有作者均声明不存在利益冲突



























