
初步探究儿童期川崎病并发冠状动脉瘤外科治疗方案及早期疗效。
回顾性分析2018年3月至2019年8月上海儿童医学中心心胸外科收治6例川崎病合并冠状动脉瘤患儿的临床资料。其中,男5例,女1例;年龄为(148.7±29.0)个月,范围在106~203个月;体重为(47.9±15.5)kg,范围在27.5~76 kg。6例患儿术前均明确诊断川崎病,经过规范药物治疗;平均治疗时间为5.7年,范围在3个月至10年。病程中患儿均出现不同程度心功能不全表现,心脏彩色超声及心脏CT检查显示病变段冠状动脉进行性扩张,部分患儿形成动脉瘤内血栓造成冠状动脉狭窄,影响心肌灌注。术前4例患儿行心导管检查,冠状动脉瘤远端血流TIMI分级为0级3例、Ⅰ级1例。6例患儿均接受冠状动脉搭桥手术,其中3例行停跳搭桥手术,3例行不停跳搭桥手术。4例行单支搭桥,2例行双支搭桥;5支选择左侧胸廓内动脉作为桥血管,右侧3支中2例选择大隐静脉、1例选择桡动脉。
6例患儿手术均顺利进行,术后ICU滞留时间为(5.5±3.0)d,总住院时间为(12.5±3.7)d,术后早期无严重并发症及死亡发生。6例患儿出院后规范服用抗凝药物,2例选择阿司匹林,4例使用阿司匹林联合氯吡格雷。术后随访9~22个月,6例患儿心功能均恢复良好,无临床症状再发生,心电图ST段逐渐恢复正常。心脏彩色超声结果显示,所有患儿冠状动脉血流均保持通畅,病变扩张段冠状动脉最大内径由术前(8.7±4.0)mm缩小至术后(6.4±2.3)mm(P<0.05)。
对于川崎病引起的巨大冠状动脉瘤或存在冠状动脉血栓药物治疗无效者应及时接受外科手术治疗,冠状动脉搭桥手术是安全有效的手术方式,术后早期疗效满意。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
川崎病又称黏膜皮肤淋巴结综合征,是儿童时期以急性发热、皮肤黏膜病损和淋巴结肿大为主要临床表现的全身性血管炎,病因尚不明确。川崎病好发于亚裔人群,其中5岁以内约80%;约15%~25%未经治疗以及3%~5%药物治疗后的川崎病患儿后期会出现冠状动脉扩张(coronary artery ectasia,CAE)或形成动脉瘤,其主要累及部位以左前降支最为多见,其次为左回旋支,罕见孤立的远端动脉瘤[1,2]。冠状动脉瘤(coronary artery aneurysm,CAA)多在发病后第2周出现,第3~8周发展至最大。经过严格抗凝治疗,约半数患儿冠状动脉瘤可在6个月至2年内消散,1/4患儿冠状动脉瘤有所缩小;但仍有1/4患儿对于药物治疗并不敏感,CAA进展严重者后期瘤内形成血栓导致冠状动脉狭窄,影响心肌供血及心功能状况[3]。众所周知,冠状动脉搭桥术(coronary artery bypass graft,CABG)是治疗CAA的有效手段,但其在儿童川崎病并发CAA治疗中的应用国内鲜有报道。2018年3月至2019年8月上海儿童医学中心心胸外科对6例川崎病合并CAA患儿实施CABG,早期随访治疗效果良好,现做回顾性报道。
纳入标准:①明确诊断川崎病,存在胸闷气促、活动耐量下降等症状,且经过长期药物治疗心功能无明显改善;②心脏彩色超声检查显示冠状动脉瘤体最大直径大于8 mm,或瘤内形成血栓造成冠状动脉狭窄;③累及2支以上冠状动脉分支,心电图检查出现明显心肌缺血改变;④心导管检查提示CAA狭窄远端冠状动脉灌注不足。
排除标准:①先天性冠状动脉瘤及冠状动脉狭窄;②川崎病尚未接受规范内科药物治疗。
最终有6例患儿纳入本次研究。其中,男5例,女1例;年龄为(148.7±29.0)个月,范围在106~203个月;体重为(47.9±15.5)kg,范围在27.5~76 kg。所有患儿均明确诊断为川崎病,术前长期接受药物治疗,治疗药物包括丙种球蛋白、糖皮质激素、阿司匹林、华法林、双嘧达莫等,治疗平均时长为5.7年,范围在3个月至10年。6例患儿病程中出现不同程度心功能不全表现(1例心功能Ⅱ级,4例心功能Ⅲ级及1例心功能Ⅳ级),临床症状包括胸闷气促、活动耐量下降等,5例患儿心电图检查提示ST段改变。心脏彩色超声及心脏CT检查结果提示冠状动脉进行性扩张,形成巨大动脉瘤(图1),部分瘤内生成血栓影响冠状动脉血液流速。心脏彩色超声CAA诊断标准:CAE是指心外膜下冠状动脉的局限性或弥漫性扩张,超过邻近正常血管的1.5倍,若大于2倍则称为CAA或瘤样扩张[2]。本次研究中4例为单发巨大CAA,2例为多发串珠样CAA;单侧CAA1例,双侧CAA5例;其中3例合并瘤内血栓,1例合并室壁瘤。
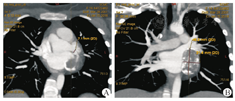

血流心肌梗死溶栓治疗(thrombolysis in myocardial infarction,TIMI)分级标准为:①0级:无灌注,即血管闭塞远端无前向血流;②Ⅰ级:渗透而无灌注,即造影剂部分通过闭塞部位,但不能充盈远端血管;③Ⅱ级:部分灌注,即造影剂可完全充盈冠状动脉远端,但造影剂充盈及清除的速度较正常冠状动脉延缓;④Ⅲ级:完全灌注,即造影剂完全、迅速充盈远端血管并迅速清除。本研究中有4例患儿术前行心导管检查,结果显示CAA远端血流TIMI分级为0级3例、Ⅰ级1例。
本研究已获得上海交通大学医学院附属上海儿童医学中心伦理委员会批准(SCMCIRB-W2020033),患儿家属均签署知情同意书。
CABG可以选择的桥血管材料包括胸廓内动脉、大隐静脉和桡动脉。①取胸廓内动脉,于胸骨撑开器下推开筋膜,暴露胸廓内动脉,于胸廓内动脉两侧1.5 cm左右切开筋膜,离断细小动脉分支,游离带蒂胸廓内动脉上端至锁骨下动脉起始部,下端至剑突水平,制取合适长度桥血管,血管钳夹闭动脉远端。②取大隐静脉,首先于小腿内侧沿血管走行做切口,分离筋膜暴露大隐静脉,剥离周围细小静脉分支,结扎静脉两端,剪取适宜长度静脉。③取桡动脉,由桡动脉远端搏动处至肘窝中央略偏尺侧纵行切开皮肤,沿桡侧腕屈肌和肱桡肌之间紧贴尺侧打开深筋膜,用牵开器牵开二肌,由中段向两侧逐渐游离合适长度桡动脉。取下的桥血管均先以含淡肝素生理盐水注射检查充盈程度,再以罂粟碱解除痉挛后备用。
所有行CABG患儿在全身麻醉下,取平卧位,采用胸骨正中切口进行手术。对于行左侧冠状动脉搭桥患儿,充分游离合适长度左侧胸廓内动脉,将远端剪成45°切面,纵行剪开左冠状动脉前降支或回旋支狭窄段远端,用7-0缝线行端侧连续吻合,完成桥血管建立。对于行右侧冠状动脉搭桥患儿,截取合适长度桥血管(桡动脉或大隐静脉),首先进行远端吻合,依次剪开桥血管外膜及右冠状动脉狭窄段远端,用7-0缝线行端侧吻合,再利用侧壁钳部分夹闭降主动脉,于主动脉壁做切口,与桥血管近端行端侧吻合,建立新的冠状动脉通路。
本研究6例患儿中,3例行心脏停跳搭桥术,3例行不停跳搭桥术;4例行单支搭桥,2例行双支搭桥。5支左侧CABG均选择左侧胸廓内动脉作为桥血管连接左冠状动脉狭窄段远端,3支右侧CABG中2例选择大隐静脉、1例选择桡动脉。术中监测所有患儿桥血管血流均显示波形良好,流速控制在30~60 ml/min,搏动指数(pulsatility index,PI)维持在2.4~3.0。
所有患儿术后均转入心胸外科重症监护室,予呼吸机插管辅助通气,心电监护生命体征,开放静脉实时监测中心静脉压,注意血气及电解质变化。术后予正性肌力药物维持促进心功能恢复,静脉泵入硝酸甘油或口服异乐定扩张冠状动脉;予肝素钠、低分子肝素钙注射液、阿司匹林及华法林等药物抗凝治疗;予磷酸肌酸钠等药物营养心肌;围手术期预防性使用广谱抗生素,并根据术中术后血培养药敏试验结果及时调整抗生素。
术后早期监测血清肌钙蛋白、N端脑钠肽前体等心衰指标,有效评价术后心肌损伤及心功能恢复情况;定期复查心脏彩色超声,观察冠状动脉血流通畅程度及评估心功能;定期复查X线胸片,了解插管位置及肺部情况,予留置胸腔引流管、调整呼吸机参数、机械振动排痰、吸痰、雾化等治疗措施以防止肺不张、气胸等情况的发生。
本组患儿出院后随访节点为术后1个月、3个月、6个月及1年,之后为每年随访一次;随访内容包括心脏彩色超声、心电图、心脏CT检查、心导管检查及心功能评估等。
统计分析采用SPSS19.0统计软件,计量资料以Mean±SD表示,分别对术前术后冠状动脉扩张段内径及左心室射血分数进行t检验。P<0.05为差异有统计学意义。
6例患儿住院期间治疗情况见表1。术后呼吸机插管时间为(28.5±12.7)h,监护室滞留时间为(5.5±3.0)d,复查床边心脏彩色超声检查显示所有患儿桥血管及远端冠状动脉血流通畅,心电图显示ST段均较术前好转,心肌灌注良好。住院期间无患儿发生严重并发症,所有患儿均顺利出院,住院时间为(12.5±3.7)d。患儿出院后均接受抗凝治疗预防桥血管堵塞,治疗方案包括为2例患儿使用阿司匹林(剂量为每天5 mg/kg)抗血小板治疗,4例患儿选择阿司匹林(剂量为每天5 mg/kg)联合氯吡格雷(剂量为每天1 mg/kg)抗血小板治疗,维持凝血功能国际标准化比值为2.0~2.5,口服药物6个月。
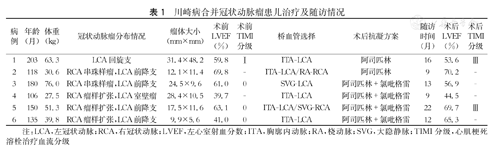
川崎病合并冠状动脉瘤患儿治疗及随访情况
川崎病合并冠状动脉瘤患儿治疗及随访情况
| 病例 | 年龄(月) | 体重(kg) | 冠状动脉瘤分布情况 | 瘤体大小(mm×mm) | 术前LVEF(%) | 术前TIMI分级 | 桥血管选择 | 术后抗凝方案 | 随访时间(月) | 术后LVEF(%) | 术后TIMI分级 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 203 | 63.3 | LCA回旋支 | 31.4×48.2 | 59.8 | Ⅰ | ITA-LCA | 阿司匹林 | 16 | 53.6 | Ⅲ |
| 2 | 118 | 30.6 | RCA串珠样瘤,LCA前降支 | 12.1×11.4 | 69.8 | - | ITA-LCA/RA-RCA | 阿司匹林 | 9 | 70.2 | - |
| 3 | 180 | 76.0 | RCA串珠样瘤,LCA前降支 | 24.5×9.6 | 61.0 | 0 | SVG-LCA | 阿司匹林+氯吡格雷 | 13 | 56.9 | - |
| 4 | 106 | 27.5 | RCA瘤样扩张,LCA室壁瘤 | 28.4×10.5 | 39.7 | - | ITA-LCA | 阿司匹林+氯吡格雷 | 9 | 44.5 | - |
| 5 | 150 | 51.3 | RCA瘤样扩张,LCA前降支 | 17.5×11.6 | 63.1 | 0 | ITA-LCA/SVG-RCA | 阿司匹林+氯吡格雷 | 22 | 69.7 | Ⅲ |
| 6 | 135 | 39.8 | RCA瘤样扩张,LCA前降支 | 9.9×5.6 | 41.0 | 0 | ITA-LCA | 阿司匹林+氯吡格雷 | 12 | 65.3 | - |
注:LCA,左冠状动脉;RCA,右冠状动脉;LVEF,左心室射血分数;ITA,胸廓内动脉;RA,桡动脉;SVG,大隐静脉;TIMI分级,心肌梗死溶栓治疗血流分级
6例患儿术后随访9~22个月,所有患儿最近一次复查心电图结果显示ST段情况较术前明显改善。心脏彩色超声结果显示患儿术后冠状动脉血流通畅,无再狭窄发生,扩张段冠状动脉最大内径由术前(8.7±4.0)mm缩小至术后(6.4±2.3)mm(P<0.05);左心室射血分数由术前(55.7±10.3)%提高至术后(60.0±8.4)%(P>0.05)。2例患儿术后半年复查心导管造影显示桥血管远端冠状动脉血流TIMI分级Ⅲ级(图2)。6例患儿心功能恢复良好,纽约心脏协会(New York Heart Association,NYHA)心功能评级Ⅱ级以上,活动耐量均有明显增加,无胸闷晕厥等症状再发生。
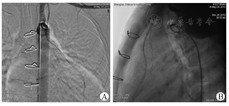

6例患儿术后早期(术后9~22个月)随访心功能均恢复良好,心脏彩色超声检查结果显示,所有桥血管及病变支远端冠状动脉均保持通畅,心肌灌注良好,术后5年桥血管通畅率和生长性还有待进一步随访。
CAA一直以来被认为是川崎病患儿最严重的并发症,其病理表现主要为血管内膜纤维增生、中层纤维板断裂以及血管外壁薄弱膨出。瘤体直径可迅速增长至自体正常冠状动脉内径数倍以上,并发血栓、栓塞以及机化等改变,其中约5%~19%会发展为冠状动脉狭窄,大大增加了急性心肌梗塞甚至猝死的发生率[4,5]。有研究显示,瘤体直径>5 mm的冠状动脉瘤体是发生冠状动脉狭窄的高危因素,瘤体直径>8 mm的巨大冠状动脉瘤远期发生心肌梗塞及心源性猝死的概率高达48%[6,7]。
对于抗凝免疫等药物治疗无效的川崎病合并CAA患儿,目前国内临床中心多采用经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)进行干预,治疗方法包括冠状动脉腔内溶栓术、球囊血管成形术、冠状动脉内支架植入术等。其适应证包括:①有明显心肌缺血的临床症状;②各种负荷试验有心肌缺血表现;③冠状动脉严重狭窄,动脉直径小于原直径四分之一,可能导致严重冠状动脉缺血性病变[8]。介入治疗具有手术创伤小、术后恢复快等优势,术后早期效果良好。但其治疗指征较窄,仅适用于非开口段局限性冠状动脉病变,且由于儿童期生长发育的特殊性,病变处远期仍存在较高的再狭窄风险。近年来,CABG在儿童期CAA的治疗作用越来越引起临床医师的重视,其已被证实是儿童期川崎病合并CAA安全有效的治疗手段[9]。2010年日本一项多中心研究对148例因川崎病合并巨大冠状动脉瘤接受过PCI或CABG治疗的患儿进行中远期(5年以上)随访:两种手术方式术后死亡率无明显差异;CABG术后冠状动脉狭窄再干预率明显低于PCI(P=0.03);多因素分析显示,在12岁以内或存在心肌缺血表现的患儿治疗中,CABG较PCI优势明显[10]。2017年多伦多儿童医院联合多中心研究结果同样证实:儿童川崎病CAA治疗中,CABG术后患儿远期冠状动脉狭窄再干预率明显低于PCI[11]。目前川崎病合并CAA应用CABG治疗的适应证包括:①左冠状动脉主干高度阻塞或多支高度阻塞或左前降支近端高度阻塞,侧支血管处于危险状态;②已有心肌梗塞病史,存在复发高风险,即使单支右冠状动脉病变也应考虑手术;③梗阻血管疏通或已形成侧支后,再次发生心肌缺血;④节段性左室收缩功能不良;⑤药物治疗无效,存在临床症状且心电图检查仍有心肌缺血表现;⑥巨大冠状动脉瘤即瘤体直径>8 mm或某一段血管内径大于4倍邻近血管内径[12,13]。
川崎病合并CAA的外科治疗始于上世纪70年代,1976年Kitamura等[14]首次报道利用大隐静脉为1例川崎病伴前间壁心肌梗塞的4岁患儿行CABG,术后早期血管造影检查显示移植血管开放良好,左室射血分数也明显提高,但大隐静脉生长性较差,术后1年随访显示桥血管已发生堵塞。1988年Kitamura等[15]再次报道利用胸廓内动脉对川崎病患儿行CABG手术,由于胸廓内动脉的结构独特,施行该手术后不会影响儿童躯体生长,且动脉血管本身具有一定生长性,亦能长期保持血管通畅。1994年Kitamura等[16]报道取胃网膜右动脉对右冠状动脉行CABG手术,远期冠状动脉通畅性良好,但胃网膜动脉本身是腹主动脉第四根分支,支流的减少会明显影响儿童日后生长发育,因此不建议胃网膜动脉作为儿童CABG的常规桥血管。2009年日本多中心报道对140例接受CABG治疗的川崎病合并CAA患儿进行中远期(5年以上)随访,结果显示CABG术后20年及25年生存率均能达到95%以上;对比其他血管材料,胸廓内动脉远期通畅性最高(87%),且远期对生长发育影响小,是儿童CABG的最佳桥血管材料[17]。与大隐静脉相比,胸廓内动脉作为血管桥的优势主要包括:①带蒂的胸廓内动脉能根据心肌供血生理需要调节血流量;②胸廓内动脉自身能产生较多前列腺素,能发挥扩张血管和抗血小板聚积的作用;③胸廓内动脉发生粥样硬化机会少,因而远期通畅率高。左侧胸廓内动脉常作为左前降支桥血管的首选材料,右侧胸廓内动脉内径偏细,临床上应用较少,因此对于存在多支冠脉病变的患儿,需与大隐静脉或桡动脉血管桥联合应用。本次研究中1例患儿为单纯左侧巨大冠脉瘤行单支CABG,5例患儿左右两侧双支均存在CAA畸形。5例患儿中2例同时实施双支搭桥,另3例患儿右侧冠状动脉瘤内血流通畅,心肌灌注良好,如果行双支搭桥,桥血管会产生竞争血流,进而影响正常冠状动脉灌注,因此仅行左侧冠状动脉搭桥手术。桥血管选择方面,6支左前降支冠状动脉搭桥中5例患儿选择左侧胸廓内动脉作为桥血管连接冠状动脉狭窄段远端,1例患儿因术中探查左侧胸廓内动脉较细,与左侧冠状动脉远端内径不匹配,考虑患儿年龄(16岁)较大,体重(76 kg)也基本达到成人标准,因此直接选择大隐静脉作为桥血管;2支右侧冠状动脉搭桥中1例选择桡动脉,1例使用大隐静脉。既往考虑到桥血管的远期生长性及通畅性问题,对于小年龄患儿均选择规范药物治疗延缓冠状动脉病变进展,尽量推迟手术年龄,普遍认为CABG手术的最佳年龄是5岁以后。但随着显微镜的应用及外科手术技术的不断提高,目前CABG手术已没有年龄限制,对于病变严重影响心功能的患儿,婴幼儿期也可施行CABG手术。此外,多组临床报道还证实:CABG术在儿童冠状动脉畸形治疗中应用广泛,不仅适用于川崎病合并CAA及冠脉狭窄的治疗,也适用于各种先天性心脏病引起的儿童冠状动脉病变治疗,且手术效果令人满意[18,19,20]。随着手术技术的不断成熟,对于大年龄儿童,越来越多的中心尝试利用不停跳CABG治疗川崎病冠脉异常,手术效果良好,术后随访冠脉通畅率满意[21,22]。
所有作者均声明不存在利益冲突



























