
评估和分析神经母细胞瘤(neuroblastoma,NB)患儿采用危险因素分层治疗的结果。
收集2002年9月至2018年12月中山大学肿瘤防治中心收治的483例采用危险因素分层治疗的初诊为NB患儿的临床资料。其中,男290例[60.0% (290/483)] ,女193例[40.0% (193/483)] ;患儿的中位年龄为3.48岁,年龄范围为7 d至18岁;按国际NB分期系统分期,1期19例,2期25例,3期95例,4期334例,4S期10例。按照年龄、临床分期、病理类型和N-MYC基因状态分为低危、中危和高危组。低危组46例[9.5% (46/483)] ,中危组102例[21.1% (102/483)] ,高危组335例[69.4% (335/483)] 。低危组采用手术+观察或手术+低强度化疗4~6个疗程的治疗方案;中危组采用手术+中等强度化疗6~8个疗程+放疗(按需实施)的治疗方案;高危组2013年前采用"环磷酰胺、长春新碱、吡柔比星"与"顺铂、依托泊苷"方案交替化疗8个疗程+手术+自体造血干细胞移植(autologous hematopoietic stem cell transplantation,ASCT)(按需实施)+放疗+生物治疗(按需实施)+异维甲酸维持治疗1年的治疗方案;2013年后采用"环磷酰胺、长春新碱、吡柔比星"与"依托泊苷、异环磷酰胺、顺铂"方案交替化疗8个疗程+手术+放疗+生物治疗(按需实施)+口服化疗药物维持治疗1年的治疗方案。复发患儿采用再次手术、化疗或放疗等挽救治疗。
全组322例行N-MYC基因检测,N-MYC基因扩增阳性率为22.4% (72/322),高危组N-MYC基因扩增阳性率为33.8%(72/213)。高危患儿行ASCT仅15例,占4.5%(15/335 )。中位随访时间为38.1个月,范围在2.5~208.0个月。低危组3年无事件生存率(event free survival,EFS)和总生存率(overall survival,OS)分别为(86.5±5.1)%和100%,中危组为(79.1±4.3)%和(89.2±3.3)%,高危组为(30.6±2.7)%和(60.3±2.9)%。335例高危组单因素和多因素生存分析显示,临床分期4期、单纯化疗和(或)腹部原发病灶是影响EFS和OS的独立不良预后因素(P均<0.05)。N-MYC基因扩增阳性和阴性的高危患儿3年EFS为(27.4±6.3)%和(36.7±4.4)%,组间比较差异有统计学意义(P=0.049)。N-MYC基因扩增阳性的4期高危患儿3年EFS为(18.7±6.7)%,N-MYC基因扩增阳性的3期和4S期高危患儿,3年EFS为(49.4±13.1)%,组间比较差异有统计学意义(P=0.009)。未行ASCT治疗的完全缓解或部分缓解的高危患儿,口服异维甲酸维持治疗,3年EFS为(28.0±5.1)%,而口服化疗药物维持治疗,3年EFS为(42.1±5.1)%,组间比较差异有统计学意义(P=0.019)。采用化疗+手术+放疗治疗模式的高危患儿,3年EFS为37.1 %;采用化疗+手术治疗模式的高危患儿,3年EFS为19.0%;单纯化疗的高危患儿,3年EFS为7.7%,组间比较差异有统计学意义(P<0.001)。2013年前后高危组3年EFS为(21.5±4.1)%和(34.9±3.6)%,组间比较差异有统计学意义(P=0.004);3年OS为(47.7±4.9)%和(66.7±3.6)%,组间比较差异有统计学意义(P<0.001 )。
采用危险因素分层治疗低危和中危NB患儿生存率高,高危患儿预后仍差,还需要探索新的治疗方式。复发患儿挽救治疗仍可有生存获益。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
神经母细胞瘤(neuroblastoma,NB)是好发于儿童的恶性实体肿瘤,主要起源于肾上腺髓质、椎旁和主动脉旁交感神经系统胚胎神经嵴细胞。NB异质性强,年龄1岁以下的部分患儿肿瘤可自行消退[1,2]。高危患儿接受积极治疗,生存率仍低。美国和欧洲等发达国家根据NB患儿年龄、临床分期、病理类型、N-MYC基因状态、染色体核型和DNA倍体等危险因素,对NB采用危险分层治疗。对于低危患儿,治疗方式为单纯手术或者观察或者手术+低强度化疗,对于中危患儿,治疗方式为手术+中等强度化疗+放疗(按需实施),而对于高危患儿,治疗方式为化疗+手术+自体造血干细胞移植(autologous hematopoietic stem cell transplantation,ASCT)+放疗+抗GD2单克隆抗体+异维甲酸维持治疗。目前发达国家低危NB患儿5年无事件生存率(event free survival,EFS)>95%,中危患儿5年EFS为80%~90%,高危患儿5年EFS为50%~60%[3,4,5,6]。然而,中国NB危险分层因素有待完善。而且,我国2020年前无抗GD2单克隆抗体可应用,高危患儿缺乏抗GD2单克隆抗体免疫治疗,生存率低于国外发达国家[7]。本文分析中山大学肿瘤防治中心2002年9月至2018年12月收治的初诊NB患儿的临床特点,按年龄、临床分期、病理亚型和N-MYC基因状态4种危险因素将患儿分为低危、中危和高危组,评估采用不同强度治疗的结果,探索新的治疗策略。
收集中山大学肿瘤防治中心收治的初诊为NB患儿的临床资料和随访信息。纳入标准:①初诊患儿;②病理确诊为NB ;③年龄≤18岁;④获得监护人或本人知情同意;⑤有较完整治疗和随访资料。排除标准:不符合纳入标准中的任何一项。最终纳入483例NB患儿。其中,男290例(60.0%),女193例(40.0%);患儿的中位年龄为3.48岁,年龄范围为7 d至18岁;按国际NB分期系统分期,1期19例,2期25例,3期95例,4期334例,4S期10例[8]。采用FISH方法对肿瘤组织进行N-MYC癌基因检测,拷贝数≥10为扩增阳性[9]。以美国儿童肿瘤协会(Children’s Oncology Group,COG)神经母细胞瘤的危险分层为基础[2,3,4,10,11],根据患儿年龄、临床分期、病理分类、N-MYC基因状态,将患儿分为低危组、中危组和高危组,分层方法见表1。最终低危组46例(9.5%),中危组102例(21.1%),高危组335例(69.4%)。不同危险分组采用不同强度治疗。患儿肿瘤的原发部位分别为肾上腺249例(51.6%)、腹膜后149例(30.8%),纵隔61例(12.6%)、盆腔12例(2.5%),颈部12例(2.5%)。322例(66.7%,322/483)行N-MYC癌基因检测,其中阳性72例(22.4%,72/322),阴性250例(77.6%,250/322)。
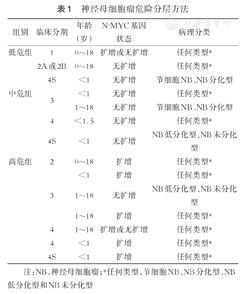
神经母细胞瘤危险分层方法
神经母细胞瘤危险分层方法
| 组别 | 临床分期 | 年龄(岁) | N-MYC基因状态 | 病理分类 |
|---|---|---|---|---|
| 低危组 | 1 | 0~18 | 扩增或无扩增 | 任何类型* |
| 2A或2B | 0~18 | 无扩增 | 任何类型* | |
| 4S | <1 | 无扩增 | 节细胞NB、NB分化型 | |
| 中危组 | 3 | <1 | 无扩增 | 任何类型* |
| 1~18 | 无扩增 | 节细胞NB、NB分化型 | ||
| 4 | <1.5 | 无扩增 | 任何类型* | |
| 4S | <1 | 无扩增 | NB低分化型、NB未分化型 | |
| 高危组 | 2 | 0~18 | 扩增 | 任何类型* |
| <1 | 扩增 | 任何类型* | ||
| 3 | 1~18 | 无扩增 | NB低分化型、NB未分化型 | |
| 1~18 | 扩增 | 任何类型* | ||
| 4 | 1~18 | 扩增或无扩增 | 任何类型* | |
| 4 | <1 | 扩增 | 任何类型* | |
| 4S | <1 | 扩增 | 任何类型* |
注:NB,神经母细胞瘤;*任何类型,节细胞NB、NB分化型、NB低分化型和NB未分化型
本研究采用门诊、电话、信件方式随访至2019年12月31日。本研究已通过中山大学肿瘤防治中心伦理委员会批准(B2020-094-01)。
低危组的治疗策略有3种,分别为①观察或单纯手术;②手术+化疗;③单纯化疗。化疗方案分为CV方案、EP方案和CAV方案。CV方案为第1天,静脉滴注环磷酰胺800 mg/m2 ,静脉注射长春新碱1.5 mg/m2。EP方案为第1~5天,每天静脉滴注依托泊苷100 mg/m2,静脉滴注顺铂20 mg/m2。CAV方案为第1天,静脉滴注环磷酰胺800 mg/m2,静脉注射吡柔比星50 mg/m2、长春新碱1.5 mg/m2。治疗时CV与EP方案交替或EP与CAV方案交替应用,每3周重复,共4~6个疗程。
中危组的治疗策略为化疗+手术+放疗(21~30 Gy,按需实施)。化疗方案分为EP方案和CAV方案。EP方案与低危组EP方案相同。CAV方案为第1天静脉滴注环磷酰胺1.2~1.5 g/m2,于使用环磷酰胺后0 h、4 h、8 h分别静脉注射美斯钠400~500 mg/m2解毒,静脉注射吡柔比星50 mg/m2,静脉注射长春新碱1.5 mg/m2。CAV与EP方案交替应用,每3周重复,共6~8个疗程。
2013年前,高危组的治疗策略为化疗+手术+ASCT(按需实施)+放疗(21~30 Gy)+生物治疗(按需实施)+异维甲酸维持治疗。化疗方案分为EP方案和CAV方案。EP方案与低危组EP方案相同。CAV方案为第1天静脉滴注环磷酰胺1.5 g/m2,于使用环磷酰胺后0 h、4 h、8 h分别静脉注射美斯钠500 mg/m2解毒,静脉注射吡柔比星50 mg/m2,静脉注射长春新碱1.5 mg/m2。CAV与EP方案交替应用,每3周重复,共8个疗程。此时的生物治疗为α-干扰素皮下注射或白细胞介素-2皮下注射(按需使用)或细胞因子诱导的杀伤细胞(或树突状细胞-细胞因子诱导的杀伤细胞或NK细胞或半相合供者免疫细胞)静脉输注。异维甲酸维持治疗为每天口服异维甲酸100~160 mg/m2,服用7 d,停7 d,持续1年。
2013年后,高危组的治疗策略为化疗+手术+放疗(21~30 Gy)+生物治疗(按需实施)+口服节拍化疗药物维持。化疗方案分为CAV方案和VIP方案。CAV方案为第1~2天每天静脉滴注环磷酰胺1 g/m2,于使用环磷酰胺后0 h、4 h、8 h分别静脉注射美斯钠330 mg/m2解毒,第1天静脉注射吡柔比星50 mg/m2,静脉注射长春新碱1.5 mg/m2。VIP方案为第1~4天每天静脉滴注依托泊苷100 mg/m2,静脉滴注异环磷酰胺1.5 g/m2,于使用异环磷酰胺后0 h、4 h、8 h分别静脉注射美斯钠300 mg/m2解毒,静脉滴注顺铂20~25 mg/m2。CAV与VIP方案交替,每3周重复,共8个疗程。此时的生物治疗为半相合供者免疫细胞输注、神经节苷脂-嵌合抗原受体T细胞或抗GD2抗体免疫治疗。口服节拍药物维持治疗为口服环磷酰胺、长春瑞滨、依托泊苷和(或)拓泊替康和西乐葆持续1年。
复发患儿根据个体不同情况进行个体化的挽救性治疗。选择挽救性化疗方案化疗或联合应用阿帕替尼、安罗替尼等靶向药物。若挽救化疗后复发转移的肿瘤病灶缩小,有机会手术切除,则对复发灶或转移灶行手术治疗,并根据患儿情况选择是否放疗。
参照实体肿瘤疗效评估标准(response evaluation criteria of solid tumors,RECIST)进行疗效评估,分为:完全缓解(complete response,CR)、部分缓解(partial response,PR)、进展(progression disease,PD)、稳定(stable disease,SD)、复发。
应用SPSS22.0统计软件对临床特点和生存资料进行分析。符合正态分布的计量资料用 ±s表示,不符合正态分布的计量资料用M(范围)表示。两组之间的比较采用连续数据的Student t检验和分类数据的卡方检验。生存数据的描述采用Kaplan-Meier生存分析法,绘制生存曲线。单因素分析采用Log-rank检验进行两两比较。采用多因素Cox比例风险回归分析,评估预测总生存率和EFS的预后价值及计算风险比率。所有统计检验均为双侧检验,P<0.05为差异有统计学意义。总生存时间(overall survival,OS)定义为从治疗开始至末次随访时间或者死亡时间。无事件生存时间定义为从治疗开始至疾病进展、复发、第二肿瘤或死亡的时间。
±s表示,不符合正态分布的计量资料用M(范围)表示。两组之间的比较采用连续数据的Student t检验和分类数据的卡方检验。生存数据的描述采用Kaplan-Meier生存分析法,绘制生存曲线。单因素分析采用Log-rank检验进行两两比较。采用多因素Cox比例风险回归分析,评估预测总生存率和EFS的预后价值及计算风险比率。所有统计检验均为双侧检验,P<0.05为差异有统计学意义。总生存时间(overall survival,OS)定义为从治疗开始至末次随访时间或者死亡时间。无事件生存时间定义为从治疗开始至疾病进展、复发、第二肿瘤或死亡的时间。
15例患儿手术后定期观察随访,30例患儿手术后联合化疗,1例患儿仅行化疗。疗效评估为CR38例、PR8例。共6例患儿复发,其中1例是2期患儿手术联合化疗后复发,5例为术后观察的患儿,占低危术后观察患儿的33.3%(5/15)。所有复发患儿挽救治疗后均存活。
36例患儿接受手术和化疗,52例患儿接受手术、化疗和放疗,1例患儿接受化疗和放疗,13例患儿仅化疗治疗。疗效评估为CR45例、PR44例、SD8例、PD5例。全组复发13例,死亡16例。复发13例患儿中,3例为骨转移,1例为骨髓转移,1例为骨和骨髓转移,5例为腹膜后复发,1例为腹膜后复发伴骨髓和骨转移,1例腹膜后复发伴骨髓转移,1例为脑转移。13例复发患儿采用多种挽救性化疗+手术(按需实施)+放疗(按需实施),获得肿瘤缓解、部分缓解和稳定,其中8例患儿反复治疗后肿瘤进展死亡。
213例(63.6% ,213/335)行N-MYC基因检测,阳性72例(33.8%,72/213)。65例患儿接受化疗和手术,239例患儿接受化疗、手术和放疗,31例患儿仅化疗治疗。其中15例(4.5%,15/335)行ASCT。疗效评估为CR104例、PR175例、SD21例、PD35例。综合治疗获得CR或PR且未行ASCT的高危患儿279例,其中118例口服化疗药物,81例口服异维甲酸进行维持治疗,80例患儿采用生物治疗或中药治疗或观察;采用生物治疗57例[39例干扰素+白细胞介素(按需实施),9例半相合供者免疫细胞输注+干扰素,2例细胞因子诱导的NK细胞输注,3例抗神经节苷脂抗体输注,4例神经节苷脂-嵌合抗原受体T细胞免疫疗法治疗]。全组复发139例,死亡160例。
复发139例患儿中,50例骨髓复发,23例骨转移复发,14例骨髓和骨转移复发,6例纵隔和胸膜转移,14脑转移,3例纵隔和骨髓转移,7例远处淋巴结转移,14例腹膜后和(或)盆腔复发转移,8例其他部位多发转移。复发患儿采用多种挽救性化疗+手术(按需实施)+放疗(按需实施)+阿帕替尼(按需实施)等抗血管生成药物等,肿瘤获得缓解或部分缓解或稳定,84例患儿反复治疗后肿瘤进展死亡。
483例患儿中位随访时间为38.1个月,范围在2.5~208.0个月,随访率为93% (452/483),共176例患儿死亡。全部参与研究患儿3年EFS和OS分别为(46.2±2.4)%和(70.3±2.3)%。其中,低危组EFS和OS分别为(86.5±5.1)%和100%,中危组分别为(79.1±4.3)%和(89.2±3.3)%,高危组分别为(30.6±2.7)%和(60.3±2.9)%(图1,图2)。N-MYC基因扩增阳性和阴性的高危患儿,3年EFS分别为(27.4±6.3)%和(36.7±4.4)%,组间比较差异有统计学意义(P=0.049)。N-MYC基因扩增阳性的4期高危患儿,3年EFS为(18.7±6.7)%,N-MYC基因扩增阳性的3期和4S期高危患儿,3年EFS为(49.4±13.1)%,组间比较差异有统计学意义(P=0.009)。采用化疗+手术+放疗治疗模式的高危患儿,3年EFS为37.1%,采用化疗+手术治疗模式的高危患儿,3年EFS为19.0%,单纯化疗的高危患儿,3年EFS为7.7%,组间比较差异有统计学意义(P<0.001)。2013年前后高危组3年EFS分别为(21.5±4.1)%和(34.9±3.6)%,组间比较差异有统计学意义(P=0.004);3年OS分别为(47.7± 4.9)%和(66.7±3.6)%,组间比较差异有统计学意义(P<0.001)。对355例高危组患儿年龄、性别、分期、原发部位、治疗模式进行单因素和多因素生存分析显示,临床分期4期、单纯化疗和(或)腹部原发病灶是影响EFS和OS的不良预后因素(P均<0.05,表2,表3)。
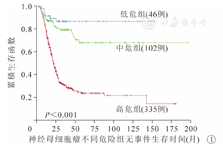

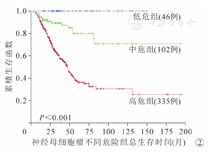

335例高危NB患儿EFS和OS单因素预后分析
335例高危NB患儿EFS和OS单因素预后分析
| 临床特征 | 例(%) | 3年无事件生存率(%, ±s) ±s) | P值 | 3年总生存率(%, ±s) ±s) | P值 | |
|---|---|---|---|---|---|---|
| 年龄 | 0.164 | 0.825 | ||||
| ≤1.5岁 | 29(8.7) | 48.1±10.0 | 65.2±9.6 | |||
| >1.5岁 | 306(91.3) | 29.7±2.8 | 60.1±3.1 | |||
| 性别 | 0.093 | 0.062 | ||||
| 男 | 215(64.2) | 34.1±3.5 | 64.0±3.6 | |||
| 女 | 120(35.8) | 23.4±4.3 | 52.4±5.1 | |||
| 临床分期 | 0.004 | 0.004 | ||||
| 4期 | 310(92.5) | 28.2±2.8 | 57.6±3.1 | |||
| 3期和4S期 | 25(7.5) | 53.1±11.3 | 88.0±8.1 | |||
| 原发病灶 | 0.506 | 0.137 | ||||
| 肾上腺+腹膜后 | 298(89) | 30.2±2.9 | 59.5±3.1 | |||
| 腹部外 | 37(11) | 38.3±8.6 | 63.5±9.8 | |||
| 治疗模式 | <0.001 | <0.001 | ||||
| 化疗 | 31(9.3) | 7.7±5.1 | 12.2±6.3 | |||
| 化疗+手术 | 65(19.4) | 19.3±5.2 | 46.4±6.5 | |||
| 化疗+手术+放疗 | 239(71.3) | 37.2±3.4 | 69.1±3.4 | |||
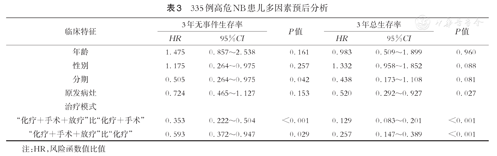
335例高危NB患儿多因素预后分析
335例高危NB患儿多因素预后分析
| 临床特征 | 3年无事件生存率 | P值 | 3年总生存率 | P值 | ||
|---|---|---|---|---|---|---|
| HR | 95%CI | HR | 95%CI | |||
| 年龄 | 1.475 | 0.857~2.538 | 0.161 | 0.983 | 0.509~1.899 | 0.960 |
| 性别 | 1.175 | 0.264~0.975 | 0.257 | 1.332 | 0.958~1.852 | 0.088 |
| 分期 | 0.505 | 0.264~0.975 | 0.042 | 0.438 | 0.173~1.108 | 0.081 |
| 原发病灶治疗模式 | 0.724 | 0.465~1.127 | 0.153 | 0.520 | 0.292~0.927 | 0.027 |
| "化疗+手术+放疗"比"化疗+手术" | 0.353 | 0.222~0.504 | <0.001 | 0.129 | 0.083~0.201 | <0.001 |
| "化疗+手术+放疗"比"化疗" | 0.593 | 0.372~0.947 | 0.029 | 0.257 | 0.147~0.389 | <0.001 |
注:HR,风险函数值比值
未行ASCT治疗的CR或PR的高危患儿,80例口服异维甲酸维持治疗,3年EFS为(28.0± 5.1)%;118例口服化疗药物维持治疗,3年EFS为(42.1±5.1)%,组间比较差异有统计学意义(P= 0.019)。
神经母细胞瘤异质性强,低危、中危和高危NB预后和处理方式有所不同。国外发达国家需要根据年龄、临床分期、病理分类、肿瘤细胞N-MYC基因状态、染色体分子核型和DNA倍体等多种危险因素进行危险分层和治疗,临床分期检查包括间碘苄基胍扫描和骨髓检查。鉴于国内的条件,本组仅是根据年龄、临床分期、病理分类和N-MYC基因状态进行危险分层,而且临床分期仅是根据全身CT或磁共振成像、全身骨扫描和骨髓检查或正电子发射计算机断层显像和骨髓检查评估肿瘤侵犯范围。
本研究低危患儿共46例,15例采用术后观察,30例手术联合低强度化疗4个疗程,1例4S期行单纯化疗,共6例患儿复发,挽救治疗后全部存活,3年EFS为86% ,OS为100%。低危NB采用观察或低强度治疗,可获得极好的生存率。但是,本组术后采用观察的低危患儿复发率为33.3%(5/15),其中2例患儿肿瘤分别位于后纵隔和后腹膜,手术完整切除,术后复查CT未见残留,故本组诊断临床分期为1期。实际上按照国际神经母细胞瘤危险组分期系统进行分期,这2例患儿肿瘤伴有影像学危险因素应该属于L2期,因此不行化疗确有复发的可能。而且15例采用术后观察的患儿中,4例未做N-MYC基因检测,所有患儿未行肿瘤染色体核型分析和DNA倍体检测,这可能是本组低危NB患儿的3年EFS (86.5%)低于国外报道的91%~95%的原因[2,3]。本组中危患儿102例,采用手术+中等强度化疗+放疗,3年EFS为79.1 % ,OS为89.2 %,生存率稍低于发达国家,主要原因可能是部分患儿(28.4%,29/102)未行N-MYC基因检测,所有患儿都没有行染色体核型和DNA倍体检测,可能存在高危患儿未能筛选出来,影响疗效和生存。近年来,本组已经进一步完善和加强了N-MYC基因检测和肿瘤染色体分子核型和DNA倍体检测,提高了危险分层精确度,选择了更加适宜的治疗方案。
本研究高危患儿335例,占全组病例69.4%。采用综合治疗方案,化疗+手术+ASCT(按需实施)+放疗+生物治疗(按需实施)+维持治疗,全组3年EFS和OS分别为30.6%和60.3%。临床4期、单纯化疗和(或)腹部原发病灶是影响高危NB患儿EFS和OS的独立不良预后因素。采用化疗+手术+放疗治疗模式优于采用化疗+手术或单纯化疗患儿,提示尽管是高危转移患儿,手术和放疗等局部治疗仍然非常重要,可以改善晚期转移NB的生存率。
ASCT是高危NB的一项巩固治疗选择,然而,移植后仍有相当多患儿复发。国外研究报道高危NB患儿行ASCT可以改善EFS,但是OS无改善[10,11]。欧洲一项高危NB患儿行ASCT随机临床研究显示,高危NB采用美法仑+白消安预处理方案,生存率优于采用卡铂+依托泊苷+美法仑预处理方案[12]。本研究仅15例高危患儿行ASCT,采用卡铂+依托泊苷+美法仑预处理方案,大部分患儿(11例)最终复发死亡,当然,移植病例数太少,不具有可比性。近年来国内外不少研究探讨进行二次ASCT治疗高危NB,二次自体移植EFS似乎优于单次自体移植,但目前仍需要临床研究进一步验证其疗效[13]。美国一项研究显示,采用抗GD2抗体治疗的高危NB患儿不做ASCT,与行ASCT高危NB患儿相比较生存率无差别,提示高危NB采用抗GD2抗体治疗可能不需要行ASCT[14]。目前发达国家高危NB患儿综合治疗结束后行抗GD2抗体免疫治疗,生存率可提高至50~60%[5,6]。此前国内无抗GD2抗体,本组的高危患儿治疗结束后共有57例患儿进行生物免疫治疗,这些生物治疗大部分是非特异性免疫治疗,故仍有33例复发。2015年抗GD2抗体地诺妥昔单抗获美国食品药品监督管理局批准用于高危NB一线巩固维持治疗。最近1年国内也获得抗GD2抗体的初步应用,将有可能改善中国高危NB生存率。
N-MYC基因扩增阳性是NB预后差的重要生物学标志。N-MYC癌基因位于染色体2p24位点,此基因扩增与肿瘤迅速进展和疾病晚期相关[9,15,16]。国外报道大约16%~25% NB患儿存在N-MYC基因扩增,高危患儿40%~50%伴有N-MYC基因扩增[17,18]。来自美国COG、德国、国际儿童肿瘤协会神经母细胞瘤研究组等国际合作组织8 800例NB研究报道,存在N-MYC基因扩增的高危NB患儿中,临床分期4期患儿的预后比非4期患儿差[19]。本研究213例高危NB患儿N-MYC基因扩增阳性率为33.8%(72/213)。72例N-MYC扩增阳性患儿中,3期和4S期患儿3年EFS优于4期患儿(P=0.009)。本组的研究结果与国际上报道的结果接近[19]。
高危NB患儿治疗中,异维甲酸主要作用机制是诱导NB分化。美国COG对高危患儿进行了ASCT后行异维甲酸维持治疗的随机研究,结果显示使用异维甲酸维持治疗的患儿5年EFS (42%)优于不用异维甲酸维持治疗的患儿(31%),但差异无统计学意义(P=0.12)[10]。本组在2013年前所有高危NB治疗结束后采用异维甲酸口服维持1年。但是高危NB患儿复发率仍然高。2013年后逐渐改为低剂量口服节拍化疗药物维持治疗1年,主要化疗药物是环磷酰胺、长春瑞滨、依托泊苷和(或)拓泊替康和西乐葆等交替口服节拍化疗,节拍治疗的主要作用机制是抗肿瘤血管生成,抑制肿瘤生长[20]。本研究199例未行ASCT的高危NB患儿,综合治疗后获得CR或PR的患儿口服药物进行维持治疗,其中81例口服异维甲酸,118例口服节拍化疗药物。结果显示,口服化疗药物维持治疗的患儿,3年EFS优于口服异维甲酸维持治疗(P=0.019)。但是,需要进一步随机研究证实。
本组2013年前后对高危NB患儿治疗策略和方案做了调整,主要在诱导化疗方案、自体造血干细胞移植、维持治疗和复发进展后挽救化疗方案等方面。复发后患儿有更多的化疗方案和更多新的药物可供选择进行挽救治疗。本组结果显示2013年后高危患儿3年EFS和OS均优于2013年前,提示加强诱导治疗强度、手术全切或大部分切除原发病灶同时联合放疗、口服化疗节拍药物维持治疗可能对改善高危患儿生存率有一定影响。但是,本研究是回顾性分析,并非随机研究,将来可考虑进一步随机研究证实此结果。
本研究高危患儿3年OS为60.3%,主要原因是不少患儿复发后仍积极进行化疗+手术+放疗等挽救治疗,并获得再次缓解。本组根据患儿初诊治疗的情况,采用以往未用过的化疗药物重新组合或者继续采用以往有效化疗药物,大部分复发患儿可获得好转,骨髓完全缓解或者复发灶手术切除或者给予放疗,都能有效的再次控制肿瘤。有些患儿出现再次复发,反复治疗,通过挽救治疗可控制肿瘤、带瘤生存、延长生存时间(5~10年)。提示复发患儿积极进行挽救治疗,仍然可以有生存获益。
本研究初步阐明基于年龄、临床分期、病理分类和N-MYC基因状态四种危险因素基本上可以区分低危、中危和高危NB。低危采用观察或低强度化疗获得极好生存率,中危患儿采用中等强度治疗也可获得很好的生存。但是,高危患儿预后较差,N-MYC基因扩增阳性高危患儿预后更差。高危患儿采用化疗+手术+放疗治疗模式优于化疗+手术或单纯化疗。未行ASCT的高危患儿综合治疗后,采用口服节拍化疗药物维持治疗生存率优于口服异维甲酸。下一步需要加入更多的有价值的生物标志物进行更精准的危险分层治疗,尤其是探讨更有效的高危患儿治疗方法,进一步改善生存率。



























