
探讨小儿脂肪瘤型脊髓栓系综合征(tethered cord syndrome,TCS)术后远期神经功能随访情况。
收集广西医科大学第一附属医院2005年1月至2012年12月收治的141例脂肪瘤型TCS患儿的临床资料,其中男53例,女88例,手术时年龄范围为1个月至11岁11个月。根据患儿术前有无神经损害症状,将所有患儿分为无症状TCS组(无症状组)47例和有症状TCS组(有症状组)94例,两组患儿的手术均由同一主刀医生完成,手术方法均为在硬膜囊内切除脂肪瘤,松解脊髓和神经根的基础上,继续探查硬膜外腔,松解穿出硬膜的神经根,游离骶囊,离断外终丝。对所有患儿进行8年以上的随访,采用Hoffman神经功能分级及疗效判断将术后与术前情况相比较。
无症状组的手术时间为(164. 14±25. 32)min;术后出现脑脊液漏2例,皮下积液1例,再栓系2例,需留置导尿管或行间歇性清洁导尿(clean intermittent catheterization,CIC)8例,需借助工具行走或轮椅2例;术后神经功能稳定27例[57. 4%(27/47)],加重20例[42. 6%(20/47)],总有效率为57. 4%(27/47)。有症状组的手术时间为(175. 08±30. 61) min,术后出现脑脊液漏3例,皮下积液3例,再栓系5例,需留置导尿管或CIC 29例,需借助工具行走或轮椅11例;术后神经功能显效10例[10. 6%(10/94),有效24例[25. 5%(24/94)],稳定37例[39. 4%(37/94)],加重23例[24. 5%(23/94)],总有效率为75. 5% (71/94)。
远期随访对脂肪瘤型TCS患儿术后神经功能恢复评价更客观、真实,无症状脂肪瘤型TCS患儿应早期行预防性手术,避免神经功能障碍,部分患儿术后远期生活质量较差,应重视术后身体和生理的康复治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脂肪瘤型脊髓栓系综合征(tethered cord syndrome,TCS)是小儿脊髓栓系最常见的类型,病理表现复杂、多样,部分患儿神经损害程度重,手术困难且效果不佳,术后仍存在较为严重的神经功能障碍[1,2,3]。目前大多数报道主要为围手术期或较短期的术后随访,和成年患者存在的区别在于绝大部分患儿术后都处于生长发育期,神经系统也存在持续的发育,手术松解远期的效果、神经功能的发展和结局值得深入探讨。现将广西医科大学第一附属医院收治的脂肪瘤型TCS患儿术后8年以上的远期随访情况汇报如下。
收集本院在2005年1月至2012年12月收治的141例脂肪瘤型TCS患儿的临床资料。其中,男53例,女88例,手术时年龄范围为1个月至11岁11个月。根据术前有无神经损害症状,分为无症状TCS组(无症状组)47例和有症状TCS组(有症状组)94例。病理分型为背侧型、腹侧型、混合型和脂肪脊髓脊膜膨出这4种类型[4]。
本研究患儿纳入标准:①手术均由同一主刀医生完成;②术后随访时间≥8年,能配合完善体格检查、实验室、影像学等相关检查,资料详细完整。排除标准:①终丝脂肪变性TCS及其他非脂肪瘤型TCS;②不能配合完善检查的患儿;③存在其他因素导致的身体机能障碍。
本研究已获得患儿家长知情同意,并通过广西医科大学第一附属医院伦理委员会批准,批件号:2021 (KY-E-049)。
采用硬膜内外腔联合松解术,取骶尾部皮肤包块纵向或横向梭形切口,依次切开皮肤及皮下组织,沿脂肪瘤体游离至腰背筋膜缺损处,向瘤体近、远端适当打开椎板,完整暴露病变组织,打开硬膜囊并切除脂肪瘤,松解脊髓和神经根,离断内终丝,裁剪硬膜,重建蛛网膜下腔,然后继续松解硬膜外腔,松解穿出硬膜的神经根,游离骶囊,离断外终丝[5]。
采用Hoffman神经功能分级[6]及疗效判断将术后与术前情况相对比。
Hoffman神经功能分级:①0级,无明显神经功能性能障碍,包括畸形和排尿的改变,可伴有反射的改变和(或)感觉缺失;②1级,轻微的肌无力和(或)只影响一侧下肢的畸形,无明显步态异常,膀胱和肛门括约肌功能正常;③2级,单纯的神经源性膀胱或一侧肢体肌无力,或膀胱功能完整但有轻微的双侧下肢肌无力;④3级,中到重度的一侧下肢无力,步态异常,伴或不伴有神经源性膀胱,或轻微的双下肢无力伴神经源性膀胱;⑤4级,严重的肌无力,需辅助行走,伴或不伴有神经源性膀胱;⑥5级,不能行走。
将手术疗效分为加重、稳定、有效和显效4个等级,包括:①加重,术后即出现神经功能障碍,或在维持原症状的基础上又出现新的病变,且观察6个月以上,不能恢复;②稳定,症状及体征无变化;③有效,可部分控尿,术后下肢感觉及运动功能在一定程度上恢复,会阴部感觉及直肠功能改善;④显效,下肢感觉及运动、直肠和膀胱功能障碍完全恢复。总有效率=显效率+有效率+稳定率[5]。
本研究所有患儿均在门诊进行随访。随访内容:①膀胱功能包括排尿次数、尿量、尿线、是否需要留置导尿管或行间歇性清洁导尿(clean intermittent catheterization,CIC);②直肠功能包括肛周收缩力量、排便次数、便秘、失禁、污粪;③会阴部感觉;④下肢外观是否存在畸形及肌力情况。门诊检查内容包括泌尿系统B型超声检查、尿流动力学检查、直肠肛管测压、放射性核素肾脏显像。
应用SPSS 22.0软件进行数据处理,正态分布计量资料采用 ±s表示,偏态分布计量资料采用M(Q1,Q3)表示,两组间样本均数比较采用t检验,非正态分布资料比较采用秩和检验,两组间样本率比较采用χ2检验,P<0. 05为有差异具有统计学意义。
±s表示,偏态分布计量资料采用M(Q1,Q3)表示,两组间样本均数比较采用t检验,非正态分布资料比较采用秩和检验,两组间样本率比较采用χ2检验,P<0. 05为有差异具有统计学意义。
所有患儿手术均顺利完成,术后随访时间≥8年。
无症状组的手术时间为(164. 14±25. 32)min,有症状组的手术时间为(175. 08±30. 61)min,两组间的差异具有统计学意义(P<0. 001)。两组患儿的一般资料、手术年龄、时间和术后随访情况比较见表1。
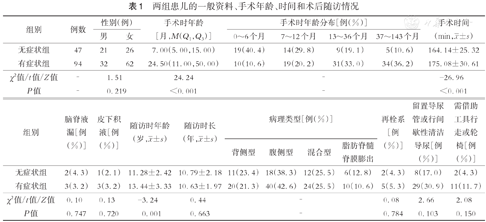
两组患儿的一般资料、手术年龄、时间和术后随访情况
两组患儿的一般资料、手术年龄、时间和术后随访情况
| 组别 | 例数 | 性别(例) | 手术时年龄[月,M(Q1,Q3)] | 手术时年龄分布[例(%)] | 手术时间(min, ±s) ±s) | ||||
|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | 0~6个月 | 7~12个月 | 13~36个月 | 37~143个月 | ||||
| 无症状组 | 47 | 21 | 26 | 7. 00(5. 00,15. 00) | 19(40. 4) | 14(29. 8) | 9(19. 1) | 5(10. 6) | 164. 14±25. 32 |
| 有症状组 | 94 | 32 | 62 | 24. 50(11. 00,50. 00) | 10(10. 6) | 19(20. 2) | 31(33. 0) | 34(36. 2) | 175. 08±30. 61 |
| χ2值/t值/Z值 | - | 1. 51 | 24. 24 | - | -26. 96 | ||||
| P值 | - | 0. 219 | <0. 001 | - | <0. 001 | ||||
| 组别 | 脑脊液漏[例(%)] | 皮下积液[例(%)] | 随访时年龄(岁, ±s) ±s) | 随访时长(年, ±s) ±s) | 病理类型[例(%)] | 再栓系[例(%)] | 留置导尿管或行间歇性清洁导尿[例(%)] | 需借助工具行走或轮椅[例(%)] | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 背侧型 | 腹侧型 | 混合型 | 脂肪脊髓脊膜膨出 | ||||||||
| 无症状组 | 2(4. 3) | 1(2. 1) | 11. 28±2. 42 | 10. 79±2. 18 | 11(23. 4) | 18(38. 3) | 12(25. 5) | 6(12. 8) | 2(4. 3) | 8(17. 0) | 2(4. 3) |
| 有症状组 | 3(3. 2) | 3(3. 2) | 13. 44±3. 33 | 10. 63±1. 97 | 20(21. 3) | 40(42. 6) | 24(25. 5) | 10(10. 6) | 5(5. 3) | 29(30. 9) | 11(11. 7) |
| χ2值/t值/Z值 | 0. 10 | 0. 13 | -3. 24 | 0. 44 | - | 0. 08 | 2. 66 | 2. 08 | |||
| P值 | 0. 747 | 0. 720 | 0. 001 | 0. 663 | - | 0. 784 | 0. 103 | 0. 150 | |||
术后神经功能保持稳定或有效一段时间后,出现新的神经功能损害症状或原神经功能损害症状持续加重,排除术后短期的脊髓神经水肿,结合磁共振成像(magnetic resonance imaging,MRI)检查结果,可诊断再栓系。其中无症状组有2例,有症状组有5例,均行再次松解术,此7例患儿的第一次手术病理类型均为脂肪脊髓脊膜膨出。术后无症状组需留置导尿管或CIC有8例,有症状组有29例。术后无症状组需借助辅助工具行走或轮椅有2例,有症状TCS组有11例(表1)。
无症状组:术前0级47例;术后0级27例,1级3例,2级7例,3级8例,4级2例,5级0例。有症状组:术前0级0例,1级26例,2级35例,3级27例,4级5例,5级1例;术后0级19例,1级12例,2级29例,3级23例,4级10例,5级1例。
无症状组和有症状组术后神经功能疗效情况见表2。

两组术后神经功能疗效情况[例(%)]
两组术后神经功能疗效情况[例(%)]
| 组别 | 例数 | 疗效 | 总有效率 | |||
|---|---|---|---|---|---|---|
| 显效 | 有效 | 稳定 | 加重 | |||
| 无症状组 | 47 | - | - | 27(57. 4) | 20(42. 6) | 27(57. 4) |
| 有症状组 | 94 | 10(10. 6) | 24(25. 5) | 37(39. 4) | 23(24. 5) | 71(75. 5) |
TCS指脊髓末端受到各种因素异常压迫、持续牵拉造成神经功能损害的一系列症候群,先天性脊柱裂是最常见的病因。随着我国医疗卫生的不断发展,人民生活水平进步,就医意识提高,该病的围孕期预防和早期诊断、早期治疗得到极大的普及,故TCS患儿就诊的年龄有越来越小的趋势。由于患儿就诊时年龄分布不一致,年龄大(≥3岁)的患儿体格检查、实验室和影像学检查结果相对稳定,手术前对神经功能损害评估准确、客观,手术后效果容易评估,但患儿年龄越大,神经功能损害的程度往往越重。年龄小(0~3岁)的婴幼儿,因为神经系统的发育不成熟,神经反射、传导未建立,未形成正常排便、排尿生理反射,骨骼肌肉发育不成熟,所以不能对肌力、肌张力、感觉和运动功能进行准确评估。部分神经功能损害轻的患儿可表现为无症状,若脊髓栓系持续存在,神经功能损害加重,则会表现出相关症状,如双下肢不等大、不等长、肌力不一致,马蹄足内翻,B型超声检查显示泌尿系统积水,但这些严重的神经缺陷,手术是无法完全改善的。
与成年患者不同,大部分患儿术后仍处在生长发育期,神经系统也在生长发育,患儿术后的神经功能表现,应该是患儿本身脊髓神经发育缺陷程度、术后患儿脊髓神经后期的发育及代偿水平、手术松解效果的三者综合。Dulfer等[7]对65例TCS病例进行2次纵向随访,随访平均时间分别为4. 6年和11. 2年,发现神经功能缺陷和排尿功能缺陷持续时间长且稳定,但是随着时间进展,部分病例的神经功能和排尿功能却在慢慢地好转。在本研究后期的随访观察中,术前无神经功能损害的患儿,术后神经功能的恢复情况出现了3种类型,分别为:①神经功能正常且稳定;②早期神经功能正常,之后出现神经功能异常,后期神经功能保持稳定;③神经功能持续异常并保持稳定。术前有神经功能损害症状的患儿,术后恢复情况有3种类型,分别为:①神经功能逐渐恢复正常;②神经功能早期持续异常,后期神经功能稳定;③神经功能早期持续异常,此后逐渐好转,达到稳定,但不能达到正常水平。对于上述情况的出现原因考虑如下:患儿就诊时往往年龄小,术前症状、体征不显露或不明显,但存在不同程度的神经发育缺陷,手术松解后,随着年龄增长,神经发育缺陷造成的症状体征逐渐显露出来,部分患儿后期脊髓神经发育代偿,神经功能可部分恢复,但达到一定时间后,神经功能趋于稳定。本研究随访过程中观察到由神经发育缺陷引起的症状,一般在术后第三年达到较稳定的状态,神经发育代偿引起的神经功能变化一般是术后第五年达到稳定。随访时病例的年龄范围为8~21岁,>8岁的病例能够准确说出主观感受,容易配合完成各项体格检查以及尿流动力学、直肠肛管测压等特殊检查。如果随访时间过短,由脊髓神经发育缺陷造成的神经损害症状尚未表现出来,就可能得到手术效果"好"的假象。Hayashi等[8]研究了53例年龄<1岁的无症状脂肪瘤型TCS患儿,施行预防性手术,对其排尿功能进行远期随访观察,平均14. 2年,范围为9. 6~17. 6年,发现18. 9%(10/53)的病例需要进行CIC处理。Fukui等[9]对TCS患儿进行20年以上的随访,研究得出治疗总有效率为72. 2%,与本研究结果相似。
对于无症状TCS患儿的治疗,大多数学者主张预防性手术治疗,比观察等待能使患儿受益更多[10,11,12,13]。Yang等[11]检索了5篇关于无症状脂肪瘤型TCS患儿手术或者保守治疗的文章,收集到408例患儿,其中保守组129例,手术组279例,随访期间,保守组24. 8%(32/129)出现神经功能恶化,手术组10. 8% (30/279)出现神经功能恶化,两组之间的差异具有统计学意义。Wykes等[12]对56例无症状TCS患儿进行保守治疗观察,观察期间28. 6%(16/56)出现神经功能损害症状,观察时间范围为3个月至9. 4年,平均观察时间为1. 9年,并用生存曲线预测10年内将有39. 3%(22/56)的患儿出现神经功能损害症状。日本的一项多中心研究共收集了261例脊髓脂肪瘤的患儿,其中无症状组159例,对136例进行了预防性的手术,随访期间1例出现神经功能损害,随访时间为1个月至5年,平均时间为2. 4年,但未告知纳入研究病例的年龄构成[13]。本研究无症状组术后神经功能总有效率为57. 4%(27/47),有42. 6%(20/47)的患儿出现不同程度的神经功能障碍(其中13例为0~6个月年龄段,6例为7~12个月年龄段,1例为13~36个月年龄段),而有症状组总有效率为75. 5%(71/94),两组总有效率的差异主要考虑为两组患儿手术时年龄构成不一致,无症状组患儿年龄分布集中于0~6个月和7~12个月两个年龄段,而有症状组集中于13~36个月和37~143个月。对于无症状脂肪瘤TCS的治疗,本研究建议积极行早期预防性手术治疗,理由如下:①从TCS的发病机制来看,"栓系"是导致神经功能持续损害的原因,早期神经功能损害但未必有临床症状,待临床症状出现,神经功能损害程度就已经加重;②无症状TCS患儿如进行剧烈、高强度的脊柱过伸或过屈运动,可能会导致脊髓严重损伤的情况发生;③显微外科、神经电生理监测、超声乳化等技术设备的使用使手术技术成熟稳定,不受年龄限制,可将手术副损伤、并发症的发生率降到最低[2,14,15,16]。
TCS患儿术后远期生活质量明显低于正常同龄人群,神经功能损害造成的排尿不能控制、失禁、大便干结、下肢畸形和不能正常行走等对患儿身体和心理的影响是长期和多方面的,如学习、工作和社交等。因此,在不断提高手术技术和更新设备的同时,也要重视术后的康复治疗,这是一个需要儿外科医生、心理医生、学校、家庭和社会积极参与的系统工程。长期规律随访是提高TCS患儿术后生活质量的前提和基础。患儿出院并不意味着治疗的结束,医务人员和家长要建立完整的随访档案,详细记录神经功能变化情况,针对不同年龄段儿童的生理、心理特点,对排尿功能障碍引发的问题采取相应措施,科学指导留置导尿管和CIC,避免出现上尿路积水甚至肾功能损害。对于有下肢畸形和功能障碍的患儿,应在脊髓栓系松解术后半年进行畸形矫正手术,在康复理疗师的科学指导下积极恢复下肢功能,摆脱辅助工具,提高自主行走的能力。重视心理咨询与治疗,良好、正确的心理咨询指导可帮助患儿正视自我,客观正确地对待神经功能障碍,提高对社会环境的适应能力,促进心理健康。
本研究由于病例随访的时间长、跨度大,数据收集困难,仅部分病例能够纵向观察到术后神经功能的变化情况,不能客观反映不同病理类型和年龄TCS患儿真实的神经功能随着时间纵向的改变情况,故在以后的随访中更应注重队列、纵向的对比研究。
所有作者均声明不存在利益冲突



























