
总结儿童胆囊息肉的临床特点和诊治效果,提高对该疾病的认识。
收集首都医科大学附属北京儿童医院2010年1月至2020年12月含"胆囊息肉"诊断的27例住院患儿的资料。其中,男14例,女13例;平均诊断年龄为12. 2岁,范围为2. 2~16. 0岁。根据是否行手术治疗分为手术组(3例)与观察组(24例)。手术组患儿于术后3个月内进行门诊复查,复查内容包括血常规、生化检查和腹部B型超声检查。所有患儿于2021年3月通过电话随访预后,随访内容包括:有无腹痛、腹胀、腹泻、营养不良以及术后症状是否消失。总结儿童胆囊息肉的临床表现、诊疗及预后,探讨手术干预的影响因素。
3例手术组患儿在术前均存在保守治疗无效的腹胀或腹痛症状,1例有家族史,行多次超声检查提示多发息肉(>2枚)或息肉长径≥10 mm,遂行腹腔镜胆囊切除术,术后病理诊断结果提示为胆囊息肉合并慢性胆囊炎。患儿术后症状消失,分别随访3个月、2年10个月和9年6个月,无相关并发症发生。24例观察组患儿均为其他疾病住院期间完善超声检查时发现胆囊息肉。超声检查结果:息肉单发20例,平均长径为4. 0 mm,范围为2. 0~9. 0 mm;息肉多发4例,均为2枚,长径<10 mm。观察组中除1例患儿因车祸伤死亡,余患儿均对胆囊息肉行保守治疗;9例出院后通过超声检查随访,7例息肉无变化,2例息肉消失。
结合家族史对儿童胆囊息肉选择合理的诊治方案。对存在症状且保守治疗无效的患儿行腹腔镜胆囊切除术;对无症状的患儿,通过超声检查定期随访,息肉长径≥10 mm时行胆囊切除术。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胆囊息肉是成人常见的胆囊良性疾病,发病率为0. 3%~12. 3%,其中约5. 0%的"真性"息肉可能进展为胆囊癌[1,2]。胆囊癌发展到晚期,预后较差,目前在成年患者中已根据胆囊息肉的相关危险因素(如息肉长径、年龄等)制定了规范的诊断、治疗及随访指南[3,4]。儿童胆囊息肉罕见,在发病率方面无确切统计数据,截至目前国际报道病例不足70例,国内尚无单独针对该病的大宗病例研究[5,6]。本研究回顾性分析首都医科大学附属北京儿童医院2010年1月至2020年12月采用手术治疗的胆囊息肉患儿的临床资料,并结合同期行保守观察的住院患儿资料,总结该病的临床特点,以进一步明确手术指征,提高诊治水平。
2010年1月至2020年12月首都医科大学附属北京儿童医院收治了含"胆囊息肉"诊断的住院患儿27例。其中,男14例,女13例;平均就诊年龄为12. 2岁,范围为2. 2~16. 0岁。将3例行手术治疗的患儿作为手术组;24例行保守观察的患儿作为观察组。
本研究患儿的纳入标准:①出院诊断含"胆囊息肉";②经2位儿外科医生阅读腹部超声检查报告并确认符合胆囊息肉诊断标准。排除标准:病例资料缺失或不全。胆囊息肉诊断标准:腹部超声检查提示无尾影、不随体位变化而移动的等回声或高回声病灶(图1)[7,8]。
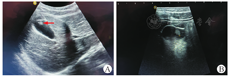

本研究已通过首都医科大学附属北京儿童医院伦理委员会批准(2020-Z-169),并获得患儿家属知情同意。
收集所有患儿的资料,包括:性别、诊断年龄、病史、辅助检查[B型超声、CT或磁共振成像(magnetic resonance imaging,MRI)检查]、息肉情况、治疗方式、病理诊断结果及合并疾病。手术组术后3个月内门诊复查,复查内容包括血常规、生化检查和腹部超声检查。所有患儿于2021年3月通过电话随访预后,随访内容包括:有无腹痛、腹胀、腹泻、营养不良,术后症状是否消失。
患儿,男,14岁9个月,体重为40. 0 kg,因无明显诱因出现腹胀12个月入院,体格检查、血常规、胆红素、肝功能等指标无异常,术前多次超声检查提示胆囊多发息肉,最大息肉的长径为6. 0 mm,保守治疗无效后行腹腔镜胆囊切除术。术后病理诊断为胆汁沉积,局部固有层及黏膜上皮增生,慢性胆囊炎,无胆囊结石。患儿术后症状消失,门诊随访3个月,相关检查结果无异常。术后9年6个月时电话随访,无相关并发症。
患儿,女,11岁1个月,体重为37. 0 kg,因进食后出现右上腹痛2个月入院,体格检查提示上腹部压痛、Murphy征(+),血常规、胆红素、肝功能等指标无异常,术前多次超声检查提示胆囊单发息肉,长径为10. 0 mm,保守治疗无效后行腹腔镜胆囊切除术。术后病理诊断为局部黏膜上皮息肉样增生,慢性胆囊炎,无胆囊结石。患儿术后症状消失,门诊随访3个月,相关检查结果无异常。术后2年10个月时电话随访,无相关并发症。
患儿,女,14岁4个月,体重为47.0 kg,因无明显诱因出现右上腹痛、右后背隐痛11个月入院,进食后伴恶心、呕吐,存在明确家族史。体格检查提示上腹部压痛、Murphy征(+),血常规、胆红素、肝功能等指标无异常,术前多次超声检查提示胆囊单发息肉,长径为10. 0 mm(图1)。完善腹部增强CT检查提示胆囊内稍高密度影,腹部MRI检查提示T2像时胆囊内类圆形低信号影,磁共振胰胆管成像(magnetic resonance cholangiopancreatography,MRCP)检查提示胆囊内类圆形缺损,肝外胆管未见明显异常,保守治疗无效后行腹腔镜胆囊切除术(图2)。术后病理诊断为胆固醇沉积,局部黏膜上皮增生,慢性胆囊炎,无胆囊结石(图3)。患儿术后症状消失。门诊随访3个月,相关检查结果无异常,无相关并发症。
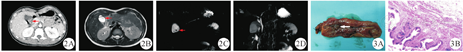

注:MRI,磁共振成像;MRCP,磁共振胰胆管成像
24例患儿均因其他疾病于住院期间完善腹部超声检查时发现存在胆囊息肉。其中83. 3%(20/24)为单发息肉,平均长径为4. 0 mm,范围为2.0~9. 0 mm;16. 7%(4/24)为多发息肉且为2枚,长径均<10 mm。1例患儿因车祸伤死亡,对其他患儿的胆囊息肉均行保守观察。39. 1%(9/23)的患儿出院后行超声检查随访,末次随访与确诊息肉的平均间隔时间为4. 0个月,范围为1.0~26.0个月,7例息肉数量及长径无变化,2例单发息肉消失。截至末次随访,共电话随访21例[91. 3%(21/23)],平均随访时间为32. 4个月,范围为8. 4~113. 2个月,均无肝胆疾病相关症状(表1)。
观察组患儿相关情况
观察组患儿相关情况
| 病例 | 性别 | 诊断年龄 | 相关症状 | 影像学检查 | 息肉情况 | 超声随访 | 超声随访时间 | 末次随访息肉情况 | 合并的主要疾病 | 治疗方式 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 数量(个) | 长径(mm) | ||||||||||
| 1 | 男 | 11岁6个月 | 无 | 超声 | 2 | 7 | 有 | 11个月 | 2枚,长径7 mm | 支周炎、左肾静脉压迫综合征 | 观察 |
| 2 | 女 | 9岁11个月 | 无 | 超声 | 2 | 4 | 无 | - | - | 支原体肺炎 | 观察 |
| 3 | 女 | 2岁2个月 | 无 | 超声 | 2 | 3 | 无 | - | - | 脑疝、创伤性颅内出血 | 死亡 |
| 4 | 男 | 13岁10个月 | 无 | 超声 | 2 | 3 | 无 | - | - | 慢性浅表性胃炎 | 观察 |
| 5 | 男 | 14岁5个月 | 无 | 超声 | 1 | 6 | 无 | - | - | 过敏性紫癜 | 观察 |
| 6 | 女 | 10岁6个月 | 无 | 超声 | 1 | 3 | 有 | 2年2个月 | 1枚,长径4 mm | 癫痫 | 观察 |
| 7 | 女 | 13岁1个月 | 无 | 超声MRI | 1 | 6 | 无 | - | - | 过敏性紫癜 | 观察 |
| 8 | 男 | 5岁8个月 | 无 | 超声 | 1 | 5 | 有 | 1个月 | 消失 | 免疫性血小板减少症 | 观察 |
| 9 | 男 | 13岁7个月 | 无 | 超声 | 1 | 5 | 有 | 3个月 | 1枚,长径5 mm | 过敏性紫癜、左肾静脉压迫综合征 | 观察 |
| 10 | 女 | 6岁7个月 | 无 | 超声 | 1 | 2 | 无 | - | - | 传染性单核细胞增多症 | 观察 |
| 11 | 女 | 12岁3个月 | 无 | 超声 | 1 | 4 | 无 | - | - | 小肠套叠 | 观察 |
| 12 | 男 | 11岁10个月 | 无 | 超声 | 1 | 4 | 有 | 1个月 | 1枚,长径4 mm | 过敏性紫癜 | 观察 |
| 13 | 男 | 15岁5个月 | 无 | 超声 | 1 | 4 | 无 | - | - | 高同型半胱氨酸血症 | 观察 |
| 14 | 女 | 13岁7个月 | 无 | 超声 | 1 | 9 | 无 | - | - | 肠系膜上动脉压迫综合征 | 观察 |
| 15 | 女 | 12岁1个月 | 无 | 超声 | 1 | 3 | 有 | 6个月 | 1枚,长径3 mm | 急性淋巴细胞白血病 | 观察 |
| 16 | 男 | 13岁8个月 | 无 | 超声 | 1 | 5 | 有 | 3个月 | 1枚,长径5 mm | 过敏性紫癜、左肾静脉压迫综合征 | 观察 |
| 17 | 男 | 9岁6个月 | 无 | 超声 | 1 | 3 | 有 | 11个月 | 消失 | 噬血细胞综合征 | 观察 |
| 18 | 男 | 10岁1个月 | 无 | 超声MRI | 1 | 4 | 无 | - | - | 支气管扩张、慢性胆囊炎、慢性胰腺炎 | 观察 |
| 19 | 女 | 15岁11个月 | 无 | 超声 | 1 | 8 | 无 | - | - | 慢性肾脏病、胆囊结石、左肾静脉压迫综合征 | 观察 |
| 20 | 女 | 10岁6个月 | 无 | 超声 | 1 | 4 | 无 | - | - | 浅表性胃炎、食管炎 | 观察 |
| 21 | 男 | 12岁10个月 | 无 | 超声 | 1 | 4 | 无 | - | - | 过敏性紫癜、过敏性紫癜性肾炎、左肾静脉压迫综合征 | 观察 |
| 22 | 男 | 11岁9个月 | 无 | 超声 | 1 | 3 | 有 | 4个月 | 1枚,长径3 mm | 右侧冠状动脉增宽 | 观察 |
| 23 | 女 | 13岁7个月 | 无 | 超声 | 1 | 9 | 无 | - | - | 慢性浅表性胃炎、肠系膜上动脉压迫综合征 | 观察 |
| 24 | 男 | 13岁7个月 | 无 | 超声 | 1 | 3 | 无 | - | - | 风湿性心脏病、高尿酸血症 | 观察 |
注:MRI,磁共振成像
胆囊息肉根据有无继发因素,分为原发性和继发性息肉[7]。原发性息肉根据病理类型的不同,分为"真性"和"假性"息肉[2,5,8]。"真性"息肉包括腺瘤和腺癌,"假性"息肉包括胆固醇息肉、腺肌症和炎性息肉等。腺瘤被认为是长期慢性刺激,引起胆囊壁纤维结缔组织增生,进一步可发展为腺癌[2]。胆固醇息肉被认为是胆囊壁胆固醇异常堆积,导致巨噬细胞浸润,形成黏膜隆起的慢性炎症过程,但具体原因尚不清楚[7,9]。腺肌症被认为与胆囊上皮和平滑肌增生合并炎症相关,一般不会恶变[1,10]。继发性息肉包括异染性脑白质营养不良相关息肉(脑硫脂激活蛋白缺陷致溶酶体内脑硫脂水解受阻,异常沉积于胆囊)、Peutz-Jeghers综合征相关息肉和胰胆管发育畸形相关息肉(胰胆合流异常所致胰液反流引起胆管炎症)[5,11,12]。成年患者随着年龄的增长,"真性"息肉存在胆囊癌变的风险,因而备受关注[2,13]。但儿童胆囊息肉发病率较成人低、多为胆固醇息肉,且目前没有恶变报道,因而关注较少,对其诊断、治疗尚无指南[5,9,14]。
成人胆囊息肉男女发病率相似,但儿童胆囊息肉约80. 0%为女性患儿[5]。本研究中男女比例约为1∶1,这可能与病例报道数量仍较少有关。本研究报道的诊断年龄中位数为12. 2岁,与文献报道一致,学龄期及青春期多见[5,7,15]。本研究中有2例患儿学龄前诊断为胆囊息肉,分别为车祸伤和免疫性血小板减少症的住院患儿,在完善超声检查时发现胆囊息肉,息肉长径≤5 mm,而免疫性血小板减少症患儿随访1个月的超声检查提示息肉消失,考虑为可自行缓解的胆固醇息肉可能性大[4]。与成年患者相似,大多数单纯胆囊息肉患儿无临床症状或表现为非特异性的腹胀,仅少数表现为右上腹隐痛,个别伴有胆绞痛、恶心、呕吐等症状[7,9,16]。无确切证据表明所表现的症状与胆囊息肉本身相关,最有可能还是和慢性胆囊炎症相关[9]。本研究手术组患儿术前均存在症状,术后病理证实合并慢性胆囊炎。当胆囊息肉患儿突然出现胆绞痛,进食后恶心、呕吐等症状,应考虑是否合并胆囊结石或息肉增大阻塞胆管可能,需尽快复查影像学检查以制定诊疗方案[4,5]。
胆囊息肉往往通过腹部超声检查意外发现或胆囊切除术后病理学检查发现[2,4]。超声检查是诊断和随访胆囊息肉的首选方式,不仅能够提示数量和大小,还能够观察胆囊壁的结构[16]。其对于胆囊息肉的诊断具有良好的特异度(71.0%~98.0%)和敏感度(50.0%~90.0%),尤其是对于长径≥10 mm的胆囊息肉[8,17]。而对于长径<10 mm的息肉,则需要超声科医生具有丰富的经验。为尽可能减少误诊,既往研究认为至少行>2次的超声检查才能确诊胆囊息肉[4,5]。随着高分辨超声检查、造影剂辅助超声检查、内镜超声检查等方式的出现,对长径>10 mm息肉的诊断水平进一步提升,但上述方式是否能够提高对长径≤10 mm胆囊息肉的诊断水平,仍需进一步研究[18,19,20]。本研究中,手术组患儿术前均行多次超声检查提示胆囊内等回声或高回声病灶,大小、位置不随患儿体位改变而变化,因而确诊胆囊息肉[8]。本研究观察组超声检查提示息肉长径均<10 mm,且有2例长径≤5 mm的患儿在随访时息肉消失,因而认为对于长径≤5 mm的息肉,"假性"息肉可能性大,可适当延长随访间隔[5]。此外,CT检查在成年患者胆囊息肉的诊断中应用广泛,主要用于评估较大的胆囊息肉以提高早期胆囊癌的检出率[16]。增强CT检查在一定程度上能够提高对长径≤10 mm的胆囊息肉的检出率,但需扩大样本量进一步研究[21]。对于MRI及MRCP检查能否提高胆囊息肉的诊断水平及鉴别息肉性质,存在较大争议。但如本研究所示,在儿童中可以有效除外胰胆管发育畸形等继发因素,同时评估胰腺炎等合并情况[7,22,23]。
根据成人胆囊息肉诊治指南,决定手术干预的主要因素为息肉大小和临床症状[4]。尽管缺乏前瞻性的高质量研究,但回顾性研究发现在成人中,对于长径≥10 mm的胆囊息肉,恶变风险明显升高,建议行胆囊切除术[24,25]。目前儿童研究多沿用成人指南[7,14,15]。与既往研究相似,本研究认为儿童与成人胆囊息肉存在不同:①成人胆囊息肉的治疗重点在于识别和治疗潜在的胆囊恶变,儿童原发性胆囊息肉目前尚无恶变报道,但结合相关文献,仍建议对长径≥10 mm的息肉行胆囊切除术,是否可随访到18岁或待息肉快速增长再行手术干预需进一步研究证明[7,9,14];②对于儿童患者,保守治疗后存在症状是行手术干预的首要指征,其次才是胆囊息肉的大小。本研究手术组中,3例患儿在胆囊切除术前均存在保守治疗无效的腹部症状。1例经超声检查发现胆囊息肉,息肉长径<10 mm,但存在腹胀症状,另2例存在腹痛症状,超声检查发现息肉长径≥10 mm,因而行胆囊切除术。3例患儿术后病理诊断提示均存在黏膜上皮增生,2例符合胆固醇息肉,术后患儿症状均消失,达到了预期手术效果。此外,息肉数量(单发或多发)、息肉形状(是否宽基底)、合并胆囊结石(有或无)、种族(是否印第安血统)、合并原发性硬化性胆管炎(有或无)也是手术干预的影响因素[2]。但在儿童研究中上述因素较少提及[5,7,15]。成人研究表明存在胆囊癌家族史的胆囊息肉成年患者恶变风险显著升高[26,27]。既往儿童研究中家族史等遗传因素极少报道[5,7]。本研究的手术组中,1例存在家族史,家长因担忧可能出现胆囊结石、胆囊穿孔等情况,要求行胆囊切除术。因此,对于儿童患者,应关注家族史,充分考虑患儿及家属意愿,最终决定治疗方案[9]。
结合症状、息肉大小及家族史评估,若患儿选择手术干预,腹腔镜胆囊切除术是目前首选的手术方式[2,5]。本研究中腹腔镜手术均顺利完成。文献报道胆管损伤是成人胆囊切除术最严重的并发症,发生率在腹腔镜手术约为开放手术的2倍[2]。本研究尚未出现此类并发症。成年患者胆囊切除术后40. 0%~50. 0%出现消化功能紊乱相关性腹胀、腹泻等并发症,随着随访时间的增加,症状可逐渐减轻[1,28]。成人胆囊良性疾病专家共识也认为胆囊切除术前应行餐前餐后胆囊功能检查,以评估胆囊切除的可行性,已有少数成人研究报道保留胆囊的息肉切除术[13,29]。但儿童胆囊切除术后出现腹胀、腹泻并发症的报道极少,本研究手术组患儿随访过程也并未出现腹胀和腹泻[30,31,32]。胆囊切除术后出现的腹胀、腹泻主要和术后结肠蠕动功能加快相关,研究报道切除胆囊前无症状、切除时年龄小则提示术后并发症发生率低,同时切除后低脂饮食可降低术后腹胀、腹泻发生率[28,33]。结合近期收治且随访时间为3个月的患儿资料,其术后禁食期间曾出现胆汁样腹泻,恢复低脂饮食后腹泻即消失,后续逐渐恢复正常饮食也未出现腹泻症状,这表明胆囊切除术后机体存在适应机制,但具体机制仍不清楚[28]。若患儿选择保守观察,则可依据成人指南通过超声检查进行观察,当息肉长径≥10 mm、息肉快速增长或出现临床症状时行手术干预[4]。
本研究为回顾性研究,观察组患儿来自各个科室,出院后未进行规律随访,存在一定偏倚,因而无法对保守治疗的儿童胆囊息肉给出合适随访方案。手术组患儿未评估术前胆囊功能对预后的影响,建议开展前瞻性研究进一步分析。但本研究仍为目前国内报道的最大单中心研究,能补充现有病例资料,为后续儿童胆囊息肉规范化的诊疗提供一定依据。
综上所述,对存在症状且保守治疗无效的胆囊息肉患儿,行腹腔镜胆囊切除术,预后良好;对无症状的胆囊息肉患儿,通过超声检查定期随访,当息肉长径≥10 mm时建议行胆囊切除术。同时在儿童胆囊息肉制定治疗方案时,应密切结合家族史。
所有作者均声明不存在利益冲突



























