
探讨儿童积乳囊肿的疾病特征及治疗的经验。
分析2015年3月至2018年12月复旦大学附属儿科医院收治的5例积乳囊肿患儿的年龄、性别、发病部位、影像学特征、临床症状和治疗方案及预后等临床资料。其中,男1例,女4例;中位年龄为16个月,年龄范围为12~24个月。
5例患儿的主要临床症状为单侧乳房无症状增大。B型超声提示局部囊性占位,边界清。磁共振成像提示T2高信号液性占位,与周围组织界限清楚。性激素化验提示卵泡刺激素和催乳素分泌升高。细针穿刺囊肿可见乳汁样液体。3例行乳糜试验2例阳性,1例阴性。5例患儿2例行抽吸治疗,3例行手术完整切除术。随访2~5年,均未见复发及相关并发症。
细针穿刺乳房囊肿获得乳汁样液体是儿童积乳囊肿重要临床诊断依据。除常规手术切除治疗外,女患儿为避免损伤乳腺组织可考虑穿刺抽吸治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
儿童积乳囊肿(galactocele)是一种罕见的良性乳房囊性肿物。积乳囊肿常发生于哺乳后期,乳腺导管阻塞导致分泌液积聚从而形成乳腺囊肿。该病在儿童中发病罕见,国内文献尚未见该病报道,国际上也仅有少数病例报道,临床上对该病认识不足容易造成误诊误治。本研究回顾分析2015年3月至2018年12月复旦大学附属儿科医院收治的5例儿童积乳囊肿的临床资料,总结该病临床特征及初步治疗经验,以提高医生对该病的认识与诊疗水平。
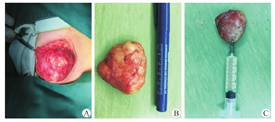
5例患儿中,男1例,女4例,中位年龄为16个月,年龄范围为12~24个月。左侧2例,右侧3例。临床表现主要为一侧乳房增大,无红肿,无疼痛,乳头无塌陷,无分泌物(图1)。就诊时病程持续时间为1~12个月。母孕史、出生史、喂养史无明显异常。母亲孕期产检激素水平未提示异常。生活环境无明显异常。(表1)

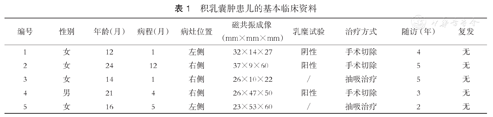
积乳囊肿患儿的基本临床资料
积乳囊肿患儿的基本临床资料
| 编号 | 性别 | 年龄(月) | 病程(月) | 病灶位置 | 磁共振成像(mm×mm×mm) | 乳糜试验 | 治疗方式 | 随访(年) | 复发 |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 女 | 12 | 1 | 左侧 | 32×14×27 | 阴性 | 手术切除 | 4 | 无 |
| 2 | 女 | 24 | 12 | 右侧 | 37×9×60 | 阳性 | 手术切除 | 5 | 无 |
| 3 | 女 | 14 | 1 | 右侧 | 26×10×22 | / | 抽吸治疗 | 5 | 无 |
| 4 | 男 | 21 | 4 | 右侧 | 26×47×50 | 阳性 | 手术切除 | 3 | 无 |
| 5 | 女 | 16 | 5 | 左侧 | 23×53×60 | / | 抽吸治疗 | 2 | 无 |
本研究获得复旦大学附属儿科医院医院伦理委员会的批准(复儿伦审【2021】 287号),并已获得患儿家属知情同意。
病例4未行相关激素水平检查。其余4例检测结果显示卵泡刺激素和催乳素都高于正常值,2例雌激素高于正常值。其中病例5女婴性激素水平明显升高,泌乳素为594.63 μg/L,雌二醇105 ng/L,卵泡刺激素5.82 U/L。所有病例肿瘤标志物、生化指标及血常规等化验未见明显异常。(表2)
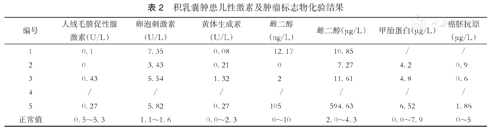
积乳囊肿患儿性激素及肿瘤标志物化验结果
积乳囊肿患儿性激素及肿瘤标志物化验结果
| 编号 | 人绒毛膜促性腺激素(U/L) | 卵泡刺激素(U/L) | 黄体生成素(U/L) | 雌二醇(ng/L) | 雌二醇(μg/L) | 甲胎蛋白(μg/L) | 癌胚抗原(μg/L) |
|---|---|---|---|---|---|---|---|
| 1 | 0.1 | 7.35 | 0.08 | 12.17 | 10.85 | / | / |
| 2 | 0 | 3.43 | 0.21 | 0 | 7.27 | 4.2 | 0.9 |
| 3 | 0.43 | 5.54 | 1.32 | 2 | 11.61 | 4.8 | 0.6 |
| 4 | / | / | / | / | / | / | / |
| 5 | 0.27 | 5.82 | 0.27 | 105 | 594.63 | 6.52 | 1.86 |
| 正常值 | 0.5~5.3 | 1.1~1.6 | 0.0~2.3 | 0~10 | 2.0~4.3 | 0.0~7.9 | 0~5 |
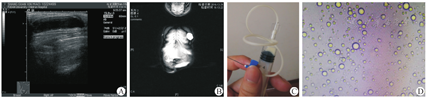
所有病例术前行MRI扫描及B型超声检查,发现乳腺囊性肿块直径为2.5~6.0 cm。B型超声提示肿块边界清楚,低回声囊性占位(图2A)。MRI显示T2高信号,内部信号均匀,与周围组织界限清楚(图2B)。另外行垂体及卵巢检查,未见明显占位。

5例患儿术前细针穿刺明确临床诊断。1例男患儿行囊肿完整切除术,4例女患儿中,2例行手术切除,2例行细针完整抽吸分泌物,随访观察。
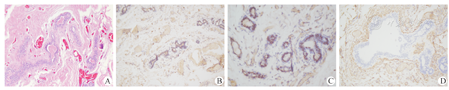
5例患儿术前细针穿刺检查可见乳汁样分泌物(图2C),分泌物予以显微镜下观察可见脂滴样表现(图2D)。3例患儿的分泌物行乳糜试验,其中2例阳性(病例2、4),病例1阴性(表1)。3例患儿行手术切除,术中见包膜完整(图3)。术后病理检查HE染色显示囊形结构,内衬立方上皮,部分上皮细胞胞质空亮并可见顶浆分泌,局部区域可见淋巴细胞、浆细胞、嗜酸性粒细胞浸润(图4A)。其中病例4的免疫组织化学检测提示黄体酮受体(prolactin receptor,PR)表达阳性,雌激素受体(estrogen receptor, ER)表达阳性,CD34表达阳性(图4B-D)。5例患儿术后随访2~5年,均未见复发,也无其他并发症。


积乳囊肿是哺乳期女性的常见疾病,约占乳腺疾病的3.25%~5.12%[1],但发生在儿童身上极其罕见[2]。本课题组查询文献,目前国际上仅31例病例报道[3,4,5,6,7,8,9,10],患儿平均年龄约15个月,其中9例双侧和22例单侧病变,双侧病例占29%,且多为男患儿,仅1~2例女患儿。其中8例有激素水平数据,6例患儿伴有高催乳素血症,为(59.1±67.5)μg/L(共8例)。本组5例都为单侧,1例男患儿,4例女患儿,性别比例与文献报道有较大差异,可能与种族相关。4例催乳素水平检测为(156.1±253.2)μg/L(7.3~594.6 μg/L )。催乳素在不同患儿中检测数值差异较大,其诊断意义有待进一步验证。术前催乳素轻度升高的3例患儿术后基本恢复正常,病例5在术后复查激素仍有轻度升高。
结合文献报道及本组资料,儿童积乳囊肿发病多见于5岁以内,男患儿多于女患儿,单侧乳房病灶为主,肿物大小约3~6 cm,临床上常表现为乳房不对称性增大,无疼痛等不适,体格检查可触及边界较清的囊性肿物,实验室检查可伴有催乳素的升高,临床诊断主要依据针刺活检可见乳汁样分泌物,B型超声及MRI可辅助诊断。治疗上目前以手术切除为主,对于女患儿可尝试抽吸治疗。如诊断明确即可择期手术干预。
Döneray等[10]提出导致男患儿积乳囊肿的3个因素:分泌性乳腺上皮、存在或既往存在催乳素刺激和乳腺导管阻塞。本组病例4虽然没有检测性激素水平,但病理切片提示存在泌乳上皮细胞,且免疫组织化学显示PR和ER表达阳性,提示乳腺上皮细胞的生长和增殖可能与性激素调控相关,支持上述理论。由于男患儿乳房对母体激素的敏感性较低,可能导致乳腺导管空化失败或延迟,导管缺损形成梗阻[4]。此外,新生儿期创伤或炎症、腹部乳糜泻等也被认为是可能原因[5],但本组病例明确无相关病史。
乳糜试验中病例2和病例4呈阳性,病例1呈阴性。乳糜试验假阴性的原因可能是分泌物中脂肪比例过高或者分泌物在体内存在时间过久而被脂肪酶降解[11]。因此,积乳囊肿患儿分泌物乳糜试验结果能否作为临床诊断依据,需要更大样本的验证。目前认为细针穿刺乳房囊肿获得乳汁样液体是较为可靠且方便的临床诊断方法[6],本组病例中手术患儿的最终病理结果也支持该诊断。积乳囊肿必须与乳房大囊型淋巴管畸形区别开来,两者在影像学上表现有一定的相似性,均表现为非特异性的囊性病变[12]。多数情况下可以通过细针穿刺来鉴别,淋巴管畸形可以穿刺得清亮淋巴液。但是也有少数囊性淋巴管畸形分泌乳糜液,如肠道淋巴系统疾病导致淋巴回流压力增加引起乳糜异常反流[13],这种情况下只能依靠术后病理诊断加以鉴别。另外,该病还须与乳房静脉畸形、乳腺纤维腺瘤、正常乳腺发育等区别开来,静脉畸形多穿刺得血性液体,纤维腺瘤多表现为实质性肿物,正常乳腺发育多双侧对称,且无局灶囊性占位,B型超声可辅助鉴别。
由于积乳囊肿是良性病变,对于成年哺乳期的患者,治疗方案包括自然吸收或治疗性细针抽吸、抗生素灌洗,如囊肿持续增大则建议手术切除[14,15]。对于儿童积乳囊肿目前仍以手术切除治疗为主,但对于女患儿为避免损害发育中的乳腺组织可以考虑抽吸术,而男患儿则建议完全切除[5],目前为止,两种治疗方案均未见复发报道[8]。但由于加上本组病例也仅5例患儿接受抽吸治疗,对于抽吸治疗和手术切除疗效的比较需要更大样本和更长随访进一步论证。
所有作者均声明不存在利益冲突



























