
目前对儿童睾丸功能的评估缺乏有效的评估方法。支持细胞是青春期前睾丸组织最活跃的细胞,自胚胎第6周开始,睾丸支持细胞分泌抗米勒管激素(anti-Müllerian hormone,AMH ),在胚胎第十周米勒管完全退化,并在之后的胚胎期和出生后仍维持较高水平,直至青春期AMH水平开始下降,成年男性体内则检测不到。AMH在男性儿童体内的分泌特点,使其可以用来评估青春期前儿童的睾丸功能。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
抗米勒管激素(anti-Müllerian hormone, AMH)也称米勒管抑制激素(Müllerian-inhibiting hormone, MIH),属于转化生长因子-β(transforming growth factor-β,TGF-β)家族中的二聚体糖蛋白,在男性体内主要由未成熟的睾丸支持细胞分泌[1]。自1946年预测其存在和20世纪70年代对其进行分离纯化后,近30~40年来,人们对其分子生物学和功能进行了大量的研究[2]。
睾丸功能的评价目前主要基于成年期血清黄体生成素(luteinizing hormone,LH)、卵泡刺激素(follicle stimulating hormone,FSH)、睾酮的测量和精液分析。然而,这些理化分析不适用于青春期前的儿童。原因是血清促性腺激素和睾酮的水平只在小青春期(出生后3~6个月)增加,之后直到青春期才会被检测到明显升高。此外,青春期前不同种族和年龄的儿童睾丸超声标准较为匮乏,这也限制了其成为一种可信赖的评估儿童睾丸功能方法。儿童睾丸的生殖细胞和间质细胞相对静止,支持细胞是胚胎期和青春期前睾丸体积的主要组成部分。其分泌的血清AMH水平代表了支持细胞的功能,间接反映青春期前儿童的睾丸功能。支持细胞也分泌抑制素B,但其水平受FSH的刺激,在青春期升高[3]。
人类胚胎早期,XX和XY胚胎的内生殖道是相同的。中肾管在胚胎第4周形成于中胚层,并向着泌尿生殖窦方向延长。胚胎第5周末,中肾管侧面的体腔细胞逐渐转变成Müllerian细胞,并向泌尿生殖窦生长,最终融合成Müllerian管,进而形成子宫和阴道。关于男性胚胎,性别分化最初由Y染色体上的性别决定基因启动。胚胎第6周,胎睾的支持细胞开始合成AMH,促使子宫、输卵管和阴道上1/3的结构退化。当胚胎受孕9周后,Müllerian导管完全退化消失。随后,睾丸间质细胞在胎盘绒毛膜促性腺激素(human chorionic gonadotrophin, HCG)的作用下产生睾酮,睾酮直接作用于中肾管,促进其在第12周分化为附睾、输精管和精囊。妊娠后期,FSH调节支持细胞的活动,促进AMH的生成,使AMH维持在一个较高水平[7]。LH是睾酮分泌的主要刺激物,负责阴茎生长,并与间质细胞因子INSL3共同使睾丸下降到阴囊位置。
在小青春期,下丘脑-垂体-性腺轴保持3~6个月的活跃状态,此时的AMH水平也处于一个高峰。LH刺激睾丸间质细胞睾酮的产生,FSH刺激支持细胞增殖,促进AMH和抑制素B的分泌。在胎儿期和婴儿期早期,支持细胞不表达雄激素受体,因此对小青春期高水平的睾酮不敏感[4]。小青春期之后,促性腺激素再次减少,此时AMH的分泌水平较前稍有降低,但仍维持一个较高水平,直至青春期开始[5]。青春期开始后,下丘脑-垂体-性腺轴启动,促性腺激素分泌的增加促使青春期性腺发育,睾丸支持细胞的雄激素受体被激活,在逐渐增加的睾酮直接作用下,刺激支持细胞成熟,使其停止增殖,导致AMH水平逐渐下降到较低水平并一直到成年期[6]。
人AMH基因全长2.8 kb,位于染色体19p13.3上,含有5个外显子,第5外显子的3'端编码生物活性C端结构域,转录调节因子GATA、SF1和SOX9在翻译起始位点418 bp内的结合位点激活AMH的表达[7]。像TGF-β家族的其他成员一样,AMH通过两个膜结合的丝氨酸/苏氨酸激酶受体(1型和2型)传递信号。事实上,2型受体(AMHR2 )是主要受体,它特异性地与TGF-β家族的其他成员结合。在结合之前,AMH必须在精氨酸451处发生蛋白水解裂解,不需要分离碎片。AMH-AMHR2复合体的形成诱导1型受体的激活,进而激活细胞质SMAD蛋白的磷酸化和核转移以及随后的基因转录。TGF-β家族成员之间共享1型受体、激活素样激酶(ALKs )和SMAD效应物。AMH转录的严格调控对于Müllerian导管的退化至关重要,因为它们只能在非常短的时间内对AMH做出反应。转录起始需要各种转录因子的合作,例如SOX9、SF1、GATA4和WT1[8]。在胎儿后期和出生后,睾丸AMH的产生通过FSH的七个跨膜受体和GSA亚单位、环磷酸腺苷、蛋白激酶A和转录因子SOX9、SF1、AP2和NFkB的通路而增加[7,9]。转录可以被雄激素下调,睾酮通过雄激素受体发挥作用并且需要SF1与AMH启动子的完美结合[10]。
目前,国内外普遍用于AMH检测采用的方法原理主要有酶联免疫吸附测定法(Enzyme linked immunosorbent assay,ELISA)、化学发光免疫分析法和胶体金法。化学发光分析法是根据化学反应产生的辐射光的强度来确定物质含量的分析方法。ELISA法是将抗原或抗体吸附在固相载体表面,使抗原抗体反应在固相载体表面进行。可用间接法、双抗体夹心法或竞争法测定抗原或抗体。胶体金法是一种以胶体金作为示踪标志物应用于抗原抗体的一种新型的免疫标记技术。
自1990年开始采用ELISA方法测定血清中AMH的浓度以来,目前已有多位专家学者进行过AMH水平区间的评估[11]。2016年《国际儿科内分泌学》杂志报道了一份健康男童及成年男性中正常的AMH血清值参考范围,并根据年龄范围和Tanner分期(表1 )[12]。这份报道综合了三份研究结果,AMH的检测采用了ELISA法和ELISA法-双抗体夹心法[12,13,14,15]。
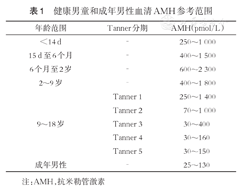
健康男童和成年男性血清AMH参考范围
健康男童和成年男性血清AMH参考范围
| 年龄范围 | Tanner分期 | AMH(pmol/L) |
|---|---|---|
| <14 d | - | 250~1 000 |
| 15 d至6个月 | - | 400~1 500 |
| 6个月至2岁 | - | 600~2 300 |
| 2~9岁 | - | 400~1 800 |
| Tanner 1 | 250~1 400 | |
| Tanner 2 | 70~1 000 | |
| 9~18岁 | Tanner 3 | 30~400 |
| Tanner 4 | 30~160 | |
| Tanner 5 | 30~150 | |
| 成年男性 | - | 25~130 |
注:AMH,抗米勒管激素
国内王斐等[16]通过ELISA法-双抗体夹心法,多中心大样本检测了国内1 400例0~5岁健康儿童血清AMH浓度,得出儿童血清AMH浓度范围(表2)。
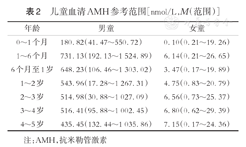
儿童血清AMH参考范围[nmol/L,M(范围)]
儿童血清AMH参考范围[nmol/L,M(范围)]
| 年龄 | 男童 | 女童 |
|---|---|---|
| 0~1个月 | 180.82(41.47~550.72) | 0.10(0.21~19.26) |
| 1~6个月 | 731.13(192.13~1 524.89) | 6.14(0.21~26.65) |
| 6个月至1岁 | 648.23(106.46~1 303.02) | 3.47(0.17~19.89) |
| 1~2岁 | 543.96(17.28~1 267.31) | 4.75(0.83~20.79) |
| 2~3岁 | 514.98(30.88~1 027.09) | 6.56(0.73~25.37) |
| 3~4岁 | 516.41(95.88~1 002.45) | 6.80(0.62~29.39) |
| 4~5岁 | 435.45(132.44~1 035.86) | 7.15(0.17~24.36) |
注:AMH,抗米勒管激素
临床上,AMH的检测已经在多种学科领域进行了相关的研究。在女性中,AMH由卵巢颗粒细胞产生,是用来评价卵巢储备的标志[17,18]。成年男性睾丸中检测不到AMH,不育者的血清中偶尔可以检测到AMH,可能与其部分未分化的支持细胞有关。在儿童中,可通过AMH的检测来观察激素水平与隐睾的相关性,或对疑似无睾症患儿判断其睾丸组织存在与否。也有研究者提出AMH水平对儿童的性发育异常(disorders of sex development, DSD)具有一定的诊断价值,可以代替HCG兴奋试验[4]。
除了围产期出现短暂的下降外,AMH水平从胎儿第7周末一直保持在高水平,其数量与支持细胞的成熟程度呈负相关[19]。当青春期开始时,支持细胞从增殖和不成熟状态进入静止和成熟状态,AMH水平在青春期急剧下降[12]。
尽管AMH的基础分泌与FSH无关,但对先天性中枢性性腺功能减退症(central hypogonadism,CHH)患儿的研究显示,FSH给药后其AMH水平升高[20]。在此基础上,青春期前AMH的升高可能反映了支持细胞受到FSH的刺激,因此,在CHH患儿中检测到低AMH水平[21]。相反,青春期发育延迟的患儿表现出正常的AMH水平[22]。CHH患儿在胎儿期和出生时缺乏FSH,可能导致支持细胞增殖不足,从而导致青春期前血清AMH水平低,这种机制在青春期发育延迟中不发生[23]。因此,AMH被认为是鉴别中枢性性腺功能减退症和青春期延迟的有用标记。
AMH可能在性早熟的早期发现中起一定作用。事实上,患有中枢性或非性腺激素依赖型性早熟的患儿血清AMH水平较低,就像正常青春期一样[24]。实验和临床研究表明,睾酮的浓度对AMH的产生有负面调节作用。青春期AMH的减少可能与间质细胞来源的睾酮对成熟SCs即表达雄激素受体(androgen recepter, AR)的抑制作用有关,这种抑制作用主要是FSH刺激作用。所以,AMH测量在显示出性早熟早期迹象的病例中可能有用,因为此时促性腺激素和睾酮水平还不能提供有效的信息。此外,由于用促性腺激素释放激素拮抗剂治疗会降低睾酮,升高AMH水平,因此血清AMH测量可以用来监测促性腺激素释放激素拮抗剂给药的有效性、剂量和/或坚持治疗的情况[12,24]。
睾酮是一种负责生殖系统男性化的类固醇,AMH是TGF-β家族的糖蛋白成员,它们是完全不同的分子,具有特定的生物合成和信号通路。两者若存在缺陷则表明整个睾丸是不正常的。在最极端的情况下,生殖器完全是女性的、Müllerian的衍生物即子宫和输卵管正常,提示睾丸从未存在或从未发挥作用。当血清AMH检测不出来,或检测水平低于46,XX的女孩时,这种情况被称为完全性性腺发育不良或Swyer综合征(46XY性反转),是早期胎儿发作的原发性性腺衰竭的完整形式[25,26]。
如果怀疑DSD患儿存在雄激素合成或作用缺陷,AMH也是有帮助的。不明确的或女性生殖器提示雄激素衰竭时,睾丸激素水平不能区分性腺发育不良和儿童时期的特殊间质细胞紊乱或雄激素不敏感。而血清AMH可以定位诊断,它在性腺发育不良中低或检测不到,但在孤立的间质细胞障碍或雄激素不敏感中正常或升高。
大多数类型的DSD都以睾酮功能障碍为特征。在男性化不足的XY DSD中,低AMH是性腺发育不全的典型表现,而在雄激素不敏感和雄激素合成缺陷中可观察到AMH正常或高水平。在大多数其他与睾酮缺乏有关的XY DSD中,AMH血清水平在年龄上是正常的,诊断基本上依赖于睾酮及其前体以及代谢物和促性腺激素的分析。目前,分子分析正发挥着越来越重要的作用,靶向或全外显子新一代测序显著提高了XY DSD病例的诊断比例[27,28]。
此外,在青春期前的DSD患儿中,血清AMH测量可监测支持细胞功能,这是一个非常有用的特征。因为所有XY性腺发育不良的患儿都有发生恶性生殖细胞肿瘤的风险,应密切监测[29]。就其本身而言,Müllerian残留物的存在应提醒临床医生注意这种可能性。以前,癌症风险是选择将男性化差且有Müllerian器官的患儿作为女性抚养的决定性论据,因为这个决定涉及早期双侧性腺切除术。如今,一些人权活动家认为,应该禁止对婴儿进行生殖器成形术,发育不良的睾丸可以保留在原位,直到儿童达到青春期前,因为青春期前生殖细胞恶性肿瘤发生的风险非常低[30,31,32,33,34]。
隐睾症指睾丸下降异常,未下降至阴囊,在新生儿尤其是早产儿中很常见,隐睾症可以出现在许多不同病因的疾病中[35]。未触及性腺的双侧隐睾应与无睾症相鉴别。性别发育异常者,胎儿晚期睾丸组织的消失或退化与男性生殖器、小阴茎和阴囊发育不良有关。出生后,隐睾症应与双侧隐睾合并腹部睾丸相鉴别。
青春期前,男性睾丸支持细胞占睾丸质量的75%,隐睾中支持细胞的数量可能有不同程度的下降,这可能是由于隐睾周围温度升高所致。隐睾患儿AMH降低的程度与睾丸损伤的严重程度有关,提示支持细胞功能恶化可能是隐睾患儿睾丸损伤的早期因素[12]。血清AMH的数量取决于支持细胞的数量和完整性,因此,在支持细胞功能障碍所致的原发性睾丸损伤病例中,AMH的表达水平可能存在意义[19]。研究表明,75%的双侧隐睾和未触及睾丸的儿童血清AMH降低,35%腹股沟型隐睾儿童中AMH水平较低[36]。Noonan综合征中,约2/3的病例发生隐睾。在童年时期,生殖激素在预期范围内。青春期发育延迟或者青春期中后期,促性腺激素水平高于正常范围,AMH在有隐睾症的患儿中下降到低于正常水平,而睾丸下降者则保持在正常水平[37]。因此,在性腺未触及的患儿中,AMH测量有助于鉴别是否有睾丸组织的存在。
不孕症是隐睾症患者长期关注的主要问题。单侧和双侧隐睾的不孕症风险分别为30%和54%,根据睾丸暴露于腹部温度的时间长短而定。在双侧隐睾的男孩中发现75%~100%的不孕不育风险,这些男孩在性腺活检中没有发现生殖细胞[38]。综上,隐睾引起的男性不育程度与支持细胞损伤的严重程度有关。其血清AMH水平下降的程度越高,成年后不育的风险就越大[39]。
PMDS是一种罕见的常染色体隐性遗传病,是单纯的AMH合成或作用的缺陷导致的,其特征是在完全男性化的46,XY男性中,米勒衍生物、子宫和输卵管持续存在。最常见的表现为以下3种情况之一:双侧隐睾、单侧隐睾伴对侧疝和横向睾丸异位。
AMH缺乏或者作用障碍的男性,可能会出现发育正常的男性外生殖器和米勒管永存的现象。截至2019年1月,共在81个家系中检测到AMH基因65种不同突变,主要发生在外显子1、2和5[40]。在第5外显子中,编码生物活性的C端结构域的碱基的命中率几乎是N端碱基的三倍。没有真正的热点,许多突变是反复发生的,但通常不会影响2~3个以上的家族。但,第2外显子Y167C突变,目前已经在7个家族中发生。在AMH基因的突变中,血清AMH水平通常很低或检测不到[41]。在患有PMDS的青春期前男孩中,非常低或检测不到的循环AMH水平是AMH突变的特征。
AMHR2是一种由573个氨基酸组成的膜蛋白,含有一个N端的胞外区与AMH结合,一个跨膜区和一个具有丝氨酸/苏氨酸激酶活性的胞内区。AMHR2基因位于染色体12q13,包含11个外显子,全长8 kbp。前3个外显子编码裂解AMH的胞外区,外显子4编码跨膜区,后7个外显子编码催化胞内区。血清中具有生物活性的AMH水平可以通过评估它们与AMHR2结合的能力来监测。最新研究表明,AMHR的基因突变可能会导致PMDS[42]。在79个家系中发现了包含64个不同等位基因的AMHR2基因突变,最常见的突变是激酶结构域27 bp缺失。与AMH基因相比,AMHR2的反复突变略少,分别为10和19。AMHR2第10外显子27 bp缺失极为常见,75例患儿中即有30例携带1个或2个等位基因。
以上研究说明88%的PMDS病例是由AMH或AMHR2突变导致的,而12%的病例,未检测到AMH或AMHR2的突变,称为特发性PMDS[41]。然而,一些研究表明,AMH或AMHR2突变的多样性可能没有被充分认识,而且测序的敏感性和特异性可能是有限的,导致AMH或AMHR2的远端启动子或内含子发生不明突变[40,42]。此外,AMH信号通路中其他分子也有发生突变的可能[39]。在实践中,PMDS的诊断在家族性病例、腹股沟疝或睾丸横断性异位的患儿中几乎不存在问题。但是,在尚未进行核型分析的、无法触及睾丸的患儿中,必须排除其他疾病,如单纯性双侧隐睾、无睾丸,甚至Prader V型先天性肾上腺皮质增生症。这种情况下,AMH检测没有什么价值,因为根据涉及的基因,血清AMH既可以像无睾症和肾上腺皮质增生症那样检测不到,也可以像隐睾症那样正常或在正常的较低范围内[43]。
XXY综合征,又称克兰费尔特综合征(Klinefelter综合征),是男性性腺机能减退的最常见形式,特征是生殖细胞加速衰竭。临床表现以身材高大,睾丸小而硬,第二性征发育不良为主。该综合征的特点为多出一条或多条X染色体,90%的病例为经典的47, XXY核型。隐睾症和轻度发育障碍在儿童时期就会被诊断出来,但大多数患者常于青春期或成年期时才出现异常,多会在成年后因不孕不育而就诊[44]。在Klinefelter综合征患者中,婴儿期和儿童期没有明显的性腺功能减退的迹象:AMH、抑制素B和FSH水平均正常。成人期的AMH水平下降至低于正常水平。有文献报道,在对29例Klinefelter综合征患儿的12.3年随访研究中,发现FSH早期升高,并伴有青春期晚期AMH和抑制素B水平异常降低或检测不到,这可能是由于儿童和青春期内分泌功能进行性损害所致[45]。然而,在Klinefelter综合征患儿中观察到与青春期相关的AMH下降延迟,最终导致成年后AMH水平下降,可能是由于支持细胞暂时的功能代偿所致。从青春期中开始,支持细胞功能逐渐恶化,导致极低或无法检测的AMH和抑制素B水平,非常高的FSH和小的睾丸容量[45,46]。最近有文献报道,与健康同龄人相比,青春期前更高的AMH水平被认为对患有Klinefelter综合征的男孩的发展具有保护作用[47]。
由于AMH的分泌在胚胎发育和不同年龄阶段变化较大,目前尚未有统一的参考范围。所以,尽管目前认为AMH是评估青春期前睾丸功能的可靠的生物标志物,但其在临床中的应用仍存在不确定性,与HCG试验之间的一致性也有待研究。Karaoglan[48]将160例患有性腺功能减退相关疾病年龄在0~18岁的男孩分为5组,分别为性腺发育障碍34例(特纳综合征23例、无睾综合征11例)、雄激素合成和受体障碍48例(完全型雄激素不敏感综合征35例、部分型雄激素不明感综合征7例、5-α还原酶缺乏征6例)、孤立生殖器畸形57例(单纯性隐睾33例、特发性小阴茎24例)、低促性腺素性功能减退症15例和青春期延迟6例。患儿均接受了连续3 d的HCG激发试验(1 500 U·M-2·D-1)。试验证明,性腺发育障碍、5-α还原酶缺乏和低促性腺素性功能减退症患儿血清AMH值低或检测不到,而雄激素不敏感综合征、青春期发育延迟、单纯性隐睾和特发性小阴茎患儿血清AMH值高或正常。AMH值<32 pmol/L表示功能绝对缺失,相当于睾丸组织的绝对缺失,32~75 pmol/L之间则可描述为部分功能不全或异常。AMH值为75 pmol/L表明功能性睾丸组织存在。而且,AMH检验与HCG检验具有较强的相关性(R160= 0.689)和较强的一致性(Kappa系数160=0.7 )。该研究提示血清AMH检测可作为评价46,XY男性性腺功能减退症患儿睾丸功能的可靠、实用的生物标志物。
综上所述,青春期前血清AMH值反映了支持细胞的功能、数量和成熟程度。血清AMH测定有助于评估睾丸功能障碍和性别发育异常患儿的睾丸组织的功能。在DSD患儿中,血清AMH可用于以下目的:①检测睾丸组织的存在;②评价支持细胞的功能;③区分影响整个睾丸分化的先天性疾病(性腺发育不全)和仅影响睾丸间质细胞支持细胞的先天性疾病;④PMDS的诊断应结合AMH或AMHR2基因的研究。但由于①AMH的分泌在胚胎发育和不同年龄阶段存在差异,其调控机制尚不清晰;②不同方法和试剂检测AMH的参考范围不同,AMH水平的比较存在困难,而且,目前缺少单一试剂盒、大样本的数据检测分析;③AMH更进一步的基因调控及引起基因突变的原因目前还不清楚;④AMH用来评价睾丸功能的临界指标还未得出明确结论。因此,检测血清AMH水平用来评估青春期前儿童睾丸功能的临床应用,未来仍需要大量严谨的实验研究。
所有作者均声明不存在利益冲突



























