
探讨儿童双侧肾母细胞瘤(bilateral wilms tumor, BWT)的临床特点、治疗效果以及预后,加深临床认知。
收集北京儿童医院在2008年1月至2019年12月收治的43例BWT患儿的临床资料,包括年龄、临床表现、影像学检查、术前化疗、手术方式、病理诊断和预后。43例共86侧肾脏;男24例,女19例;就诊中位年龄为17个月,范围为3~69个月;术前化疗30例(60侧)作为术前化疗组,未化疗9例(18侧)作为未化疗组,余4例(8侧)资料不详不列入任何组别;6例化疗前行穿刺活检。30例(60侧)术前化疗患儿中术前化疗反应评估资料完整26例(52侧),缺失4例(8侧)。术前化疗时间范围为4~12周,术前化疗方案以VA方案(长春新碱+更生霉素)为主,共19例(38侧);VAD方案(长春新碱+更生霉素+阿霉素),9例(18侧);仅运用长春新碱化疗,2例(4侧)。本研究病例随访数据采用Kaplan-Meier法绘制生存曲线,SPSS 24.0软件计算4年无事件生存率和总体生存率。
行双侧保留肾单位手术(nephron sparing surgery, NSS) 30例[69.8%(30/43)];行一侧瘤肾切除术+对侧NSS有13例[30.2%(13/43)]。术前化疗组中双侧NSS占80.0%(24/30),术前未化疗组中双侧NSS有6例。43例患儿术后均复查增强CT,双侧肾脏残存肾实质累计大于单侧肾脏23例[53.5%(23/43)],双侧肾脏残存肾实质累计小于单侧肾脏20例[46.5%(20/43)]。所有患儿均获随访,中位随访时间为48个月,范围为8~158个月;中位随访年龄为71个月,范围为39~180个月。存活39例,死亡4例;存活患儿中,肾功能衰竭1例,带瘤存活4例;死亡患儿中,1例为术后9年无瘤状态下死于脑疝,余3例为复发治疗后死亡。术后复发9例,单侧最高分期为Ⅲ期4例,Ⅳ期5例;复发部位为原位复发7例,腰大肌处复发1例,腹膜后多处复发1例;中位复发时间为11个月,范围为1~38个月;7例手术切除复发灶,术后加用依托泊苷、卡铂、环磷酰胺加强化疗;复发患儿中死亡3例,带瘤存活2例,无瘤存活4例。Kaplan-Meier法计算得出所有43例患儿4年无事件生存率为85.6%,总体生存率为90.4%。
BWT通过术前化疗,尽可能行NSS,术后根据化疗后病理分型并结合分期进行治疗仍可以有良好的预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肾母细胞瘤(wilms tumor,WT)是儿童时期最常见的肾脏恶性肿瘤,其中双侧肾母细胞瘤(bilateral wilms tumor, BWT)占5%~8%[1]。目前单侧组织学预后良好型(favorable histology,FH)WT无瘤生存率>85%,然而在BWT的治疗中仍存在巨大挑战[1]。运用NWTS-5化疗方案的BWT患儿随访4年的无瘤生存率为56%,其中FH、局灶间变型、弥漫间变型患儿的4年无瘤生存率分别为65%、76%、25%[2,3,4]。如何在防止肿瘤复发的前提下保留有效肾组织防止远期肾功能衰竭是BWT治疗的焦点。本文研究总结儿童BWT的临床特点、治疗效果以及预后,以期对该疾病有更清晰的认识。
2008年1月至2019年12月,北京儿童医院共收治WT患儿568例,排除单侧WT+对侧肾母细胞瘤病(nephroblastomatosis,NS),病理诊断为BWT有47例,4例临床资料不全且失访,最终纳入43例BWT[7.6%(43/568)]。43例共86侧肾脏;男24例,女19例;就诊中位年龄为17个月,范围为3~69个月,30.2%(13/43)的患儿就诊年龄<1岁;术前化疗30例(60侧)作为术前化疗组,未化疗9例(18侧)作为未化疗组,余4例(8侧)资料不详不列入任何组别;6例化疗前行穿刺活检。临床表现为腹部包块30例,血尿6例,B型超声检查时无意发现4例,腹痛、腹胀3例。所有患儿术前均行B型超声和增强CT检查,提示12例并发畸形,其中隐睾6例,尿道下裂并隐睾2例,WAGR综合征2例,右侧肾盂输尿管连接部梗阻、Denys-Drash综合征各1例;肿瘤位于肾脏一极有69侧,肿瘤直径中位数为9.6 cm,范围为5~17 cm。
本研究已通过北京儿童医院伦理委员会审批,审批号:[2021]-E-154-R。所有患儿监护人均签署了临床研究知情同意书。
30例(60侧)术前化疗患儿中术前化疗反应评估资料完整26例(52侧),缺失4例(8侧)。术前化疗时间范围为4~12周,术前化疗方案以VA方案(长春新碱+更生霉素)为主,共19例(38侧);VAD方案(长春新碱+更生霉素+阿霉素)有9例(18侧);仅运用长春新碱化疗有2例(4侧)。
术前化疗反应评估情况为:90.4%(47/52)不同程度缩小;32.7% (17/52)缩小程度>1/3;57.7%(30/52)缩小程度<1/3;7.7% (4/52)肿瘤增大;1.9%(1/52)完全消失。
均经腹腔行开放手术,手术方式包括一侧瘤肾切除术+对侧保留肾单位手术(nephron sparing surgery,NSS)和双侧NSS。两侧手术间隔2周。
采用SPSS 24.0及GraphPad Prism 8软件进行数据处理。应用单样本K-S检验验证是否正态分布,非正态分布计量资料以中位数表示;采用Kaplan-Meier法绘制生存曲线,估计4年无事件生存率(event free survival,EFS)和总体生存率(overall survival, OS)。计数资料以例数和(或)百分数表示,组间比较采用χ2检验或Fisher精确概率法检验。P< 0.05为差异具有统计学意义。
行双侧NSS 30例,占69.8%(30/43);行一侧瘤肾切除术+对侧NSS有13例,占30.2%(13/43)。术前化疗组中双侧NSS占80.0% (24/30),术前未化疗组中双侧NSS有6例。43例术后均复查增强CT,双侧肾脏残存肾实质累计大于单侧肾脏23例[53.5%(23/43)],双侧肾脏残存肾实质累计小于单侧肾脏20例[46.5%(20/43)]。
本研究患儿术后病理分型按国际儿童肿瘤(International Society of Pediatric Oncology,SIOP)病理分型系统进行分型,其中间叶为主型23侧,上皮为主型9侧,胚芽为主型9侧,混合型21侧,大面积坏死化疗后改变7侧,胎儿横纹肌瘤型7侧,囊性部分分化型2侧,囊性1侧,病理具体分型不详7侧。术后单侧最高分期为Ⅰ期15例,Ⅱ期17例,Ⅲ期6例,Ⅳ期5例,术后根据SIOP病理分型并结合单侧最高分期进行化疗,其中9例在化疗的基础上增加放射治疗。
所有患儿均获随访,中位随访时间48个月,范围为8~158个月;中位随访年龄为71个月,范围为39~ 180个月,2例患儿的随访年龄>12岁。存活39例,死亡4例;存活患儿中,肾功能衰竭1例,带瘤存活4例;死亡患儿中,1例为术后9年无瘤状态下死于脑疝,余3例为复发治疗后死亡。术后复发9例,单侧最高分期为Ⅲ期4例,Ⅳ期5例;复发部位为原位复发7例,腰大肌处复发1例,腹膜后多处复发1例;中位复发时间为11个月,范围为1~38个月;7例手术切除复发灶,术后加用依托泊苷、卡铂、环磷酰胺加强化疗;复发患儿中死亡3例,带瘤存活2例,无瘤存活4例。
所有43例患儿4年无事件生存率为85.6%,总体生存率为90.4%(图1)。
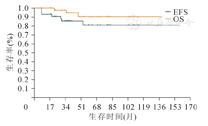

注:EFS,无事件生存率;OS,总体生存率
BWT按发生时间不同,分为同一时期和不同时期,其中同一时期BWT约占WT的6.3%,不同时期BWT约占WT的0.85%[5]。本研究43例BWT患儿中,6.9%(39/568)为同一时期,0.7%(4/568)为不同时期,与文献报道基本一致[5]。BWT合并泌尿生殖系统畸形和相关易感综合征概率高,相关易感综合征主要分为两大类,一类是WT1基因异常而导致的泌尿生殖系统畸形,包括WAGR综合征(WT、无虹膜症、泌尿生殖系统发育异常和智力障碍)和Denys Drash综合征(WT、性发育异常、肾小球硬化),另一类是过度生长型综合征,最常见的为Beckwith-Wiedemann综合征(脐膨出、巨舌、巨体)。Charlton等[5]报道的545例双侧BWT患儿中,并发畸形120例[22.0% (120/545)],本研究12例[27.9%(12/43)]并发畸形,其中9例为泌尿生殖系统畸形,3例合并相关易感综合征。
BWT患儿术前通过B型超声、增强CT检查不难诊断,在儿童双侧肾脏肿瘤中,主要病理类型以WT为主,其他类型双侧肾脏肿瘤罕见,因此主要需与单侧WT合并对侧NS鉴别。超声检查图像主要表现为肾区膨胀性生长的实性、囊实性肿物,少数则以囊性病变为主,WT的最大直径多>3 cm,呈球形,有假包膜;而NS的最大直径多<2 cm,呈卵圆形,无假包膜,NS内罕有出血坏死。增强CT检查图像主要表现为肾区实性、囊实性肿物,少数表现为囊性,肿瘤假包膜呈完全或不完全轻度增强带,残余肾在肿瘤周边形成新月形或厚薄不等的环形高密度影,称新月征或边缘征。临床工作中更容易见到一侧WT合并对侧NS,因NS通过化疗可有效抑制其发展甚至消失,故不在本研究讨论范围。双侧WT如何在保证不复发的前提下更多的保留有效肾组织防止远期肾功能衰竭是需要特别关注的焦点。本研究5例经外院首诊的同时期BWT患儿,3例术前未经化疗,切除一侧瘤肾后转入本院,1例将肿瘤小的一侧瘤肾切除,为后续治疗,特别是为防止远期发生肾功能衰竭带来挑战。
目前不论美国儿童肿瘤协作组(Children's Oncology Group,COG)还是SIOP协会对于BWT的治疗原则均是在提高存活率的前提下,经术前化疗力争行NSS手术而保留肾组织,减少远期肾功能衰竭的发生。COG和SIOP在术前化疗药物的选择方面略有不同,SIOP推荐VA(长春新碱+更生霉素)化疗4周评估疗效,如肿瘤体积缩小>50%,则继续化疗4周后手术;如肿瘤稳定或进展则加用阿霉素化疗4周,直到肿瘤缩小至可行NSS为止,如加用阿霉素后肿瘤大小没有进一步变化,且检查评估肿瘤行NSS术存在困难,则组织专家组会诊讨论强化化疗及手术治疗方案[6]。COG在针对BWT进行的前瞻性临床试验AREN0534中,目标为双侧NSS占比> 50%,4年EFS由NWTS-5报道的56%提高到73%,术前VAD方案(长春新碱+更生霉素+阿霉素)化疗6周后评估是否可行双侧NSS,如肿瘤缩小但不能行双侧NSS则继续化疗至12周;如肿瘤稳定甚至进展则双侧活检后调整方案化疗至12周再行手术治疗[7]。BWT术后治疗方案按SIOP化疗后病理分型并结合单侧最高分期制定[7,8]。根据术前化疗后的反应评估和肿瘤组织学将WT分为低危、中危和高危三种类型。低危为完全坏死型;中危包括消退型、混合型、间叶型、上皮型、局灶间变型;高危则包括胚芽型和弥漫间变型。在术后化疗的基础上,对单侧最高分期为Ⅱ期以上并高危、Ⅲ期以上并中危的患儿行侧腹部放射治疗,放射治疗的时间一般推荐在术后2周内开始[9]。
本研究术前化疗以VA方案为主,对术前影像学检查发现淋巴结或远处转移的患儿予VAD方案化疗。本研究的术前化疗组中,19例初始化疗为VA方案的患儿中术后复发4例,死亡1例,该例为不同时期的BWT; 9例初始化疗为VAD方案的患儿中,术后复发3例,死亡2例;仅运用长春新碱化疗的2例无复发、死亡。术前化疗组中运用VAD方案患儿的预后稍差于使用VA方案、长春新碱化疗的患儿,考虑因本院仅在部分病理分期为Ⅲ、Ⅳ期患儿予VAD方案化疗,和使用VA方案、长春新碱化疗的患儿相比存在分期上的差异,不能说明不同化疗方案的优劣。
COG和SIOP均支持在术前化疗12周内行手术治疗,主要原因为:①德国儿童肿瘤协作组对BWT患儿的研究说明化疗前12周肿瘤缩小最明显;②化疗时间>12周,NSS手术难度将增加;③化疗至12周仍无满意效果应考虑间变型、胎儿横纹肌瘤型等对化疗不敏感的病理类型WT,盲目延长化疗时间可能仅让患儿暴露于化疗药物的毒副作用之中,延误治疗时机[5,7]。
BWT术前化疗是否需要活检,目前COG和SIOP均不建议常规术前活检,术前诊断更依赖于影像学检查。COG对于单侧WT术前化疗行活检的主要原因是为了避免误诊以及确认肿瘤是否存在间变。然而在SIOP研究中显示WT的误诊率很低,单侧肾肿瘤的误诊率在1.6%~5.5 %[10]。尽管已有罕见的双侧肾恶性横纹肌样瘤和双侧肾癌的病例报道,但双侧肾肿瘤的误诊率更低[11]。有报道提出在术前经活检未发现间变,而切开活检间变型WT的检出率为33.3%[12]。另有报道在25例同时具有术前活检及术后肿瘤标本的双侧间变型WT患儿中仅8.0%(2/25)在术前活检检出间变类型[2]。此外日本肾母细胞瘤协作组报道了16年共28例BWT患儿,其中17例进行了术前活检,未检出间变型WT,术后经病理证实,此28例患儿均为FH(组织学预后良好型),此后针对BWT患儿,不再做术前常规活检[13]。本研究6例患儿进行术前活检,1例影像学征象不典型,考虑为透明细胞肉瘤或淋巴肉瘤可能,另5例为常规行化疗前活检,此6例患儿活检病理诊断均为WT,43例患儿术后病理诊断同样未发现间变型WT。结合以上分析可见BWT患儿在术前化疗不必常规行活检,但是对于年龄>10岁或者影像学检查征象不典型的患儿需考虑活检。
对BWT患儿而言,在提高EFS、OS的同时,最大的威胁是终末期肾病(end-stage renal disease,ESRD),因此如何尽量保留肾单位是关键。手术方式应尽可能在规律术前化疗后分期行双侧NSS,两侧手术间隔2周,尽可能保留患儿肾组织以保障远期肾功能。目前尚无NSS临床治疗指南,一般认为BWT经术前化疗后,肿瘤位于肾脏一极或者肾脏中部的边缘,术前肿瘤没有破裂,没有侵袭周围器官,保留的肾组织大于正常肾脏1/2可以考虑行NSS。COG报道术前化疗后双侧行NSS比例为39%,术后根据病理分型结合单侧最高分期进行放射治疗和化疗[7]。NSS手术的热缺血时间<30 min是保护肾功能的重要因素。如果难以在30 min内处理完创面,可以在阻断肾蒂血管20 min时开放肾血管1~2 min后重新阻断肾蒂血管并继续手术。NSS主要的缺点是在手术切缘肿瘤阳性时会增加肿瘤复发的概率,因此术中尽量做到切缘阴性。本研究在NSS术后未见切缘阳性患儿,与术前通过影像学精准判断、术者经验和术中谨慎操作有关,本研究认为术前化疗后,肿瘤与正常肾脏之间包膜更明显,在警惕包膜薄弱部位的同时偏向肾脏剜除是防止切缘阳性的方法。如果术后病理淋巴结为阳性,预后良好型需进行放射治疗而不必再次手术切除保留的肾脏,弥漫间变类型等预后不良类型则需切除残肾并放疗;如果切除标本中有NS,提示残肾发生异时WT的可能性大,需要密切随访。有研究认为术后病理诊断NSS切缘阳性的BWT患儿在术后需接受规范的放射治疗和化疗,局部复发风险在切缘阳性与切缘阴性患儿之间的差异无统计学意义[14,15]。
BWT患儿预后在近十年较前有显著改善。COG报道AREN0534研究中双侧WT的4年EFS、OS分别为82.1%和94.2%,较NWTS-5报道双侧WT的4年EFS、OS分别为56.0%和80.8%明显提高[7]。日本肾母细胞瘤协作组对28例BWT患儿平均随访8年时间,范围为1.3~13.1年,EFS为85.5 % ,OS为92.6%[13]。本研究43例患儿的中位随访时间为48个月,范围为8~158个月,复发9例,死亡4例,4年EFS为85.6%,OS为90.4%,预后与相关报道一致[7,13,16]。本研究复发的9例中单侧最高分期为Ⅲ期4例,Ⅳ期5例;3例予术前化疗后病理诊断提示为胚芽型,该3例中2例术后出现远处转移。死亡的4例中1例因突发脑疝而死亡,余3例中1例为不同时期的WT,单侧最高分期为Ⅲ期,另2例单侧最高分期均为Ⅳ期。再次提示病理分型、单侧最高分期是影响BWT预后的重要因素。
BWT患儿在远期可能面临高血压、ESRD等并发症。一侧瘤肾全切+对侧NSS患儿远期随访中高血压发生率约66.7%,而双侧NSS患儿高血压发生率为20.0%~30.6%[17]。Breslow等[18]统计了BWT患儿远期ESRD发生率,平均随访时间为11.5年,其中无合并畸形的BWT患儿ESRD发生率为11.5%;合并泌尿生殖系统异常时为25.0%;合并WAGR综合征时为90.0%;合并Denys Drash综合征时为70.0%。本研究患儿尚未随访至成年,远期高血压及ESRD情况仍需进一步随访确认。
所有作者均声明不存在利益冲突



























