
探究烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(nicotinamide adenine dinucleotide phosphate oxidase 4,NOX4)通过调控细胞增殖对小鼠神经管缺损(neural tube defects,NTDs)形成的作用。
选用体重18~20 g的健康C57BL/6J小鼠,雌鼠30只,雄鼠15只,雌雄小鼠按2∶1比例于晚上合笼、过夜,次日清晨观察小鼠阴道栓,有明显阴道栓确认已交配,当日记为孕0.5 d(E0.5)。选取明确受孕的18只小鼠,按随机数字表法随机分为小鼠NTDs组(9只)和对照组(9只)。孕8.5 d(E8.5)时,将小鼠NTDs组利用全反式维甲酸(all trans retinoid acid,ATRA)按70 mg/kg的浓度灌胃处理,对照组采用橄榄油灌胃处理。在孕9.5 d(E9.5)收集胎鼠。体式显微镜下观察胚胎神经管发育情况并拍照记录形态。通过免疫荧光染色法观察神经管形态,蛋白质印迹法(Western blot)检测NOX4和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)在神经管的表达情况。构建NOX4过表达质粒(oe-NOX4)和对照(NC)以及NOX4沉默质粒(sh-NOX4 2#、sh-NOX4 3#)和对照(sh-NC),分别转染至C17.2细胞系中,通过Western blot检测NOX4及增殖相关蛋白PCNA的表达情况;通过细胞计数试剂盒(cell counting kit-8,CCK8)检测转染质粒24 h、48 h、72 h、96 h后细胞生长情况,进一步明确NOX4对细胞增殖的调控作用。
体式显微镜下观察E9.5胎鼠神经管发育情况,NTDs组存在明显神经管畸形。免疫荧光染色结果也显示NTDs组存在明显的神经管闭合不全,对照组神经管发育正常,且NTDs组神经管中NOX4表达略高于对照组,而PCNA的表达低于对照组。Western blot结果显示,NTDs组胚胎中NOX4表达(6.24±2.70)高于对照组(1.00±0.51),PCNA的表达(0.75±0.09)低于对照组(1.00±0.12),两组间的差异有统计学意义(P<0.05)。在C17.2神经干细胞中转染NOX4过表达质粒(oe-NOX4)和沉默质粒(sh-NOX4 2#、sh-NOX4 3#),利用Western blot检测NOX4表达水平的变化,结果显示,转染oe-NOX4质粒后,NOX4的表达(1.26±0.13)显著高于转染NC组(1.00±0.02),而转染oe-NOX4质粒后增殖相关蛋白PCNA的表达(0.71±0.10)较NC组(1.00±0.12)显著降低,差异有统计学意义(P<0.05);相反,转染sh-NOX4 2#、sh-NOX4 3#质粒后,NOX4的表达为(0.85±0.06)、(0.71±0.06),显著低于转染sh-NC质粒组(1.00±0.04),PCNA的表达(1.61±0.17)、(1.43±0.17)较sh-NC组(1.00±0.17)明显增加,差异有统计学意义(P<0.05)。利用CCK8实验探究NOX4对细胞增殖能力的影响,结果提示,过表达NOX4,24 h后与NC组相比,吸光度为(0.48±0.01)比(0.48±0.02),48 h为(0.82±0.04)比(1.12±0.03),72 h为(1.07±0.10)比(2.10±0.10),96 h为(2.53±0.20)比(3.01±0.43),细胞增殖能力呈下降趋势,差异有统计学意义(P<0.05);而与sh-NC相比,当转染sh-NOX4 2#、sh-NOX4 3#,24 h吸光度分别为(0.32±0.02)、(0.31±0.02)、(0.30±0.01),48 h为(0.77±0.02)、(0.64±0.04)、(0.37±0.04),72 h为(1.94±0.05)、( 1.69±0.03)、(1.24±0.08),96 h为(2.33±0.11)、( 2.11±0.05)、(2.01±0.01),细胞增殖能力有显著提高,差异有统计学意义(P<0.05)。
NTDs中异常高表达的NOX4能够通过降低增殖相关蛋白PCNA的表达,抑制细胞增殖,导致小鼠神经管闭合异常。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
神经管缺损(neural tube defects,NTDs)是胚胎发育过程中神经管闭合失败引起的一种中枢神经系统的严重出生缺陷,主要包括无脑畸形、脊柱裂和脑膨出,其发病率为0.5‰~2‰[1]。NTDs是由遗传和环境因素共同作用的复杂疾病,是导致婴儿死亡和患儿残疾的主要原因,不仅严重影响患儿的生命和生活质量,也给家庭和社会带来巨大的经济负担,已成为我国重大公共卫生问题[2]。
细胞增殖是神经管闭合过程中重要的生物学功能之一。神经管闭合是脊椎动物大脑和脊髓发育的开始,神经板通过弯曲、上升并融合形成闭合的神经管,需要精确控制细胞的增殖和分化情况来完成这一复杂且高度动态的形态学过程,如果这个过程中细胞增殖减少,会产生NTDs[3,4]。有文献报道,神经形成过程中,神经管背侧的细胞增殖活性强于腹侧的细胞,Phactr4通过控制细胞周期,可以导致空间上细胞增殖紊乱,造成无脑畸形的表型[5]。Notch1的缺失能导致神经干细胞的缺失和神经干细胞池的早熟分化和消耗殆尽,导致神经干细胞增殖受损继而影响神经管的形成[6]。课题组前期利用全反式维甲酸(all trans retinoid acid,ATAR)制作了NTDs大鼠模型,发现NTDs胎鼠神经管部位也存在细胞增殖减少,然而,神经管闭合过程中调控细胞增殖的相关机制仍不十分清楚。
烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase,NOX)是膜结合蛋白家族,由NOX1、NOX2、NOX3、NOX4、NOX5、DUOX1和DUOX2七种酶组成,NOX主要在神经元、神经胶质细胞和脑血管内皮细胞中表达[7]。文献报道NOX4在多种疾病中能调控细胞增殖[8,9,10]。NOX4可以抑制肝细胞的再生,在肝脏部分切除术后的小鼠模型中,NOX4通过抑制肝细胞增殖导致肝脏的实质结构和脂肪变性的恢复减慢[8]。NOX4能够抑制肿瘤细胞增殖,例如在药物诱导的结肠癌和纤维肉瘤模型中,NOX4基因敲除的小鼠比野生型小鼠的肿瘤发生时间更早且肿瘤的生长更快[9]。NOX4也能抑制糖尿病小鼠平滑肌细胞增殖,从而延缓动脉粥样硬化的进展[10]。
课题组前期研究发现,在NTDs疾病模型中,NOX4能够通过诱导细胞凋亡导致NTDs形成[11]。然而,NOX4对神经干细胞增殖的调控作用未见报道。本研究拟通过课题组前期成功构建的ATRA诱导的NTDs动物模型,观察NOX4在小鼠NTDs模型中的表达,并通过NOX4对增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)的表达调控以及CCK8实验明确NOX4对神经干细胞增殖活性的影响,进一步探究NTDs的发生机制,并为NTDs的诊断治疗提供新的靶点。
小鼠神经干细胞(C17.2,贝纳创联生物研究所),ATRA(美国Sigma公司),MEM培养基(美国Gibco公司),MEM NEAA(美国Gibco公司),胎牛血清(美国Gibco公司),双抗/青霉素链霉素溶液(美国Hyclone公司),NOX4质粒(上海吉凯基因化学技术有限公司)。JetPRIME(法国PolyPlus-transfection公司),BCA蛋白定量试剂盒(北京索莱宝科技有限公司),NOX4兔多克隆抗体(美国Rocklamd公司),PCNA兔多克隆抗体、β-actin鼠单克隆抗体、辣根过氧化物酶标记的山羊抗兔/抗小鼠IgG(美国Proteintech公司),4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)(上海碧云天生物技术有限公司),CCK8试剂盒(南京诺唯赞生物科技有限公司)。
C57BL/6J小鼠购自北京华阜康生物技术有限公司,饲养于中国医科大学附属盛京医院SPF级实验动物房。选用体重18~20 g的C57BL/6J小鼠,雌鼠30只,雄鼠15只,于前1 d晚按雌雄2∶1合笼,次日晨将小鼠分笼,观察雌性小鼠有无阴道栓存在,有阴道栓存在的雌性小鼠单独放一笼,记为孕0.5 d(E0.5)。于E8.5将已孕小鼠(18只)随机分为小鼠NTDs组(9只)和对照组(9只),NTDs组给予橄榄油溶解的ATRA,按70 mg/kg的浓度灌胃处理,对照组给予同样体积的橄榄油灌胃。于E9.5处死小鼠,剖宫取出胎鼠,于体式显微镜下观察胚胎形态并拍照,样本保存于-80°C冰箱备用。NTDs组共取出胎鼠68只,其中61只存在明显的神经管闭合不全,包括无脑畸形和脊柱裂;对照组共取出胎鼠75只,其中73只胎鼠发育正常。本实验通过中国医科大学附属盛京医院伦理委员会的批准(2021PS831K)。
E9.5胎鼠固定于多聚甲醛中过夜。75%、85%、95%、无水乙醇,梯度酒精脱水;二甲苯透明;浸蜡;包埋。制作4 μm厚石蜡切片,二甲苯脱蜡,梯度酒精复水。抗原修复后,用10%胎牛血清封闭,滴加一抗,4°孵育过夜。室温滴加荧光二抗,孵育2 h,DAPI染色5 min,50%甘油封片,于荧光显微镜下拍照。
用含10%胎牛血清、1% MEM NEAA、100 μg/ml青霉素、100 μg/ml链霉素的MEM培养液,在37°C、5%CO2培养箱中培养小鼠神经干细胞C17.2。构建NOX4过表达质粒(oe-NOX4)和对照(NC)以及NOX4沉默质粒(sh-NOX4 2#、sh-NOX4 3#)和对照(sh-NC)。将细胞接种至6孔板,培养24 h。使用PolyPlusJetPRIME转染试剂,转染NOX4过表达质粒、空载体对照、sh-NC、sh-NOX4 2#、sh-NOX4 3#至C17.2细胞。转染后48 h收集细胞。
从收集E9.5胎鼠和C17.2细胞沉淀中用放射免疫沉淀法提取蛋白质。对照组和NTDs组每个样本均使用3只小鼠胚胎提取蛋白。使用12%的SDS聚丙烯酰胺凝胶电泳分离蛋白样本、电转印至聚偏二氟乙烯膜上,用5%脱脂牛奶封闭1.5 h,滴加一抗4°孵育过夜。次日,TBST洗膜3次,室温下与兔和鼠二抗(1∶5 000)孵育2 h,化学发光显影。
将NOX4过表达质粒、空载体对照、sh-NC、sh-NOX4 2#、sh-NOX4 3#转染至C17.2细胞。取对数生长期细胞,以5 000个细胞/孔接种至96孔板中。设置24 h、48 h、72 h、96 h 4个时间点,每组设置3个重复孔,同时设置不含细胞的空白对照孔。于96孔板内加入新鲜配置的含10 μl CCK8的培养基,37℃培养箱中孵育2 h后,用酶标仪测量波长450 nm处的吸光度值。
采用SPSS 25.0软件进行统计分析。用GraphPad 8.0统计软件作图。采用独立样本t检验进行比较,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
体式显微镜下观察到,E9.5对照组小鼠胚胎发育正常,而NTDs组小鼠脑部可见明显闭合不全的神经管,如图1A箭头所示。免疫荧光染色显示,NTDs小鼠模型中的胚胎神经管存在明显的形态异常,且NOX4在NTDs组中的表达高于对照组(图1B)。Western blot显示NTDs组NOX4的蛋白表达(6.24±2.70)也明显高于对照组(1.00±0.51)(n=9)(图1C、图1D),差异具有统计学意义(P<0.05)。提示NTDs小鼠胚胎中高表达的NOX4在促进NTDs发生中起一定作用。
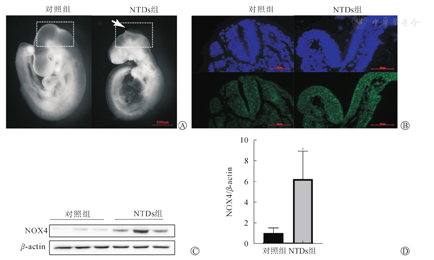

注:aP<0.05
免疫荧光染色显示,增殖相关蛋白PCNA在NTDs组中的表达低于对照组(图2A)。Western blot结果显示增殖相关蛋白PCNA在NTDs中的表达(0.75±0.09)低于对照组(1.00±0.12)(n=8)(图2B、图2C),差异具有统计学意义(P<0.05),提示NTDs中的增殖活性低于正常对照组。
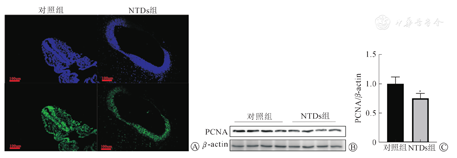

注:aP<0.05
转染NOX4过表达质粒至小鼠C17.2神经干细胞,48 h后采用Western blot检测NOX4和增殖相关蛋白PCNA的表达。结果显示,转染NOX4过表达质粒后NOX4蛋白水平上调,(1.26±0.13)比(1.00±0.02),差异有统计学意义(P<0.05)(图3A、图3B);增殖相关蛋白PCNA的表达下调,(0.71±0.10)比(1.00±0.12),差异有统计学意义(P<0.05)(图3C、图3D),提示NOX4可以抑制神经干细胞的增殖。
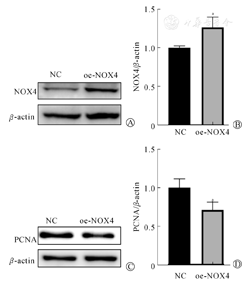

注:aP<0.05
Western blot结果显示,转染NOX4沉默质粒48 h后,sh-NOX4 2#、sh-NOX4 3#两组中NOX4蛋白水平分别为(0.85±0.06)、(0.71±0.06),较sh-NC组的(1.00±0.04)均降低(图4A、图4B),增殖相关蛋白PCNA水平(1.61±0.17)、(1.43±0.17)较sh-NC组(1.00±0.17)增加(图4C、图4D),差异均有统计学意义(P<0.05)。提示沉默NOX4后能促进神经干细胞增殖。
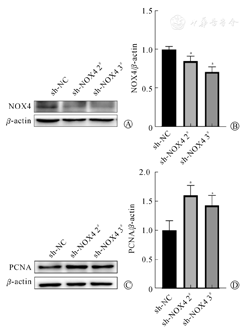

注:aP<0.05
CCK8结果显示,神经干细胞在转染NOX4过表达质粒后,24 h后与NC组相比,吸光度为(0.48±0.01)比(0.48±0.02),48 h为(0.82±0.04)比(1.12±0.03),72 h为(1.07±0.10)比(2.10±0.10),96 h为(2.53±0.20)比(3.01±0.43),第48 h、72 h、96 h增殖能力受到明显抑制,差异有统计学意义(P<0.05,图5A)。相反,神经干细胞在转染sh-NOX4 2#、sh-NOX4 3#后,24 h吸光度分别为(0.32±0.02)、(0.31±0.02)、(0.30±0.01),48 h为(0.77±0.02)、(0.64±0.04)、(0.37±0.04),72 h为(1.94±0.05)、(1.69±0.03)、(1.24±0.08),96 h为(2.33±0.11)、(2.11±0.05)、(2.01±0.01),第48 h、72 h、96 h增殖能力较sh-NC组相比明显升高,差异有统计学意义(P<0.05,图5B)。表明NOX4能够抑制神经干细胞的增殖。
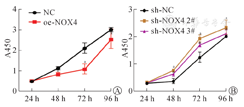

注:aP<0.05
NTDs是遗传和环境共同作用下发生的一种多因素神经系统疾病,典型的临床表现包括无脑畸形和脊柱裂等。然而胎儿NTDs发生机制尚不十分清楚,实验动物模型的建立为揭示NTDs的发生提供了重要依据,已经发现超过300个基因的异常作用可导致NTDs的发生,这些基因能调控细胞增殖、分化、迁移、凋亡等对神经管闭合起重要调控作用的活动,其中包括转录因子PAX3、Cited2、Grhl3等,促凋亡基因Casp3、Casp9、JNK1/2,氧化应激调节因子SOD1、ASK1,平面细胞极性基因VANGL1、VANGL2以及分化调节基因Neurofibromin、Phactr4等[12,13]。此前课题组研究发现miR-322可以通过沉默NOX4,抑制NOX4对细胞凋亡的促进作用,抑制NTDs的发生,而NOX4在神经管闭合过程中对其他生物学功能的调控作用未见报道[11]。近年来对NTDs发病机制的研究主要集中在细胞凋亡,关于细胞增殖与NTDs的研究较少。本研究利用ATRA诱导的小鼠NTDs模型,发现NOX4可以通过抑制细胞增殖过程从而导致NTDs的发生。
细胞增殖对于神经管闭合过程是至关重要的。在神经管闭合过程中,如果神经干细胞增殖能力降低,造成神经管的神经上皮变薄,导致神经管闭合异常和NTDs表型[4]。关于神经形成过程中的细胞增殖已有文献报道,细胞接触抗有丝分裂剂或调控细胞周期的相关基因突变均可以引起NTDs[14]。小鼠胚胎暴露在高糖环境下会影响端脑神经干细胞的存活和增殖,导致糖尿病妊娠胚胎神经管发育异常,且细胞增殖过程中所需嘌呤和嘧啶的产生增加则会促进小鼠神经管闭合[2,15]。也有研究发现,在小鼠胚胎神经管发育过程中,若脑部神经上皮增殖过度,造成神经板增厚也会导致神经管形成失败,形成NTDs表型[16]。在发育早期,神经干细胞的过度增殖也会破坏神经元的发育,最终导致头部区域神经管闭合的严重缺陷[17]。结合本课题组前期的研究,在ATRA诱导的NTDs大鼠模型中,NTDs组畸形发生部位的神经前体细胞在神经管中央区域的增殖率显著低于对照组,可见在ATRA诱导的NTDs模型中存在细胞增殖减少的现象[18]。但ATRA诱导的小鼠NTDs模型中细胞增殖减少的机制尚无报道。本研究中发现,NTDs模型中NOX4表达增多,且可能通过抑制细胞增殖相关蛋白PCNA表达进而导致NTDs的发生。
NOX4作为氧化呼吸链电子传递的物质,其主要生物学功能是生成活性氧(reactive oxygen species,ROS),而ROS与细胞增殖有关,表明NOX4可能通过ROS调节增殖功能[19]。例如,NOX4介导生成的ROS和超氧化物能诱导细胞周期阻滞,从而抑制猪外胚层细胞的增殖[20]。在神经系统的研究中,有研究者发现NOX4介导生成的ROS的累积会导致神经元死亡和损伤增加,导致阿尔兹海默症等神经退行性疾病的发生[21]。本研究中发现在小鼠NTDs模型中NOX4表达增加,增殖相关蛋白PCNA表达减少,提示NOX4可能对神经管闭合过程中的细胞增殖发挥作用。因此,本团队借助对NOX4的过表达或沉默调控,发现NOX4可以通过抑制增殖相关蛋白PCNA的表达,抑制神经干细胞增殖。
由此可见,NOX4可能通过抑制细胞增殖,导致神经管闭合失败及NTDs的发生,为阐明细胞增殖在NTDs发生中的机制提供了新的见解。鉴于NOX4对细胞增殖的调控作用,其有望成为临床上NTDs治疗干预的新靶点。
所有作者均声明不存在利益冲突



























