
分离和培养成人脂肪来源干细胞(hADSC),并观察非接触式细胞体外共培养条件下,hADSC对人胰岛细胞形态、存活率及功能的影响及机制。
采用胶原酶消化法分离并原代培养获得hADSC,形态学、免疫荧光及成骨、成脂诱导分化鉴定hADSC。采用Liberase酶消化及Ficoll 400液分离、纯化成人胰岛细胞,并将胰岛细胞分为共同培养组和单独培养组;倒置相差显微镜观察两组胰岛细胞的生长形态,比较两组体外培养3、7和14 d时的胰岛细胞存活率、胰岛素分泌量、胰岛素刺激指数及培养14 d时上清液中肝细胞生长因子(HGF)、转化生长因子-β(TGF-β)、血管内皮细胞生长因子(VEGF)及碱性成纤维细胞生长因子(b-FGF)浓度。
培养第3代hADSC呈均一的长梭形纤维细胞样形态,免疫荧光检测显示CD44和CD49d为阳性,CD31、CD34和CD106均为阴性;具有成骨、成脂等多向分化潜能。培养14 d时,共同培养组胰岛细胞的形态较单独培养组完整,共同培养组胰岛细胞存活率为(82.83±2.32)%,较单独培养组的(53.00±2.82)%明显提高(P<0.01);共同培养组、单独培养组高糖培养时的胰岛素分泌量分别为(23.66±2.11)mIU/L和(7.82±1.09)mIU/L,低糖培养时分别为(13.22±0.77)mIU/L和(6.40±0.44)mIU/L,两组比较,差异均有统汁学意义(P<0.01);共同培养组胰岛细胞胰岛素刺激指数由培养3 d时的1.90±0.03降为培养14 d时的1.77±0.13,降低不明显;单独培养组由培养3 d时的1.67±0.10降为培养14 d时的1.22±0.12,显著降低(P<0.01)。培养14 d时,共同培养组上清液HGF、TGF-β、VEGF、b-FGF浓度均显著高于单独培养组(P<0.05)。
从成人脂肪组织中能够成功分离及培养hADSC;在体外与人胰岛细胞共同培养时,hADSC可以通过分泌HGF、TGF-β、HGF、b-FGF来提高胰岛细胞的存活率,改善胰岛细胞的功能。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胰岛移植治疗1型糖尿病的埃德蒙顿方案(Edmonton protocol)成功实施以来,临床胰岛移植取得了较大的进展,但仍存在许多困难,其中包括有功能胰岛细胞能否在体外长期保存[1,2,3,4]。研究表明,胰岛经历分离过程的细胞性及非细胞性损伤后,由于缺血、缺氧会很快进入细胞凋亡周期[5,6]。而骨髓等间充质干细胞可通过调控及分泌营养因子、抗凋亡因子、抗炎症因子等改善损伤局部的微环境,从而抑制细胞凋亡、促进细胞存活及发挥功能[7,8]。脂肪干细胞(hADSC)具有与骨髓间充质干细胞等相似的特性,并且来源充足、取材方便[9]。因此,我们将分离、培养的hADSC与纯化后的成人胰岛细胞体外接触式共培养,观察hADSC对体外培养的胰岛存活率及功能的影响,并探讨其作用机制。
脂肪组织来自因疤痕修复需行腹部取皮术患者的腹部皮下脂肪组织,由我院整形外科提供;胰腺组织取自多器官供者。组织供者均无系统性感染、糖尿病及相关疾病,年龄20~40岁,取组织前均经医院伦理委员会审批,并获得患者及其家属知情同意。所获取的组织于4 ℃下用威斯康星大学器官保存液(UW液)冷藏保存。
Ficoll液(400DL型),吖啶橙(AO)及碘化丙啶(PI)荧光染色剂,肝细胞生长因子(HGF)、转化生长因子-β(TGF-β)、血管内皮细胞生长因子(VEGF)、碱性成纤维细胞生长因子(b-FGF)酶联免疫吸附试验(ELISA)检测试剂盒,兔抗人CD31、CD34、CD49d、CD106抗体,以及异硫氰酸荧光素(FITC)或藻红蛋白(PE)标记的羊抗兔二抗均购自美国Sigma公司;胶原酶I、Liberase酶、胎牛血清、RPMI 1640培养液、DMEM/F12培养基均购自美国Gibco公司;间充质干细胞成脂诱导分化培养基及成骨诱导分化培养基购自深圳市百恩维生物科技有限公司;胰岛素放射免疫试剂盒购自中国原子能科学院产。倒置式显微镜及VANOX型荧光显微镜为日本Olympus公司产品,5100型细胞培养箱为美国NAPCC公司产品。
无菌条件下取脂肪组织10 g,超净台内用磷酸盐缓冲液(PBS)反复冲洗以除去血液和组织碎片,剪除筋膜和血管;剪碎脂肪组织至约1 mm3大小;加入0.1 g/L的胶原酶Ⅰ溶液20 ml,于37 ℃水浴震荡消化60 min后,加入等量含体积分数10%胎牛血清的DMEM-F12完全培养基终止消化;167×g离心5 min,弃去上层油和脂肪组织以及上清液;用培养液重悬,75 μm不锈钢筛网过滤,167×g离心5 min;弃去上清液,DMEM-F12完全培养基(含体积分数10%胎牛血清,100 μ/L青霉素,100 μg/L链霉素)重悬细胞,调整细胞密度,以5×104个有核细胞/cm2密度接种于25 ml细胞培养瓶中。置于37 ℃、饱和湿度、含体积分数5%CO2培养箱中培养,视细胞生长状况每2~3 d换液1次。倒置显微镜下观察,当细胞达到80%~90%融合时,用2.5 g/L胰酶+0.2 g/L EDTA消化传代。观察细胞生长情况及形态变化,传代至细胞形态均一、呈克隆化生长状态。
酸化处理的普通盖玻片消毒后放入24孔培养板,将P3代的hADSC悬液接种于盖玻片上,置于37 ℃、饱和湿度、含体积分数5%CO2培养箱继续培养。待细胞均匀铺满孔底,吸出培养液,用PBS冲洗盖玻片,冷风吹干后置于-20 ℃低温冰箱巾冻存,根据hADSC的表面抗原谱免疫荧光法检测hADSC的CD31、CD34、CD44、CD49d、CD106相关抗原。取出玻片后置入湿盒中,用PBS冲洗2次,每次3 min;用40 g/L多聚甲醛于室温下固定30 min,PBS冲洗2次,每次3 min;内源性过氧化物酶阻断剂10 min,用PBS冲洗2次,每次3 min;用10 g/L TritonX-100 2 min,PBS冲洗2次,每次3 min;分别加兔抗人CD31、CD34、CD44、CD49d、CD106 IgG,于4 ℃下过夜,PBS冲洗3次,每次5 min;加PE或FITC标记的羊抗兔IgG荧光二抗,于室温下避光孵育2 h,PBS冲洗3次,每次5 min;避光加1 g/L的4',6-二脒基-2-苯基吲哚(DAPI)染色液于盖玻片上,于室温下避光孵育5 min标记细胞核。甘油封片,指甲油封片周,即刻在荧光显微镜下观察。
(1)hADSC向脂肪细胞诱导分化:取P3代生长均一的hADSC,以5×104/孔接种至6孔板,DMEM-F12完全培养基孵育至80%融合,更换成间充质干细胞成脂诱导分化培养基,开始诱导。以DMEM-F12完全培养基为阴性对照。每3 d更换培养液1次,倒置相差显微镜观察细胞形态变化,并用油红O染色定性观察体外诱导分化的结果。油红O染色定性:取油红O干粉溶于异丙醇溶液中,配成5 g/L油红O储存液,避光保存。按储存液∶蒸馏水=3∶2的比例稀释储存液并过滤,制成油红O染色剂。染色时,细胞弃去原培养液,PBS漂洗1遍,用40 g/L多聚甲醛在4 ℃条件下固定1 h,再用70%异丙醇清洗1遍,加油红O染色剂1.5 ml,于室温下放置20 min,用体积分数60%异丙醇洗去多余的染料,PBS漂洗,倒置相差显微镜下观察细胞内脂滴形成。(2)hADSC向成骨细胞诱导分化:取P3代生长均一的hADSC,以5×104/孔接种至6孔板,DMEM-F12完全培养基孵育至80%融合,更换成间充质干细胞成骨诱导分化培养基,开始诱导。倒置相差显微镜下观察细胞形态变化并茜素红染色鉴定。茜素红染色:成骨诱导14 d,蒸馏水冲洗,体积分数75%酒精固定20~30 min,蒸馏水冲洗后加入20 g/L茜素红孵育10~20 min,用蒸馏水洗去多余的染料,于光镜下观察。
用胰腺体尾部进行胰岛分离,剪去周围脂肪组织和血管后,经胰管插管灌注4 ℃的1.5 g/L的Liberase酶,待胰腺膨胀后剪去包膜及灌注不良的头段。剪碎胰腺组织至约1 mm3大小,于38 ℃水浴振荡消化约15~20 min,用约10倍体积的含100 ml/L胎牛血清的4 ℃Hanks液中止消化,用300 μm不锈钢筛网过滤,收集滤过液至50 ml的离心管,依次加入密度为1.135、1.108、1.096、1.037 g/ml的Ficoll 400分离液各10 ml,其上方缓慢加入收集的滤过液。于4 ℃下375×g离心20 min,吸出1.096~1.108和1.037~1.096 g/ml的界面细胞,于4 ℃下用不含胎牛血清的RPMI 1640培养液,375×g离心5 min,沉淀制成胰岛细胞悬液,备用。
采用胰岛细胞与hADSC非接触式共同培养作为共同培养组,取P3代hADSC接种于Transwell 6孔双层培养板的下室,预先培养3 d。纯化后的胰岛细胞用无血清的RPMI 1640培养液洗涤2遍后重悬,毛细吸管在倒置相差显微镜下手工挑出300个直径在100~300 μm之间的胰岛,以各直径类别与换算指数换算成直径150 μm的胰岛当量(IEQ),加入含体积分数10%胎牛血清的RPMI 1640完全培养液,于Transwell 6孔双层培养板的上室与hADSC共同培养,隔日全量换液。以相同IEQ的胰岛细胞于Transwell 6孔双层培养板的上室单独培养作为单独培养组。两组均在体外培养14 d。
于倒置相差显微镜下观察胰岛细胞的形态变化。体外培养3、7、14 d时,用100 μl微量加样器在每孔板胰岛悬液中反复取样3次,取0.5 g/L的AO 0.01 ml和0.25 g/L的PI 1 ml与胰岛样本混合10 min,在荧光显微镜490 nm激发光滤光片及510 nm光栅滤光片下观察,可同时见到绿色(AO)和红色(PI)荧光,活细胞染绿色,死细胞染红色。在40倍的放大倍数下,每个样本观察3个视野,胰岛的活性按照以下公式计算:绿色荧光细胞数/(红色和绿色荧光细胞数)×100%。
取体外培养第14天时胰岛细胞,为避免胰岛细胞产生的细胞因子对检测结果的影响,在取样前48 h移除Transwell小室上室中的胰岛细胞。每孔板上清液取样100 μl,应用ELISA检测试剂盒检测上清液中HGF、TGF-β、VEGF及b-FGF的浓度。
应用胰岛素放射免疫试剂盒检测胰岛的功能。取共同培养组和单独培养组各6份样本,测定胰岛素释放量。样本先置于含2.7 mmol/L葡萄糖的RPMI 1640培养液中,在37 ℃下孵育30~45 min。然后分别与含低糖(2.7 mmol/L葡萄糖)和高糖(16.7 mmol/L葡萄糖)的RPMI 1640培养液孵育60 min,收集上清液,采用放射免疫法测定胰岛素分泌量(mIU/L),计算胰岛刺激指数(SI)=高糖胰岛素值/低糖胰岛素值,评价胰岛β细胞对葡萄糖刺激的敏感性。
应用SPSS(19.0版)软件进行统计处理,数据以均数±标准差( ±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
倒置相差显微镜下观察hADSC呈贴壁生长,原代培养至14 d时细胞达80%融合,细胞形态不均一,分别呈梭形、多角形、圆形;传至P3代时细胞生长良好,呈典型的均一的长梭形纤维细胞样形态,漩涡状或辐射状生长,与间充质干细胞形态相符(图1)。
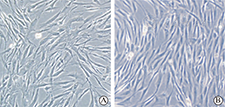

A为原代培养14d;B为培养至P3代
免疫荧光检测显示CD31、CD34和CD106呈阴性反应,CD44和CD49d呈阳性反应,符合hADSC表面抗原谱(图2)。
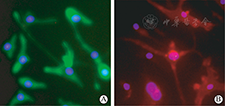

A为CD44;B为CD49d
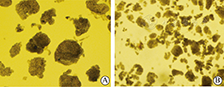
hADSC向脂肪细胞诱导分化后3 d,可见小部分细胞胞浆内出现少量高折光性的细小脂滴,并逐渐聚集,诱导分化后6 d,部分细胞形态发生明显改变,从长梭形类成纤维细胞外观逐渐变圆,并开始出现充满脂滴的细胞,油红O染色阳性,未加成脂诱导剂的阴性对照组则为梭形细胞形态(图3)。hADSC向成骨细胞诱导分化3~4 d,细胞形态由长梭形变为扁圆形,细胞核变圆,细胞体积增大,长轴缩短,胞膜有多个伪足伸展,细胞外基质有少量钙盐沉积,有些形成钙结节,随着诱导时间的延长,钙盐沉积增加,成骨诱导14 d细胞外基质大量钙盐沉积,未加成骨诱导剂的阴性对照组则为梭形细胞形态(图4)。


A为hADSC成脂诱导分化6 d细胞形态;B为hADSC成脂诱导分化6 d油红O染色阳性;C为阴性对照

A为成骨细胞诱导分化4 d细胞形态;B为hADSC成骨诱导14 d茜素红染色阳性;C为阴性对照
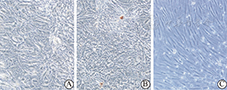
倒置显微镜下可见,培养开始时两组胰岛细胞均呈边界清楚的椭圆形细胞团,折光性能良好。培养14 d时共同培养组胰岛细胞团无明显退化,结构完整,边界仍清楚,多贴附于hADSC生长;单纯培养组胰岛细胞明显退化,细胞团减少,多形成细胞碎片,折光性能差(图5)。

A为共同培养组;B为单纯培养组
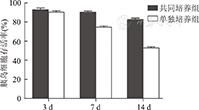
两组胰岛细胞存活率均随培养时间的延长逐渐下降,共同培养组胰岛细胞存活率由培养3 d时的(92.83±2.48)%降为培养14 d时的(82.83±2.32)%(P<0.01);单独培养组胰岛细胞存活率由培养3 d时的(90.33±1.86)%降为培养14 d时的(53.00±2.82)%(P<0.01);培养14 d时,单独培养组胰岛细胞存活率显著低于共同培养组,两组比较,差异有统计学意义(P<0.01,图6)。

培养第14 d时,共同培养组上清液中HGF、TGF-β、VEGF和b-FGF浓度分别为(21.17±5.56)ng/L、(21.65±7.09)ng/L、(27.67±7.58)ng/L和(16.50±7.06)ng/L,均显著高于单独培养组的(7.33±3.61)ng/L、(11.33±5.16)ng/L、(5.33±2.58) ng/L和(9.17±2.32)ng/L,两组比较,差异均有统计学意义(P<0.01,图7)。
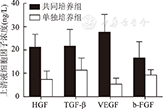

HGF为肝细胞生长因子,TGF-β为转化生长因子-β,VEGF为血管内皮细胞生长因子,b-FGF为碱性成纤维细胞生长因子
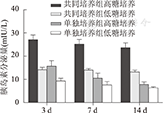
随着培养时间的延长,两组胰岛素分泌量均逐渐降低。共同培养组高糖培养的胰岛素分泌量由培养3 d时的(27.07±2.10)mIU/L降为培养14 d时的(23.66±2.11)mIU/L(P>0.05),低糖培养的胰岛素分泌量由培养3 d时的(14.16±1.07)mIU/L降为培养14 d时的(13.22±0.77)mIU/L(P>0.05);单独培养组高糖培养的胰岛素分泌量由培养3 d时的(15.70±2.40)mIU/L降为培养14 d时的(7.82±1.09)mIU/L(P<0.01),低糖培养的胰岛素分泌量由培养3 d时的(9.34±1.15)mIU/L降为培养14 d时的(6.40±0.44) mIU/L(P<0.01);培养14 d时,单独培养组高糖和低糖培养的胰岛素分泌量均显著低于共同培养组低糖培养的胰岛素分泌量,差异均有统计学意义(P<0.01,图8)。

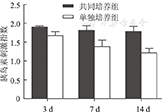
随着培养时间的延长,共同培养组胰岛细胞对葡萄糖刺激的敏感度降低不明显,胰岛素刺激指数由培养3 d时的1.90±0.03降为培养14 d时的1.77±0.13(P>0.05);单独培养组的胰岛素刺激指数由培养3 d时的1.67±0.10降为培养14 d时的1.22±0.12(P<0.01);培养14 d时,两组胰岛素刺激指数的比较,差异有统计学意义(P<0.01,图9),共同培养组胰岛素刺激指数优于单独培养组。

随着临床胰岛移植的进展,亦出现许多制约胰岛移植发展的因素,其中包括胰岛组织来源不足。如果能够实现胰岛细胞在体外长期有功能的保存,将会为选择合适的需胰岛移植的患者提供最佳机会,延长移植胰岛存活时间,从而提高胰岛细胞的利用率。目前主要有体外培养和冷冻保存两种保存胰岛细胞的方式,这两种保存方式均会导致胰岛细胞的数量和功能损失[10,11]。研究表明,胰岛细胞在获取、分离及纯化过程中,由于缺血、缺氧及胰腺消化后释放的各种酶,均可引起胰岛的细胞性及非细胞性损伤,导致胰岛细胞微环境破坏及凋亡[5,6]。因此,为分离的胰岛细胞创造一个适宜的微环境以保持其生物活性,减少其凋亡已成为胰岛保存面临的一个重要课题。
脂肪干细胞属于间充质干细胞的一种,是从脂肪组织中分离得到的一群多能干细胞,和骨髓间充质干细胞等比较,其在细胞增殖、细胞老化、多分化潜能及表面抗原特性等方面没有显著性差异,但与骨髓干细胞(BMSC)相比,hADSC细胞有取材方便、来源充足及对供者损伤小等优点[12,13]。本实验中,我们成功分离、培养了hADSC,其形态学、表面抗原及多向分化潜能鉴定符合文献报道的hADSC的特性。研究证实,和BMSC一样,hADSC亦能分泌大量的HGF、VEGF、TGF-β和b-FGF等营养因子及聚集素蛋白、胶原蛋白、层粘连蛋白等细胞间质组分,这些营养因子及细胞间质组分除具有广泛的营养支持作用外,还直接参与细胞的黏附、维持组织结构的完整性及细胞功能的表达,从而改善损伤局部的微环境,抑制细胞凋亡[14,15]。Bhang等[16]研究亦曾报道了在纤维蛋白凝胶中共移植hADSC和胰岛细胞的相互作用,结果显示hADSC可以通过分泌多种生长因子促进胰岛细胞活性。因此,根据hADSC的旁分泌特性,我们建立了和胰岛细胞的非接触式共同培养体系,以期通过hADSC分泌的细胞因子来改善胰岛细胞的生存及功能。
关于hADSC分泌的HGF、VEGF、TGF-β、b-FGF等细胞因子对胰岛细胞产生保护作用的机制,目前认为主要有两个方面:(1)上述细胞因子与其在胰岛细胞表面的受体结合后可通过PLCγ-PKC-Raf-MEK-ERK信号通路,将信号传递至核内,激活DNA的合成,促进胰岛细胞增殖[17];(2)上述细胞因子与其在胰岛细胞表面的受体结合后通过磷脂酰肌醇-3激酶(PI-3K)通路激活抗凋亡激酶PKB/Akt,促进抗凋亡基因Bcl-2表达,抑制凋亡基因Bax、caspase-3等的表达,从而发挥抗凋亡作用,维持胰岛细胞存活[18]。Dai等[19]研究胰岛β细胞HGF受体基因敲除的小鼠发现,相对于对照组,胰岛β细胞HGF受体基因敲除的小鼠出现了胰岛体积缩小,胰岛素分泌功能障碍,这证实了HGF与其受体结合后的下游信号对胰岛的生长及胰岛素的分泌具有重要作用。Fiaschi-Teasch等[20]的研究证实,HGF与胰岛细胞HGF受体结合后,除可以通过PI-3K-PKB/Akt通路促进胰岛细胞存活、抑制胰岛细胞凋亡外,还可通过PI-3K-PKB/Akt通路调节胰岛素分泌、促进胰岛移植物功能的改善。以上研究亦进一步佐证了hADSC分泌的细胞因子对胰岛细胞具有保护作用。
本研究中我们发现,培养14 d时,hADSC+胰岛细胞共同培养组胰岛细胞团无明显萎缩,边界仍然清楚,单纯培养组的胰岛呈明显退化趋势,细胞碎片增多,细胞团减少,折光性较差;随着时间的延长,单独培养组胰岛细胞存活率、胰岛素分泌量较共同培养组下降更明显;胰岛素刺激指数在共同培养组下降不明显,而单独培养组显著降低;并且共同培养组上清液HGF、VEGF、TGF-β、b-FGF浓度均显著高于单独培养组。
综上所述,我们证实hADSC体外与胰岛细胞共同培养可以通过hADSC旁分泌作用来提高胰岛细胞的存活率,改善胰岛细胞功能,有利于胰岛细胞长期保存。但本实验在hADSC对胰岛细胞保护机制方面还存在不足,需在以后实验中进一步研究。



























