
建立一种基于不同肝癌肝移植标准的术后长期存活模型(MHCAT),并应用全国肝细胞肝癌(HCC)肝移植数据对其进行验证。
对223例HCC肝移植受者的长期随访资料进行回顾性、多因素分析,建立基于米兰标准、UCSF标准、上海复旦标准及杭州标准4种肝癌肝移植标准的长期预后模型MHCAT,进而使用中国肝移植注册(CLTR)系统中肝移植术后超过5年的1371例HCC肝移植受者数据,验证MHCAT对于肝移植长期存活的预测效能。
除肝癌肝移植标准外,术前甲胎蛋白和胆红素总量水平、术中出血量及再次移植是HCC肝移植长期存活的独立预测因素。1 371例HCC肝移植受者纳入MHCAT的验证分析,中位随访时间22.2个月(6.1~72.4个月)。其中,符合米兰标准、UCSF标准、上海复旦标准及杭州标准的受者分别为34.4%、39.7%、44.2%和51.9%,使用基于上述标准的MHCAT预测肝移植术后3年和5年存活率的c-statistic分别为0.712~0.727和0.726~0.741,基于不同标准的MHCAT其预测效能的差异均无统计学意义(P>0.05)。进一步将MHCAT的预测效能与Metroticket公式进行对比分析,基于米兰标准、UCSF标准和上海复旦标准的MHCAT预测肝移植术后3年存活率的效能显著高于Metroticket(P<0.05),而基于任何标准的MHCAT预测5年存活率的效能与Metroticket的差异无统计学意义(P>0.05)。
MHCAT对于中国HCC肝移植术后长期存活率具有良好的预测效能,对HCC肝移植受者术后风险的评估具有指导意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前,国际上通常采用较为严格的标准限定可以接受肝移植的肝细胞肝癌(HCC)患者,以期获得与良性终末期肝病相当的长期存活率,但同时也使得一部分HCC患者失去肝移植的机会,因而HCC肝移植的标准一直存在争议。从米兰标准到加州大学旧金山分校(UCSF)标准,再到肿瘤数目与最大直径之和不超过7(up-to-seven)标准[1,2,3,4,5],肝移植医生一直在尝试寻找扩大肝癌肝移植标准和维持良好长期存活率间的最佳平衡点。有资料表明,不同地域、不同分配方案都会对肝移植术后长期效果造成影响[6]。我国肝移植专家在总结国内肝移植资料的基础上,提出了上海复旦标准、杭州标准等扩大的肝癌肝移植标准。以上各标准侧重于肝癌的形态学指标,较少涉及肿瘤的生物侵袭性。本研究中,我们在米兰标准、UCSF标准、上海复旦标准及杭州标准的基础上,结合围手术期潜在危险因素,建立基于上述不同标准的肝癌肝移植长期存活预测模型(MHCAT),进一步通过中国肝移植注册(CLTR)数据库记录的大样本HCC病例,将MHCAT与up-to-seven标准中的Metroticket公式进行对比,验证MHCAT在我国HCC肝移植术后长期存活预测中的有效性。
本研究中包含1个建模队列和1个验证队列,并保证2个队列中所有长期存活的肝癌肝移植受者的随访时间超过5年。
选取2001年1月到2006年12月223例在我院接受成人HCC肝移植的受者,建立肝移植术后的MHCAT。
选取2008年6月前CLTR记录的5 740例成人HCC肝移植受者,排除标准:(1)儿童肝移植;(2)器官联合移植;(3)排除原发病为胆管细胞性肝癌,肝细胞和胆管细胞混合性肝癌,以及其他恶性肝脏肿瘤的肝移植受者;(4)在肝移植术中意外发现HCC的受者。为验证MHCAT在HCC肝移植术后长期生存的预测效能,我们进一步设定以下排除标准:(1)在我院实施肝移植的受者;(2)MHCAT所涉及的因素(米兰标准、UCSF标准、上海复旦标准、杭州标准,术前甲胎蛋白和胆红素总量水平,再次移植史,术中出血量)中任意缺失的受者;(3)随访时长小于5年,且最后随访状态为存活的受者;(4)存活情况不完整(包括生存状态和随访日期的缺失或不明)的受者。最终1371例HCC肝移植受者纳入验证队列。所有受者均签署知情同意书,并经我院伦理委员会批准,以及获得CLTR科学委员会批准使用全国数据资料。
建模队列中的病例资料由2名专职随访员收集,并按照CLTR数据库规定在每例肝移植完成后48 h内上传CLRT系统,定期追踪每例受者的存活情况并及时更新。验证队列中的资料来自CLTR系统中的81家肝移植中心和7家随访医院,数据收集和上传均遵循CLTR相关规定。米兰标准、UCSF标准、上海复旦标准及杭州标准见文献[1,4,7,8],并根据肝移植术中病肝的病理报告对肿瘤数目、最大直径及血管侵犯情况进行校正。Metroticket预测3年和5年存活率通过Metroticket在线计算工具http://www.hcc-oltmetroticket.org/calculator输入肿瘤相关指标获得。
本研究主要终点事件为受者术后3年和5年的生存情况。MHCAT通过多因素分析,运用Cox比例风险模型生成。MHCAT的验证由CLTR 2名统计学专家独立完成,并经另1名资深统计学专家审核,作为研究者,我们只能提供MHCAT相关公式、资料以及研究方案,对预验证队列数据和统计分析不能做任何干预。使用SAS V9.2统计软件对数据进行处理,连续变量以均数±标准差( ±s)或中位数(四分位距IQR)表示,分类变量以频数(%)表示,使用受试者工作特征(ROC)曲线检验MHCAT和Metroticket的预测效能,采用Kruskal-Wallis分析比较二者ROC曲线下面积的差异(c-statistic),利用ROC曲线的最高Youden指数获得区分长期生存最大差异分组的截断值,通过Kaplan-Meier方法以及log-rank检验进行高危组和低危组患者的生存分析。以双尾法确定P值,P<0.05为差异有统计学意义。
±s)或中位数(四分位距IQR)表示,分类变量以频数(%)表示,使用受试者工作特征(ROC)曲线检验MHCAT和Metroticket的预测效能,采用Kruskal-Wallis分析比较二者ROC曲线下面积的差异(c-statistic),利用ROC曲线的最高Youden指数获得区分长期生存最大差异分组的截断值,通过Kaplan-Meier方法以及log-rank检验进行高危组和低危组患者的生存分析。以双尾法确定P值,P<0.05为差异有统计学意义。
1.建模队列:223例受者均为ABO血型相容肝移植,平均随访时间为46.31个月,建模队列的人口学及临床特征见表1。同期我中心共施行502例肝移植,HCC是最主要的适应证(占44.4%)。受者术后1、3和5年存活率分别为78.9%、53.2%和46.4%,无肿瘤复发存活率分别为77.4%、52.6%和45.8%。223例受者中,135例超出米兰标准(60.5%),符合复旦标准(52.0%)和杭州标准(64.6%)的受者比例显著高于符合米兰标准的受者比例(P<0.05),符合杭州标准的受者比例均显著高于其他标准(P<0.01,表2)。
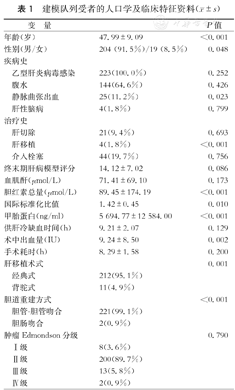
建模队列受者的人口学及临床特征资料( ±s)
±s)
建模队列受者的人口学及临床特征资料( ±s)
±s)
| 变 量 | P值 | ||
|---|---|---|---|
| 年龄(岁) | 47.99±9.09 | <0.001 | |
| 性别(男/女) | 204 (91.5%)/19 (8.5%) | 0.048 | |
| 疾病史 | |||
| 乙型肝炎病毒感染 | 223(100.0%) | 0.252 | |
| 腹水 | 144(64.6%) | 0.426 | |
| 静脉曲张出血 | 25(11.2%) | 0.023 | |
| 肝性脑病 | 4(1.8%) | 0.799 | |
| 治疗史 | |||
| 肝切除 | 21(9.4%) | 0.693 | |
| 肝移植 | 4(1.8%) | <0.001 | |
| 介入栓塞 | 44(19.7%) | 0.756 | |
| 终末期肝病模型评分 | 14.12±7.02 | 0.086 | |
| 血肌酐(μmol/L) | 71.41±69.10 | 0.173 | |
| 胆红素总量(μmol/L) | 89.45±174.19 | <0.001 | |
| 国际标准化比值 | 1.42±0.45 | 0.010 | |
| 甲胎蛋白(ng/ml) | 5 694.77±12 584.00 | <0.001 | |
| 供肝冷缺血时间(h) | 9.21±2.07 | 0.129 | |
| 术中出血量(IU) | 9.24±8.50 | 0.002 | |
| 手术耗时(h) | 8.29±1.58 | 0.200 | |
| 肝移植术式 | 0.001 | ||
| 经典式 | 212(95.1%) | ||
| 背驼式 | 11(4.9%) | ||
| 胆道重建方式 | <0.001 | ||
| 胆管-胆管吻合 | 221(99.1%) | ||
| 胆肠吻合 | 2(0.9%) | ||
| 肿瘤Edmondson分级 | 0.790 | ||
| Ⅰ级 | 8(3.6%) | ||
| Ⅱ级 | 200(89.7%) | ||
| Ⅲ级 | 13(5.8%) | ||
| Ⅳ级 | 2(0.9%) | ||
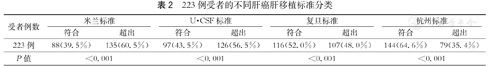
223例受者的不同肝癌肝移植标准分类
223例受者的不同肝癌肝移植标准分类
| 受者例数 | 米兰标准 | U·CSF标准 | 复旦标准 | 杭州标准 | ||||
|---|---|---|---|---|---|---|---|---|
| 符合 | 超出 | 符合 | 超出 | 符合 | 超出 | 符合 | 超出 | |
| 223例 | 88(39.5%) | 135(60.5%) | 97(43.5%) | 126(56.5%) | 116(52.0%) | 107(48.0%) | 144(64.6%) | 79(35.4%) |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | ||||
2.验证队列:1371例受者中,男性1245例,女性126例,年龄(49.8±9.1)岁,中位随访时间为22.2个月(6.1~72.4个月),其中接受亲属活体供肝移植的受者62例(4.5%)。术后1、3和5年存活率分别为63.1%、43.8%和37.6%,无肿瘤复发存活率分别为55.8%、40.4%和35.7%。研究期中,共有748例受者死亡。仅34.4%的受者符合米兰标准,在米兰标准基础上UCSF标准、复旦标准、杭州标准分别将受者群体扩大了15.5%、28.5%和51.3%。
对建模队列223例受者进行单因素分析显示,受者年龄、性别、静脉出血史、再次移植史、胆红素总量(TBil)、国际标准化比值(INR)、甲胎蛋白水平、术中出血量、移植手术方式(经典式或背驮式)、胆道吻合方式以及4种肝癌肝移植标准均与肝移植的预后相关(表1)。将4种标准分别与其他单因素分析中有统计学意义的预测因素代入Cox比例风险模型,对于4种标准,选择符合标准的受者作为参考组,对于其他预测因素中的计量数据和计数数据,分别以最小值和百分比最高者作为参考组,采用后退法建立基于4种不同标准的MHCAT,MHCAT评分公式及根据MHCAT评分预测肝移植术后3和5年存活率的公式见表2。以米兰标准、UCSF标准和上海复旦标准为基础的MHCAT中,术前甲胎蛋白水平、术中出血量及再次移植是受者长期存活的独立预测因素,而以杭州标准为基础的MHCAT中,术前胆红素总量、术中出血量、再次移植是影响受者长期存活的独立危险因素。分别对4种MHCAT进行ROC曲线分析,曲线下面积c-statistic达0.773~0.824,Kruskal-Wallis检验显示基于不同标准的MHCAT的c-statistic无统计学差异(P>0.05)。
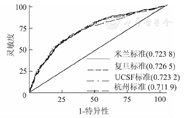
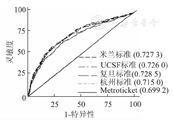
验证队列1 371例受者中,与MHCAT有关的受者特征见表4。使用基于米兰标准、UCSF标准、上海复旦标准、杭州标准的MHCAT对1 371例受者的长期存活进行预测,并与受者的实际存活情况对照,ROC曲线分析显示(图1、图2),基于上述标准的MHCAT预测肝移植术后3年存活率的c-statistic分别为0.724、0.723、0.727、0.712,5年存活率的c-statistic分别为0.737、0.737、0.741、0.726,基于不同标准的MHCAT的预测效能间的差异均无统计学意义(P>0.05)。



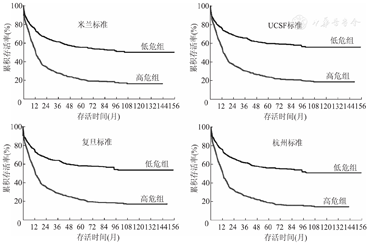
根据MHCAT预测术后长期存活的ROC曲线,基于米兰标准、UCSF标准、上海复旦标准、杭州标准的MHCAT评分的截断值分别为2.085、1.689、1.479、1.331,根据截断值将1 371例受者分为低危组和高危组,生存分析显示基于米兰标准的MHCAT低危组受者肝移植术后3和5年存活率分别为61.4%和55.5%,基于UCSF标准的MHCAT低危组受者分别为65.8%和59.8%,基于复旦标准的MHCAT低危组受者分别为64.3%和58.6%,基于杭州标准的MHCAT低危组受者分别为62.2%和56.5%,基于任何标准的MHCAT高危组受者3年存活率均低于30%,5年存活率更低,基于4种标准的MHCAT低危组受者的长期存活率显著高于高危组(图3,P<0.001)。

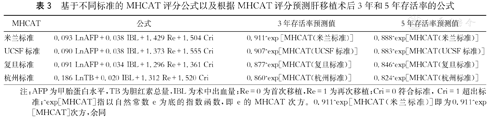
基于不同标准的MHCAT评分公式以及根据MHCAT评分预测肝移植术后3年和5年存活率的公式
基于不同标准的MHCAT评分公式以及根据MHCAT评分预测肝移植术后3年和5年存活率的公式
| MHCAT | 公式 | 3年存活率预测值 | 5年存活率预测值 |
|---|---|---|---|
| 米兰标准 | 0.093 LnAFP+0.038 IBL+1.429 Re+1.504 Cri | 0.911^exp[MHCAT(米兰标准)] | 0.888^exp[MHCAT(米兰标准)] |
| UCSF标准 | 0.090 LnAFP+0.038 IBL+1.373 Re+1.555 Cri | 0.907^exp[MHCAT(UCSF标准)] | 0.883^exp[MHCAT(UCSF标准)] |
| 复旦标准 | 0.091 LnAFP+0.034 IBL+1.296 Re+1.361 Cri | 0.877^exp[MHCAT(复旦标准)] | 0.846^exp[MHCAT(复旦标准)] |
| 杭州标准 | 0.186 LnTB+0.020 IBL+1.312 Re+1.520 Cri | 0.860^exp[MHCAT(杭州标准)] | 0.824^exp[MHCAT(杭州标准)] |
注:AFP为甲胎蛋白水平,TB为胆红素总量,IBL为术中出血量;Re=0为首次移植,Re=1为再次移植;Cri=0符合标准,Cri=1超出标准;^exp[MHCAT]指以自然常数e为底的指数函数,即e的MHCAT次方。0.911^exp[MHCAT(米兰标准)]即为0.911^exp[MHCAT]次方,余同
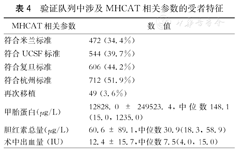
验证队列中涉及MHCAT相关参数的受者特征
验证队列中涉及MHCAT相关参数的受者特征
| MHCAT相关参数 | 数 值 |
|---|---|
| 符合米兰标准 | 472 (34.4%) |
| 符合UCSF标准 | 544 (39.7%) |
| 符合复旦标准 | 606 (44.2%) |
| 符合杭州标准 | 712 (51.9%) |
| 再次移植 | 49 (3.6%) |
| 甲胎蛋白(μg/L) | 12828.0 ± 249523.4,中位数148.1(15.0, 1235.0) |
| 胆红素总量(μg/L) | 60.6 ± 89.1,中位数30.9(18.3, 58.9) |
| 术中出血量(IU) | 12.4 ± 15.7,中位数7.5(4.0, 15.0) |
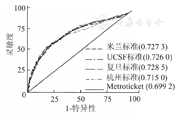
1 371例受者中有73例因肿瘤个数或最大直径等数据的缺失或异常致使无法得到Metroticket的术后3和5年存活率预测值,最终1 298例受者纳入MHCAT和Metroticket对比分析。将Metroticket与基于4种标准的MHCAT获得的3和5年存活率预测值与受者实际存活率对照,建立ROC曲线,应用Metroticket预测3和5年存活率的c-statistic分别为0.699和0.738。使用Kruskal Wallis检验对MHCAT和Metroticket的c-statistic进行对比分析发现,基于米兰标准、UCSF标准和上海复旦标准的MHCAT预测术后3年存活率的c-statistic显著高于Metroticket(P<0.05,图4),而5年存活率的c-statistic与Metroticket的差异均无统计学意义(P>0.05,图5)。


截至2014年底,我国已实施肝移植超过26 000例,成为仅次于美国的肝移植第二大国,但肝移植术后5年存活率明显低于美国和欧洲(60.5%与73.7%、73.0%),我国肝移植整体长期存活率偏低主要在于肝癌肝移植的疗效明显劣于美国和欧洲(49.7%与67.5%、64.0%),究其原因,一方面由于我国肝癌肝移植的比例显著高于美国和欧洲(40%与20.9%、16%),另一方面,我国65.6%的肝癌受者肝移植时已超出米兰标准[9,10,11]。
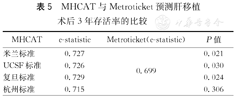
MHCAT与Metroticket预测肝移植术后3年存活率的比较
MHCAT与Metroticket预测肝移植术后3年存活率的比较
| MHCAT | c-statistic | Metroticket(c-statistic) | P值 |
|---|---|---|---|
| 米兰标准 | 0.727 | 0.699 | 0.021 |
| UCSF标准 | 0.726 | 0.030 | |
| 复旦标准 | 0.729 | 0.024 | |
| 杭州标准 | 0.715 | 0.306 |
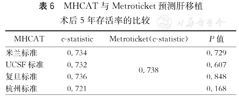
MHCAT与Metroticket预测肝移植术后5年存活率的比较
MHCAT与Metroticket预测肝移植术后5年存活率的比较
| MHCAT | c-statistic | Metroticket(c-statistic) | P值 |
|---|---|---|---|
| 米兰标准 | 0.734 | 0.738 | 0.729 |
| UCSF标准 | 0.732 | 0.607 | |
| 复旦标准 | 0.736 | 0.848 | |
| 杭州标准 | 0.721 | 0.168 |
近20年来的肝移植临床实践证明,符合米兰标准的肝癌受者接受肝移植治疗可以获得与良性肝病肝移植相当的长期存活率,在这一思路的基础上,其他扩大的肝癌肝移植标准陆续提出,其目的是保证良好长期存活率的前提下,尽可能使更多的肝癌受者获益于肝移植。由于供肝的稀缺,10多年前,米兰标准成为美国器官联合共亨网络(UNOS)评价肝癌受者优先政策的工具,并被国际上许多移植中心作为肝癌肝移植的指征,更多的移植中心则进一步探索扩大的肝癌肝移植标准在受者术前筛选中的作用。但无论是米兰标准还是扩大的肝移植标准,其"非是则否"的二元判定过于武断,尤其是当这种标准作为肝癌肝移植资格准入的条件时,一刀切的方式让一些完全有可能痊愈的受者彻底失去了肝移植的机会,因而引起了很大的争议。另外,仅仅依靠肿瘤数目、大小及主要血管侵犯来判定术后肿瘤复发风险并不全面,越来越多的证据表明甲胎蛋白、微癌栓、术前肿瘤对介入栓塞化疗(TACE)的反应等因素都是影响肝移植术后长期存活的独立危险因素,因此,在肝癌肝移植潜在受者的筛选中,一种可量化的按照术后存活几率进行排序的方式可能更为合理和公平。MHCAT结合了以肿瘤形态学为基础的肝癌肝移植标准,以及反映肿瘤生物侵袭性的甲胎蛋白,尤其是术中出血量作为独立的危险因素,可能反映了对于肿瘤复发具有重要意义的循环肿瘤细胞,与以往单纯的肝癌肝移植标准相比,对于HCC肝移植术后长期存活的预测效能更佳。
有了米兰标准的成功经验,很多研究者提出了各自的标准,有些是在米兰标准的基础上,扩大肿瘤数目和直径的限制,有些则加入了其他的变量,这导致肝癌肝移植标准的混乱,不利于指南的完善,而且,现行的供肝分配方案多以米兰标准为基础,如果贸然改变,将导致分配系统的混乱。本研究中,MHCAT可以在不改变米兰标准的基础上,增加一些变量,从而获得MHCAT评分,而且米兰标准和其他变量的系数关系是确定的,对于分配系统的调整可以较为简单和顺利的完成。MHCAT的另一个优势在于可以在4种肝癌肝移植标准基础上分别对一个特定的患者进行评分,由于术前影像学检查存在精度的误差,一定会对肿瘤数目和直径产生低估,当1例患者按照米兰标准可能处于符合和超出的临界点,这种情况下,可以按照基于UCSF标准的MHCAT进行评分,一定程度上弥补了术前影像学评估误差导致符合或超出肝移植标准的误判。
MHCAT系统的局限之处在于术中出血量作为术中危险因素,影响了HCC肝移植潜在供者术前筛选的效能,需要找到合适的术前替代指标,如循环肿瘤细胞等生物侵袭性标志物。另外,由于我国肝癌肝移植受者中超出米兰标准的比例很高,因而整体存活率偏低,通过目前的截断值区分出来的低危组,其5年存活率也只是在55%~60%,我们下一步可以进一步对低危组进行分层,找到使部分受者5年存活率超过65%的更佳截断值。
综上所述,本研究证实MHCAT对HCC肝移植术后长期存活具有良好的预测效能,与目前国际上最权威的预测模型Metroticket相比,MHCAT对5年存活率的预测与Metroticket的差异无统计学意义,而对3年存活率的预测则优于Metroticket。



























